谷氨酰胺诱导热休克蛋白70在缺氧性肺动脉高压新生大鼠中的保护作用研究
赵 婷,王彦梅,王 乐
(新疆医科大学第一附属医院新生儿科,乌鲁木齐 830054)
缺氧性肺动脉高压(hypoxia induced pulmonary hypertension,HPH)是引起新生儿持续缺氧和发绀的危重疾病,救治困难,病死率高。本课题组前期研究发现,缺氧时缺氧诱导因子-1α(hypoxia inducible factor-1 alpha,HIF-1α)的表达增强,通过对其下游靶基因内皮素-1(endothelin-1,ET-1)和诱导型一氧化氮合酶(Inducible nitric oxide synthase,iNOS)的调控,导致肺血管舒缩因子之间失衡,在新生儿HPH的发病中占重要地位[1-2]。针对新生儿HPH的有效治疗方法仍在不断研究,而热休克蛋白70(heat shock protein70,HSP70)能够促进HIF-1α的降解[3]。动物实验研究显示[4-5],腺病毒诱导HSP70表达,促进HIF-1α的降解,阻断其下游靶基因ET-1、iNOS的作用而延缓HPH的发生发展。但因其有毒有害,限制了临床应用。谷氨酰胺(Glutamine,Gln)可诱导HSP70表达,对多种细胞和器官损伤具有明显的保护作用。本研究拟在前期研究基础上初步探讨谷氨酰胺在新生大鼠缺氧性肺动脉高压中的保护作用。
1 材料与方法
1.1 实验动物选择Wistar新生大鼠(实验动物许可证号:SCXK(新)2011-0004)84只,日龄7~10 d,体质量30~40 g,由新疆医科大学第一附属医院医学研究中心动物实验研究部提供。
1.2 仪器与试剂氧浓度测定仪(杭州利华科技有限公司,型号:CY-100B);小动物呼吸机(成都泰盟科技有限公司,型号:HX-200);光学显微镜(日本奥林巴斯公司);电泳仪、电转仪(美国 BIO-RAD 公司)。Gln由北京索莱宝科技有限公司提供;HSP-70 单克隆抗体,HIF-1α、ET-1、iNOS 多克隆抗体(美国Thermo 公司)。
1.3 分组及新生大鼠缺氧性肺动脉高压模型建立84只新生大鼠随机分为2组:对照组和缺氧性肺动脉高压(HPH)组,HPH组包括模型组、盐水组、谷氨酰胺(Gln)组,各组再分为缺氧 3、7、14 d 3个亚组,每个亚组7只新生大鼠。HPH组中盐水组和Gln组新生大鼠通过尾静脉注射同等剂量无菌盐水、Gln注射液,Gln溶于生理盐水中配成3%的溶液,按0.75 g/kg注射,1次/d,连续3 d,后立即将新生大鼠与其母鼠放于常压缺氧舱内建立新生儿缺氧性肺动脉高压模型[6],将 8% 氮氧混合气体输入缺氧舱内,持续监测氧浓度8 h,保持舱内氧浓度在8%~10%波动,氧舱内条件要求:舱内清洁、空气干燥,每天保持昼/夜分布均匀(12 h/12 h),一直持续到造模后3 d、7 d、14 d。对照组新生大鼠和母鼠在常压氧舱内饲养,饲养条件一致,在舱内放置时间一致,对照组舱内氧浓度是正常空气下的氧浓度。对各组新生大鼠同期分别于缺氧第3、7、14天检测相关指标。
1.4 新生大鼠肺动脉压力监测各组新生大鼠在缺氧第3、7、14天测定肺动脉压力(mPAP),用10%水合氯醛溶液1.5 mL/kg腹腔注射麻醉,仰卧位固定在手术台上,纵行切开气管正中皮肤约2 mm长度,分离显露气管,静脉套管针(14号)置入气管,与小动物呼吸机连接,保证新生大鼠呼吸稳定,新生大鼠尾部血氧饱和度监测在90%~95%波动,在胸骨前方做U型切口暴露胸腔,用小儿静脉穿刺针逆血流方向刺入肺动脉根部,同时连接压力传感器监测mPAP变化,记录数值。
1.5 肺动脉组织结构及肺血管重塑指标变化监测新生大鼠测压后处死,迅速切取右肺组织,4%多聚甲醛固定1周后常规石蜡固定、浸蜡、包埋、切片,每只新生大鼠选取肺组织切片3张,进行苏木精-伊红(HE)染色。光学显微镜下观察肺动脉组织结构变化。用病理图像分析软件测定肺血管中层壁厚(MT)、肺小血管外径(ED)、肺血管壁中层横截面积(MA)和总横截面积(TAA),肺动脉血管壁中层壁厚占外径的百分比(MT%)、中层横截面积占血管总横截面积的百分比(MA%)作为肺血管重塑指标,监测其变化。
1.6 HSP70、缺氧诱导因子-1α(HIF-1α)、内皮素-1(ET-1)、诱导型一氧化氮合酶(iNOS)在肺组织中蛋白质表达在不同缺氧时间点测定完肺血管压力后,处死新生大鼠,快速留取肺组织100 mg,放入液氮中转移至-80℃冰箱备用,实验时在肺组织块中加蛋白裂解液,匀浆、离心、取上清液,加上缓冲液,变性、离心,取样品至变性聚丙烯酰胺不连续凝胶电泳(SDS-PAGE),恒压电泳(100 V)下,将蛋白质转移至聚偏二氟乙烯(PVDF)膜上,取膜清洗后加入封闭液进行1 h常温封闭,清洗封闭液,将一抗溶液HSP70:1∶1 000,HIF-1α:1∶500,iNOS:1∶200,ET-1:1∶500 稀释比例加入,4℃孵育过夜,去掉一抗液,加入二抗稀释液,常温孵育1 h,去二抗,显色。通过凝胶成像分析仪采集图像,用Quantity One 分析目的条带灰度值。

2 结果
2.1 各组新生大鼠mPAP的变化比较模型组及盐水组缺氧3 d、7 d、14 d的mPAP水平与同日龄对照组比较显著增高,差异有统计学意义(P<0.05),表明造模成功,肺动脉高压形成。但两组间同日龄mPAP水平比较差异无统计学意义(P>0.05),说明盐水对缺氧后肺动脉压力无影响;Gln组缺氧3 d、7 d、14 d的mPAP水平与同日龄对照组比较,差异无统计学意义(P>0.05),与同日龄模型组及盐水组比较显著降低,差异有统计学意义(P<0.05),说明谷氨酰胺诱导的HSP70可以降低肺动脉压力。见表1。

表1 各组新生大鼠肺动脉压水平 (mPAP,±s)
2.2 各组新生大鼠肺血管形态及重塑指标的改变HE染色后在光镜下观察对照组新生大鼠肺血管管腔大、壁薄,清晰显示血管壁各层次结构变化;缺氧后模型组、盐水组的新生大鼠在缺氧3 d时肺血管壁表现增厚;在缺氧7 d时,肺血管平滑肌层增厚,官腔缩小;在缺氧14 d时显示肺血管中层平滑肌增生,管壁增厚明显,官腔更加狭小。Gln组在缺氧3 d、7 d肺血管中层平滑肌无变化,管壁不增厚,官腔狭小不显著;在缺氧14 d时肺血管中层平滑肌轻度增生改变,管壁轻度增厚,官腔轻度狭小。说明Gln组肺血管结构改变轻微,可以减轻或延缓缺氧肺血管的重塑。结果见图1。
缺氧3 d,各组间测量的肺血管重塑指标中层横截面积占血管总横截面积的百分比(MA%)、肺动脉血管壁中层壁厚占外径的百分比(MT%)比较,差异无统计学意义[F(MA %)=0.312、F(MT %)=0.252,P>0.05];缺氧7 d、14 d各组间测量的肺血管MA%、MT%比较,差异有统计学意义[F(MA%7 d)=5.367、F(MT%7 d)=6.102,P<0.01;F(MA%14 d)=8.672、P<0.01,F(MT%14 d)=5.132、P<0.05],其中对照组及Gln组分别与模型组、盐水组比较差异具有统计学意义(P<0.05),Gln组与对照组比较差异无统计学意义(P>0.05);说明缺氧7 d、14 d时模型组、盐水组出现肺血管重塑,Gln组未出现肺血管重塑,延缓肺血管重塑。结果见表2、表3。

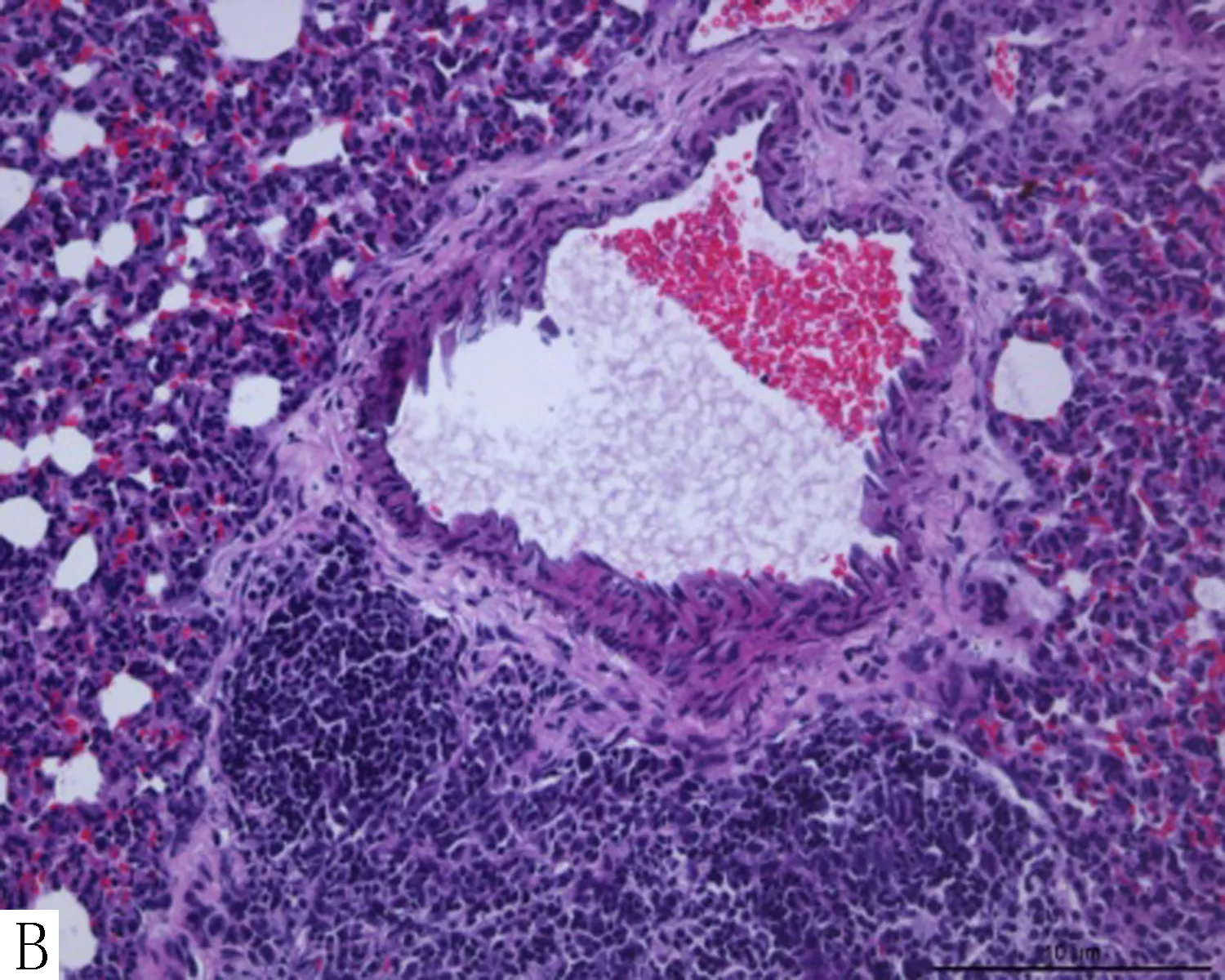




注:A为对照组,B~D分别为模型组、盐水组3、7、14 d肺血管,E为Gln组3、7 d,F为Gln组14 d。图1 各组新生大鼠肺血管形态学改变(HE染色 ×200)

表2 各组新生大鼠MA%变化

表3 各组新生大鼠MT%变化
2.3 各组HSP70、HIF-1α、ET-1、iNOS在新生大鼠肺组织中的蛋白质表达比较
2.3.1 各组HSP70在新生大鼠肺组织中的蛋白质表达比较 各组间缺氧3 d 、7 d、14 d HSP70的蛋白质表达比较差异有统计学意义(F=13.547,P<0.01;F=3.546,P<0.05;F=15.625,P<0.01),其中对照组与HPH各组比较差异有统计学意义(P<0.01),HPH各组表达增强,Gln组与模型组、盐水组比较差异有统计学意义(P<0.01),HSP70在Gln组表达增强;模型组与盐水组比较差异无统计学意义(F=1.681,P>0.05)。说明Gln组HSP70表达明显增强,Gln可以诱导HSP70高效表达。见表4、图2。

表4 各组新生大鼠肺组织HSP70的蛋白质变化
2.3.2 各组HIF-1α在新生大鼠肺组织中的蛋白质表达比较 在缺氧3 d、7 d、14 d各组间HIF-1α的蛋白质表达差异有统计学意义(F=3.156,P<0.05;F=3.235,P<0.05;F=4.601,P<0.05),其中对照组与模型组、盐水组比较差异有统计学意义(P<0.05),HPH各组表达增强,Gln组与模型组、盐水组比较差异具有统计学意义(P<0.05),对照组与Gln组比较差异无统计学意义(P>0.05),HIF-1α在Gln组表达降低。提示在缺氧3 d、7 d、14 d HPH组HIF-1α蛋白质表达较对照组增强,说明缺氧可以引起HIF-1α表达,Gln组与模型组、盐水组比较表达降低,说明Gln组诱导HSP70高效表达后可以下调HIF-1α蛋白质的表达。结果见表5、图3。

表5 各组新生大鼠肺组织HIF-1α的蛋白质表达变化
2.3.3 各组ET-1在新生大鼠肺组织中的蛋白质表达比较 在缺氧3 d、7 d、14 d各组间ET-1的蛋白质表达差异有统计学意义(F=3.466,P<0.05;F=2.988,P<0.05;F=3.145,P<0.05),其中对照组与模型组、盐水组比较差异具有统计学意义(P<0.05),Gln组与对照组比较差异无统计学意义(P>0.05),ET-1在Gln组表达降低。Gln组与模型组、盐水组比较ET-1的蛋白质表达降低,说明Gln组诱导HSP70高效表达后可以阻断ET-1的表达。结果见表6、图4。

表6 各组新生大鼠肺组织ET-1的蛋白质表达变化

对照组 模型组 盐水组 Gln组图2 各组新生大鼠肺组织HSP70蛋白电泳图

对照组 模型组 盐水组 Gln组图3 各组新生大鼠肺组织HIF-1α蛋白电泳图

对照组 模型组 盐水组 Gln组图4 各组新生大鼠肺组织ET-1蛋白电泳图
2.3.4 各组iNOS在新生大鼠肺组织中的蛋白质表达比较 在缺氧3 d、7 d、14 d各组间 iNOS的蛋白质表达差异有统计学意义(F=3.129,P<0.05;F=3.359,P<0.05;F=3.651,P<0.05),HPH各组表达增强,Gln组与模型组、盐水组比较差异具有统计学意义(P<0.05),Gln组与对照组比较差异无统计学意义(P>0.05),iNOS在Gln组表达降低。说明Gln组诱导HSP70高效表达后可以阻断iNOS蛋白质的表达。见表7、图5。

表7 各组新生大鼠肺组织iNOS的蛋白质水平变化

对照组 模型组 盐水组 Gln组图5 各组新生大鼠肺组织iNOS蛋白电泳图
3 讨 论
新生儿缺氧性肺动脉高压是NICU中严重威胁新生儿生命的疾病之一。新生儿HPH发病机制复杂,肺血管内皮损伤,其中以血管收缩因子ET-1和舒张因子iNOS最为重要,缺氧引起肺血管内皮损伤,内皮损伤后引起内皮细胞功能紊乱,引起内皮血管血管活性物质ET-1和iNOS平衡紊乱,导致肺血管重塑,这种变化共同参与了HPH的发生、发展过程[7-9]。
热休克蛋白70是一类在生物进化过程中高度保守的内源性蛋白质,具有自我稳定及保护机制的结果,它的主要功能是参与蛋白质在细胞内合成、运输、折叠和降解过程,极大提高各组织细胞在缺氧、感染、肿瘤的等应激反应时的耐受性,使得这些组织细胞的生理功能发生改变[10]。有实验研究发现,在缺氧情况下HSP70可以通过降解HIF-1α的的活性,发挥保护缺氧组织器官损伤[3]。前期新生儿HPH动物实验研究发现,HSP70可能通过激活HIF-1α的泛素化降解,阻断其和下游靶基因的作用而延缓HPH的发生发展[5]。Gln是人体内含量最丰富的游离氨基酸,在维持人体的正常生理代谢方面起着重要作用。有研究显示Gln 可特异性诱导器官高表达HSP70,发挥HSP70在组织细胞损伤的修复功能[11-12]。正常情况下HSP70位于细胞浆内,表达量很少,当细胞受到缺氧等应激刺激时,表达增高。吴琼等[13]报道,当Gln注射剂量为0.15 g/kg体重时,即可诱导大鼠心、肝、肺和主动脉 HSP70表达,单次注射Gln 0.75g/kg体重,注射12 h左右可诱导HSP70mRNA 高表达,且当给大鼠单次注射Gln 0.75g/kg体重时,对大鼠没有任何毒副作用[14],因此本实验对小鼠的最大注射量也选择为0.75 g/kg 体重,并于注射后缺氧第3、7、14 天的观测时间点检测相关指标,发现Gln可诱导缺氧性肺动脉高压新生大鼠肺组织HSP70的表达,降低 HIF-1α、ET-1、iNOS的表达。
本课题组前期研究发现内源性HSP70对缺氧性肺动脉高压肺的保护作用弱,不能减轻肺血管的损伤性改变[5],而腺病毒介导的外源性HSP70在新生大鼠肺组织高效表达后,进一步通过下调缺氧调控的关键因子HIF-1α和其下游重要的血管活性因子ET-1、iNOS的表达,减轻缺氧性肺动脉高压新生大鼠的肺血管压力,延缓肺血管组织结构重塑样改变,延缓新生大鼠缺氧性肺动脉高压的发生发展,对HPH新生大鼠的肺组织具有保护作用。但同时发现腺病毒引起实验新生大鼠死亡率高,限制了其临床应用。
本研究再次证明缺氧可以引起肺血管损伤,内皮细胞损伤,导致血管舒缩因子异常分泌,引起缩血管物质增多,肺血管平滑肌细胞痉挛、重塑,引起缺氧性肺高压发生。Gln组缺氧3、7、14 d的mPAP水平与同日龄模型组及盐水组比较均显著降低,Gln组HSP70表达明显增强,HIF-1α、ET-1、iNOS的蛋白质表达降低,缺氧7 d、14 d时模型组、盐水组出现肺血管重塑,Gln组未出现肺血管重塑,延缓肺血管重塑。说明谷氨酰胺诱导的HSP70高效表达后可以降低肺动脉压力,降低其下游靶基因ET-1、iNOS的蛋白质表达,减轻或缓解肺血管重塑。推测预防性使用谷氨酰胺可特异性诱导肺组织表达 HSP70,进而起到保护肺泡上皮血管内皮细胞,减轻肺血管损伤而发挥肺保护作用。
综上所述,补充外源性谷氨酰胺可能通过诱导HSP70的表达,下调缺氧性肺动脉高压新生大鼠肺组织中HIF-1α、ET-1、iNOS的表达,减轻肺血管的损伤,对缺氧性肺动脉高压肺组织的损伤起保护作用。谷氨酰胺作为一种HSP70表达的诱导药物,无毒副作用,具有潜在的临床应用价值。

