溶剂热法合成Ce-Mg-Ni/C纳米复合储氢材料
刘卓承 郭瑞华, 阮 飞 胡 锋 张捷宇 安胜利
(1上海大学材料科学与工程学院,上海 200072)
(2内蒙古科技大学材料与冶金学院,包头 014010)
0 引 言
Re-Mg-Ni合金是目前最接近产业化的金属储氢材料之一[1],而Ce在稀土元素中含量最大,其丰度甚至高于常见的铅元素,且由于其具有特殊的物理与化学性能,可作为诸多功能材料重要的组分[2-4]。通常制备Ce-Mg-Ni合金的方法有真空熔炼或机械合金化,特别是Mg基储氢合金。Zhu等[5]先以C与Ni球磨,后与Mg氢化燃烧形成复合材料,使得合金的放氢温度降低了45 K。Yang等[6]将石墨(C)和Mg24Y3合金与不同质量比的Ni粉机械球磨制备复合材料,得到的Mg24Y3-3%(w/w)C-5%(w/w)Ni复合材料在100℃条件下,1 min内可得到5.47%(w/w)的吸氢量。但在实际生产过程中难免有稀土或镁超细粉末的挥发富集,甚至形成爆炸。为解决稀土或镁超细粉末挥发的安全瓶颈,化学法制备合金显的尤为重要。另外,对比传统熔炼或球磨法制备的储氢合金,化学法制备储氢材料的成品率高,且工艺条件可控。Lei等[7]尝试以溶剂热法制备Mg2Ni/C纳米级复合材料,最终制得了明显的Mg2Ni相。金属/C复合材料在储氢[8]和锂电池电催化中[9]有着重要的应用。金属/C复合材料主要包括碳纳米管[10]、碳-气凝胶[5]、碳冷冻凝胶[11]、炭黑[12],而在复合材料中使用的金属主要有Pt、Pd、Au、Sn、Mg、Co、Ni、Cu等。为了将金属纳米颗粒沉积在碳基质上,通常使用多元醇还原法[13-14]。在多元醇的还原过程中,金属离子通过多元醇,如乙二醇(EG)、甘油和聚乙二醇(PEG)还原成金属纳米颗粒。由于C在电催化和储氢过程中经常与金属发生反应,因此将这2种过程合二为一(即多元醇的辅助溶剂热合成法)制备金属/C复合材料具有新的应用前景。
本论文研究了溶剂热法制备Ce-Mg-Ni/C复合材料的新工艺。为了更好的制备出纳米金属/C复合材料,先用葡萄糖为C源,水热法制备出纳米C球,再以乙二醇(EG)为溶剂,加入醋酸镍,调整并得到N i/C装载模板;继续以乙二醇(EG)为溶剂,加入醋酸镁、三氯化铈混合,得到Ce-Mg-Ni/C模板;最后在自动控制的Sieverts设备烧结,制得所要的复合材料,并对其进行储氢性能测试。形貌观察(SEM)及X射线衍射分析(XRD)表面,制备得到了明显的纳米级CeMg3、CeNi3相,并可见目标相Ce2MgNi2和Ce23Mg4Ni7,这对制备合金/碳复合材料新工艺提供可行性依据。
1 实验部分
1.1 样品的制备
1.1.1 C球制备
称取8.00 g葡萄糖置于烧杯中,加入80 mL去离子水,玻璃棒搅拌使其全部溶解,再将配制好的葡萄糖溶液在25℃恒温条件下磁力搅拌40 min,然后将搅拌后的葡萄糖溶液转移至100 mL水热反应釜中,最后将真空反应釜在真空干燥箱内180℃下恒温反应16 h,待其冷却至室温后抽滤。将滤饼清洗后在50℃条件下干燥6 h,即可得到C球模板。
1.1.2 Ni/C纳米复合材料的制备
先分别称取3份1.0 g干燥后的C球模板分散在60 mL纯度为99.0%的乙二醇溶剂中,然后分别加入0.5、1.0、1.5 g的醋酸镍(Ni(CH3COO)2·4H2O),在25℃下恒温磁力搅拌15 h后移至100 mL反应釜内,然后将反应釜放入到真空干燥箱中,180℃条件下恒温反应4 h,反应结束后冷却至室温。经抽滤清洗后,将固体样品置于干燥箱内,50℃条件下干燥5 h,得到3组Ni/C纳米复合样品,观察每组Ni/C复合效果,为下一步制备提供工艺条件。
1.1.3 Ce-Mg-Ni/C纳米复合材料的制备
在3组Ni/C样品形貌观察的基础上,选取2份Ni(CH3COO)2·4H2O与C质量比值为1的Ni/C纳米复合样品1.0 g,再次分散至60 mL纯度为99.0%的乙二醇中。分别在2份溶液中加入醋酸镁(C4H6O4Mg·4H2O)0.215 3 g,氯化铈(CeCl3)0.495 0 g,目的得到Ce2MgNi2/C纳米复合材料。同样加入醋酸镁0.246 1 g、氯化铈1.626 5 g,目的是得到Ce23Mg4Ni7/C纳米复合材料。接着将两者置于25℃恒温磁力搅拌24 h后移至100 mL反应釜中,于真空干燥箱中120℃的条件下反应3 h,之后随炉冷却至室温。抽滤清洗后,样品在干燥箱内50℃条件下干燥5 h。将干燥后的固体粉末装入自动控制的Sieverts设备样品室中烧结。抽真空至1~2 Pa,充入氦气,升温至400℃保温1 h后冷却,得到的纳米级Ce2MgNi2/C和Ce23Mg4Ni7/C复合材料。
1.2 性能表征与测试
使用日本D/max-r B X射线衍射仪分析了复合材料的相结构,衍射仪功率为40 kV×150 mA,采用Cu Kα辐射,波长为0.154 6 nm,扫描范围为10°~90°,扫描步长为0.02°,扫描速度为10°·min-1。用Jade6.0和Findit2011软件对材料成分进行相组成判断。用JEOL公司生产的扫描电镜(SEM,JSM-6400)观察所制备的C球、Ni/C以及Ce-Mg-Ni/C的复合材料形貌,加速电压为20 kV。
采用法国Setaram-PCTPRO系统测试了溶剂热法制备的复合材料的氢化性能,氢吸附的P-C-T性能。每次测试前,样品经充分活化,等温氢吸附氢压为3.0 MPa,P-C-T测试氢压为0~5.0 MPa,吸附氢温度为50、200和300℃。
2 结果与讨论
2.1 微观形貌表征
2.1.1 C球的形貌
图1为水热法制备的C球模板形貌。由图1(a)可见,所制备的样品呈圆球状,粒径分布均匀,局部可见零散C球存在。图1(b)为局部放大C球模板分布图,发现部分C球形成局部粘合,表明在加热过程中,局部温度过高,导致C球形核和长大过程不完全。然而,C球具有较好的亲水性,并呈现较强的吸附力,为金属纳米粒子的装载提供有利条件。

图1 水热法制备C球模板的SEM图Fig.1 SEM images of Csphere prepared by hydrothermal method
2.1.2 Ni/C复合材料的SEM及XRD分析
溶剂热强化吸附被认为是制备C复合装载纳米材料的重要途径,Zhai等[15]共组装树脂、柠檬酸铁以及聚丙二醇与环氧乙烷的加聚物(F-127)作为C源,加入0.10 g的Ni(NO3)2·6H2O作为复合Ni盐,制备出介孔Ni/C复合材料。参照Ni盐的添加量,本文探索加入0.5、1.0、1.5 g的醋酸镍作为Ni/C复合装载量,以观察不同Ni添加量的复合效果。图2所示为溶剂热法制备的Ni/CSEM图以及经面扫描后Ni的分布情况。对比图2(a,c,e)可见,在原均匀C球模板的基础上兼有Ni的吸附。图2(a)所示吸附的Ni未能使得C球粘连情况减弱,且局部可见C球长大或减小。图2(c)复合效果明显较好,分散的C球表面有均匀的Ni分布,且在图2(d)的元素分布图中观察到清晰的颗粒状Ni元素吸附。图2(e)同样也能观察到C球的严重粘连,Ni元素伴随C球的粘连团聚而富集在局部,没能达到理想的复合效果。由此可知,1.0 g的醋酸镍为最佳复合量,故选用1.0 g的醋酸镍作为Ni/C复合装载量制备Ce-Mg-Ni/C复合材料。

图2 Ni/C复合材料的SEM照片及面扫描图Fig.2 SEM and surface scan images of Ni/Ccomposite
为更清楚的观察Ni/C复合装载效果,将图2(c)局部放大后观察形貌,如图3(a)所示,样品可大致分为两类复合类型:第一类Ni/C复合为接近1μm的较分散的C球;第二类Ni/C复合为50~500 nm粘连的C球。Xu等[16]认为金属离子沿C球模板径向插入的深度与径向的温度梯度对该过程有着重要的作用。同时,当以乙二醇为溶剂,在180℃溶剂热处理4 h的条件下,Ni离子的径向深入可导致部分C球收缩,形成多壳结构。故可以推断第一类C球极有可能为均匀的单壳结构,第二类C球为多壳结构。这与图2(b,d,f)中多壳结构的C球中Ni离子分布强度要明显优于单壳结构相一致。
通过XRD分析,可确定复合材料中的基本物相。图3(b)表明为Ni/C复合材料在10°~30°之间较宽的弥散峰为非晶相纳米C,同时Ni标准CIF文件(ICSD No.43397)的前3强衍射线对应于样品出现的3个尖峰。从而可判断样品中存在C和Ni,证明成功制得纳米级Ni/C复合保持一致。

图3 加入1.0 g醋酸镍制备的Ni/C复合装载的SEM图(a)及XRD图(b)Fig.3 SEM image(a)and XRD pattern(b)of Ni/Ccomposite by adding 1.0 g Ni(CH3COO)2·4H2O
2.1.3 Ce-Mg-Ni/C复合材料的SEM及XRD分析
以金属/C复合材料的制备为基础,Lei等[7]以维生素(vitamin C)作为C源合成了纳米级的Mg-Ni/C,证明了二元合金/C复合材料制备的可行性。本文得到的Ce2MgNi2/C复合材料的SEM图及点扫描图谱如图4所示。图4(a)表明Ce2MgNi2/C复合材料仍呈现不规则粘连的C球形貌,局部可见片层状形貌,初步判断是烧结后C球模板发生分解,留下所要载入的金属离子,形成类似纳米级的复合材料。由各元素含量分析可知,Ce、Mg和Ni原子均匀分布在形状点表层,且原子比接近2∶1∶2。EDS图谱中仍可见C和O的分布(图4(b)),表明C球分解不充分。忽略材料的氧化过程,可证实形成了Ce2MgNi2/C复合材料。
为进一步判断物相,对得到的Ce2MgNi2/C复合材料进行XRD分析,图5显示在32.7°~40.8°范围内的33.9°和59.2~62.3°范围内的60.4°位置分别出现较宽的特征峰,对应于Ce2MgNi2标准CIF文件(ICSD 411012)在33.5°、35.5°及37.4°的特征峰,CeMg3标准CIF文件(ICSD No.102217)在34.1°和61.1°的特征峰,以及CeNi3标准CIF文件(ICSD No.152839)在34.2°、36.1°及61.2°的特征峰。依照制备材料时各元素的成分配比,可证明在复合材料中出现了Ce2MgNi2、CeMg3以及CeNi3的特征峰,而CeMg3和CeNi3合金正是伴随Ce2MgNi2合金出现的主要第二相,这也反应了溶剂热法制备三元Ce2MgNi2合金的可行性。
图6(a)为Ce23Mg4Ni7/C复合材料的SEM图及点扫描图谱。由图可知,该复合材料仍呈现不规则粘连的C球装载形貌,局部可见均匀分散的第二类球状形貌,表明C球分解不充分,合金装载效果有限。对图中相似点区域做点扫描分析(图6(b))可知Ce、Mg和Ni原子均匀分布在形状点表层,且原子比偏离23∶4∶7,仍可见C和O的分布,这表明Mg元素在制备过程中大量损失,不宜在复合材料中存在,但存留下来的Mg和Ce与Ni形成合金装载附着在C球表面,形成有限的Ce23Mg4Ni7/C复合材料。

图4 Ce2MgNi2/C复合材料的SEM图(a)及点扫描EDS图谱(b)Fig.4 SEM image(a)and dot scan mapping EDS(b)of Ce2MgNi2/Ccomposite

图5 Ce2MgNi2/C复合材料的XRD图Fig.5 XRD patterns of Ce2MgNi2/Ccomposite

图6 Ce23Mg4Ni7/C复合材料的SEM图(a)及点扫描EDS图谱(b)Fig.6 SEM image(a)and dot scan EDS(b)of Ce23Mg4Ni7/Ccomposite
为进一步判断物相,对得到的Ce23Mg4Ni7/C复合材料进行XRD分析,图7显示在27.2°出现微小的峰,对应于Ce23Mg4Ni7标准CIF(ICSD No,1717342)文件在27.3°的特征峰。分别在34.2°和35.7°出现的明显峰位则对应于CeNi3标准CIF文件(ICSD No,152839)在34.2°和36.1°处的特征峰, 同时Ce23Mg4Ni7在36°也出现峰位,所以35.7°的峰位可能是Ce23Mg4Ni7并伴随CeNi3相而产生的,在40°~50°间的非晶峰也包含CeNi3主强峰。结合本实验预制备复合材料各元素的配比,可间接判断出有Ce23Mg4Ni7相存在。

图7 Ce23Mg4Ni7/C复合材料的XRD图Fig.7 XRD pattern of Ce23Mg4Ni7/Ccomposite
2.2 吸放氢性能
图8 (a)为经溶剂热法制备的Ce2MgNi2/C和Ce23Mg4Ni7/C复合材料在50℃下的等温氢化动力学。由3.0 MPa氢气压力下的吸附曲线可以看出,50℃时2种复合材料在10 s内吸附氢量已高于1.0%(w/w)H2,并在3 h时间内吸附氢量无较大的改变,且Ce2MgNi2/C吸附氢量先达到1.69%(w/w)H2,后又降低至1.54%(w/w)H2,而Ce23Mg4Ni7/C吸附能力也可达到1.05%(w/w)H2。显然,这2种复合材料具有较好的低温吸附氢能力,且两者的吸附氢活化性能极好。这主要是由于复合材料具有纳米级结构,同时过剩的C球可提供有利于氢的吸附的足够空间。为研究复合材料在吸放氢循环过程中的结构稳定性,对复合材料在300℃下进行吸放氢循环稳定性测试(图8(b))。该图表明2种复合材料都具有较好的氢化循环稳定性,经10次循环后,吸附氢量没有明显下降,且吸附氢量与50℃下的相当,这对于熔炼法制备的合金来说是难以实现的。同时复合材料的放氢性能较差,即使在300℃下,Ce2MgNi2/C放氢量约为0.24%(w/w),而Ce23Mg4Ni7/C仅为0.13%(w/w),充分反映了复合材料较弱的放氢性能。这一结果很可能是由于Ce或Mg与氢的结合能力强有关[17],再者富含Ce的合金具有极低的放氢平台,氢的放出需要较为苛刻的低压条件。

图8 Ce2MgNi2/C和Ce23Mg4Ni7/C复合材料(a)在50℃下的等温氢化动力学;(b)在300℃下的吸放氢循环稳定性测试Fig.8 (a)Isothermal hydrogenation kinetic curves of Ce2MgNi2/Cand Ce23Mg4Ni7/Ccomposite at 50℃;(b)Hydrogen adsorption-desorption cycle stability test for Ce2MgNi2/Cand Ce23Mg4Ni7/Cat 300℃
为进一步讨论复合材料中有效相的吸附氢作用,图9给出了Ce2MgNi2/C和Ce23Mg4iN7/C材料吸附氢后的XRD结果。由图可见,复合材料整体呈现较宽的峰,吸附氢后主要生成CeH2.73(ICSD No.44359),并伴随MgH2(ICSD No.26624)的生成,其中10°~30°间为纳米C。由此可认为复合材料在吸附氢循环过程中发生部分可逆分解。上文提到溶剂热法制备的复合材料Ce2MgNi2/C和Ce23Mg4Ni7/C中含有的Ce2MgNi2、Ce23Mg4Ni7、CeMg3及CeNi3相吸附氢,进而吸附氢分解为CeH2.73和MgH2,这也正是复合材料具有较好的低温吸附氢和较弱的放氢性能的原因。
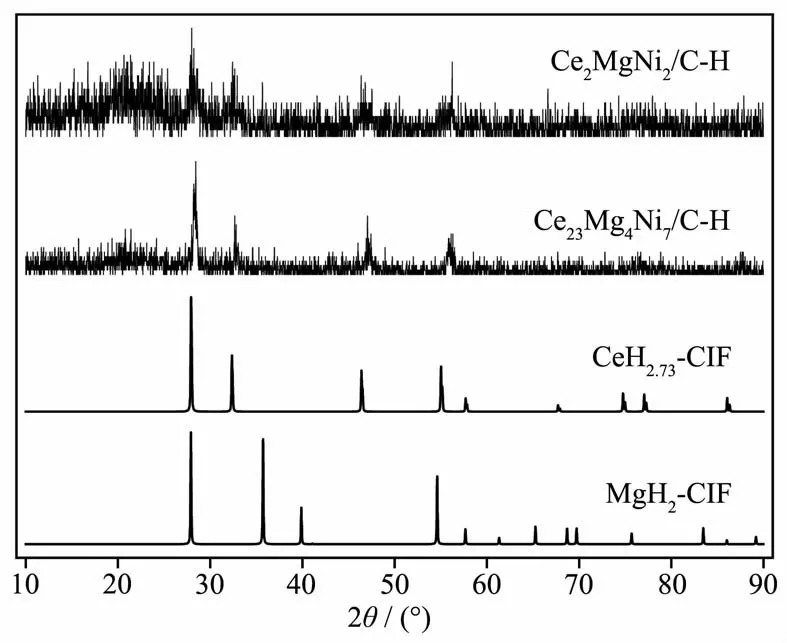
图9 Ce2MgNi2/C和Ce23Mg4iN7/C复合材料吸附H后的XRD图Fig.9 XRD patterns of the Ce2MgNi2/CandCe23Mg4Ni7/C after hydrogen adsorption
图10 为Ce2MgNi2/C和Ce23Mg4Ni7/C复合材料在50及200℃时的P-C-T吸放氢曲线。由图可见,2种复合材料的P-C-T曲线平台不明显,这表明材料存在多相结构,Ce23Mg4Ni7/C的氢吸附平台低于Ce2MgNi2/C。由放氢曲线可知,复合材料在50℃时几乎少有氢气放出。即使温度提高至200℃也无明显放氢,这一结果和熔炼制备的合金吸放氢性能较为吻合[17],这也进一步显示了C复合装载制备合金的有效性。此外,随温度升高,吸附氢平台明显延长,这也表明,温度升高会增加部分氢在复合材料内部扩散的动力,更能达到材料的最大吸附量。

图10 Ce2MgNi2/C和Ce23Mg4Ni7/C复合材料在50及200℃下的P-C-T吸附氢曲线Fig.10 P-C-T adsorption curves of Ce2MgNi2/Cand Ce23Mg4Ni7/Ccomposite at 50 and 200℃
3 结 论
(1)使用溶剂热法制备了具有C复合材料的Ni/C复合材料,其中1.0 g的均匀C球与1.0 g的醋酸镍为Ni/C复合最佳装载量。
(2)使用溶剂热强化法制备了具有C复合装载的Ce2MgNi2/C和Ce23Mg4Ni7/C复合材料。微结构表征结果显示,Ce2MgNi2/C形成了具有类似纳米结构的C装载Ce2MgNi2的复合材料,并伴随CeNi3和CeMg3第二相;而Ce23Mg4Ni7/C形成有限的C装载Ce23Mg4Ni7复合材料。
(3)通过对2组复合材料吸放氢性能测试发现:Ce2MgNi2/C和Ce23Mg4Ni7/C复合材料均具有极好的吸附氢动力学性能,且两者在50℃下的吸附氢量可分别达到1.54%(w/w)H2和1.05%(w/w)H2;P-C-T结果显示,复合材料具有较高的吸附氢平台,遗憾的是两者放氢性能不明显,侧面反映出溶剂热法制备Ce-Mg-Ni三元合金的有限性。。

