沙尘暴PM2.5 颗粒致大鼠炎症反应和心脏损伤的研究
李星辉 雷林峰 乔燕 聂芳菲 马婧 王晨晨 王立君
沙尘暴是全世界干旱地区较为常见的一种灾害性天气现象,指强风将地面尘沙吹起使空气混浊,水平能见度<1km,沙尘暴天气易诱导发生各种疾病[1]。沙尘暴颗粒物中的有毒物质及病菌可经呼吸道进入人体,对机体健康造成损害,损害程度与沙尘暴颗粒物的来源、直径及化学成分有关。目前,沙尘暴颗粒物已成为危害人类健康的主要因素之一,2002 年世界卫生组织的估算结果表明,全球城市每年因颗粒物污染至少造成100 万居民死亡和740 万居民伤残调整生命年的损失,而东南亚、东亚(包括中国)、南亚国家约承担一半的损失,因为该地区颗粒物污染严重[2]。以往对沙尘暴颗粒物的研究多聚集在呼吸系统,对沙尘暴颗粒物在心血管系统的影响及其机制研究甚少,目前沙尘暴颗粒物污染与人群心血管系统疾病发病及死亡的关系已逐渐成为研究热点之一。相关学者已提出沙尘暴颗粒物致心血管系统疾病的可能机制,包括损伤血管内皮细胞、激发氧化应激和炎症反应、引起血管舒缩功能及脂质功能障碍、促进血栓形成、促进动脉粥样硬化病变的发生和发展等,这些过程又相互关联,最终导致心血管系统疾病的发生和发展[3-4]。本研究通过采集甘肃河西走廊沙尘暴颗粒,研究不同暴露剂量的沙尘暴PM2.5 对Wistar 大鼠心脏损伤的影响,阐述沙尘暴PM2.5 对心脏的炎性损伤反应,现报道如下。
1 实验对象和方法
1.1 实验对象及材料 32 只6 周龄SPF 级健康雄性Wistar 大鼠,体重180~200g,常规条件喂养2 周。实验所用沙尘暴PM2.5 由甘肃省河西走廊地区武威市环境保护局监测中心提供。使用TEOM1405D 双通道颗粒物监测仪来保证沙尘暴PM2.5 的粒径大小,对于粒径<10μm 的颗粒物先经顶端的PM10 切割头进入采样系统,再被虚拟冲击器分离为PMc 和PM2.5,进入双通道的颗粒物分别聚积在系统可更换的TEOM 滤膜上。实验所用沙尘暴颗粒物PM2.5均来自这些更换后的滤膜。
1.2 方法
1.2.1 沙尘暴PM2.5 溶液的配制 将采有沙尘暴PM2.5 的滤膜取出并裁剪成1cm×3cm 大小,浸入超纯水中,超声震荡30min,共3 次,震荡液用纱布过滤,滤液经冷冻真空干燥后得到沙尘暴PM2.5 粉末,置入-20℃冰箱保存。用电子天平称取各暴露组所需沙尘暴颗粒物PM2.5 的量(低暴露组、中暴露组、高暴露组PM2.5 的量分别按1.5、6.0、24.0mg/kg 进行计算),并用无菌0.9%氯化钠溶液配制成各暴露组所需的浓度,之后经超声震荡15min 混匀后备用。
1.2.2 沙尘暴PM2.5 暴露模型的建立 采用随机数字表法将大鼠分为4 组,即沙尘暴PM2.5 低剂量暴露组(低暴露组)、中剂量暴露组(中暴露组)、高剂量暴露组(高暴露组)及空白对照组。以3ml/kg、10%水合氯醛行腹腔注射麻醉,仰卧位固定,颈部备皮,碘伏消毒,行颈前正中切口约1cm,分离皮下和肌肉组织暴露气管,用6 号针头与气管稍呈角度刺入,经气管缓慢滴入0.5ml 不同浓度的沙尘暴PM2.5,共滴注3 次,1 次/d,即暴露3 次。空白对照组滴注等量0.9%氯化钠溶液。每次沙尘暴PM2.5 暴露前及气管滴注后24、48、72h 称量记录每只大鼠的体重。
1.2.3 大鼠血清炎症因子的检测及心脏组织的病理形态学观察 建模成功后,采用先前的麻醉方法,剖开腹腔,暴露腹主动脉采血,静置凝固后离心,3 000r/min,4℃,10min,置-20℃冰箱备用。采血完成后立即脱颈椎处死,充分暴露胸腔,剪去大血管,取出心脏组织,清洗后标记置冻存管备用。(1)采用酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)法分别测定4 组大鼠血清炎症因子C反应蛋白(c-reactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素(IL)-1、IL-6、IL-8 和巨噬细胞炎症蛋白-2(macrophage inflammatory protein-2,MIP-2)水平。具体方法为:取样;标准品加样;空白孔和待测样品孔加样;加酶;温育;洗涤;显色;终止;测定;绘制标准曲线并计算。(2)组织切片制作及苏木精-伊红(HE)染色:固定;脱水;透明;透蜡;包埋;切片;贴片;染色;封固;显微镜观察。
1.3 统计学处理 采用SPSS20.0 统计软件,符合正态分布的计量资料以表示,多组比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 4 组大鼠的体重变化比较 见表1。
由表1 可见,与暴露前比较,空白对照组大鼠体重在第1 次暴露后未见明显减轻,结果无统计学意义(P>0.05)。第1 次暴露后的高暴露组,第2 次暴露后的中、高暴露组,第3 次暴露后的低、中、高暴露组的大鼠体重均较空白对照组下降明显(P<0.05或0.01)。同时各暴露组大鼠毛发渐失去顺滑感且光泽渐消失、呼吸急促、活动量减少、进食及饮水量明显减少,而空白对照组大鼠上述变化不明显。
2.2 4 组大鼠暴露72h 后炎症因子比较 见表2。
由表2 可见,与空白对照组比较,低暴露组、中暴露组及高暴露组大鼠CRP、TNF-α、IL-1、IL-6、IL-8、MIP-2 水平均呈剂量依赖性升高,差异均有统计学意义(均P<0.05)。
2.3 4 组大鼠心脏组织病理形态学变化 见图1。
由图1 可见,与空白对照组相比,低、中暴露组大鼠心肌细胞肥大,细胞间质变窄,但两组未见明显差异;而高暴露组大鼠心肌细胞明显肥大,细胞间质明显变窄;空白对照组未发现上述改变。4 组大鼠心脏组织切片未观察到明显的炎性细胞浸润。

表1 4 组大鼠的体重变化比较(g)
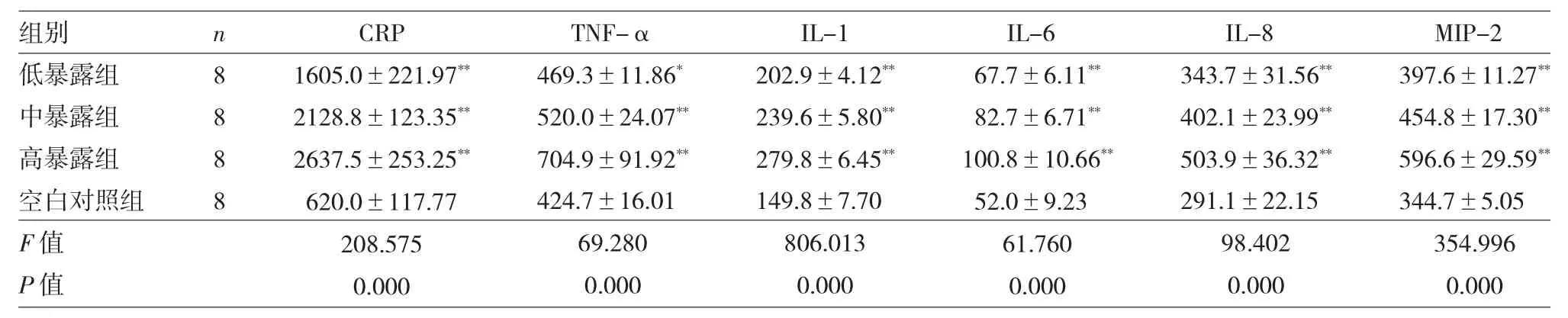
表2 4 组大鼠暴露72h 后炎症因子比较

图1 4 组大鼠心脏组织病理图(A:低暴露组;B:中暴露组;C:高暴露组;D:空白对照组;HE 染色,×200)
3 讨论
我国西北地区由于独特的自然环境和地理条件,属于沙尘暴频发带,甘肃河西走廊地区是中国北方沙尘暴的第二大源区。笔者发现每当沙尘暴高发时期,当地医院因心血管疾病就诊率、住院率及病死率均有所增高,因此选取此地区沙尘标本进行相关动物实验。已有研究揭示了人类和动物暴露于颗粒物与全身促炎反应具有相关性,从而造成心血管系统的损害[5-7]。研究表明,炎症反应的产生及炎性因子的释放在心血管系统疾病的发生和发展中扮演着至关重要的作用[8]。在本实验中,我们选择测量大鼠血 清 炎 症 因 子 CRP、TNF-α、IL-1、IL-6、IL-8、MIP-2 水平来评估暴露于沙尘暴PM2.5 导致的炎症反应。CRP 是全身炎症的敏感标志物和心血管事件有价值的预测指标,TNF-α、IL-6、MIP-2 均具有促进炎症发生和发展的作用。已有研究发现暴露于PM2.5,可引起血清CRP、IL-1、IL-6 水平升高,且IL-6 的升高水平与PM2.5 的暴露剂量呈正相关关系[9-10]。将小鼠暴露于颗粒物中,其血清MIP-2 的水平逐渐升高,在暴露后24h 炎症反应程度最大[11],颗粒物暴露也会导致TNF-α 水平升高[12]。研究发现暴露于不同浓度的PM2.5,24h 后血清中IL-1 的水平呈剂量依赖性升高,且48h 后IL-8 的水平随暴露剂量的增加而逐渐升高[10,13]。上述研究结果与本实验发现相吻合。
研究发现颗粒物诱导炎性介质的产生依赖于活性氧的生成和核因子-κB(NF-κB)、丝裂原活化蛋白激酶(MAPK)的活化[14]。暴露于不同浓度的PM2.5,NF-κB 蛋白表达量显著增加,而NF-κB 抑制蛋白α 表 达 量 显 著 下 降,NF-κB 可 通 过 控 制IL-6、IL-1β、IL-8、TNF-α 和一氧化氮合酶(iNOS)的直接或间接表达来调节炎症反应[15-16]。核因子IκBα 可以抑制NF-κB 从细胞质向细胞核转运,因此IκBα的下调被认为是NF-κB 活化的标志物[17]。以后的研究应围绕颗粒物诱导炎症细胞因子产生的相关机制进行。
本实验发现成年Wistar 大鼠暴露于沙尘暴PM2.5 后,可出现暴露组大鼠体重明显减轻,推测可能是皮肤切开对大鼠属于外伤性刺激,可直接导致气管滴注后大鼠进食和饮水量的减少,从而引起大鼠体重下降,但由于随颗粒物暴露剂量的增加而减轻明显,也不能排外暴露于沙尘暴PM2.5 后产生的毒性反应所致。在本研究中,各组大鼠心脏组织切片经HE 染色后,在光学显微镜下发现暴露组大鼠心肌细胞呈现不同程度的肥大。中暴露组与低暴露组相比,心肌细胞肥大程度未见明显差异,可能与两组PM2.5 暴露剂量相差不大有关,而高暴露组心肌细胞明显肥大,细胞间质明显变窄,推测与暴露时间、浓度相关。而上述各组大鼠心脏组织切片均未观察到明显的炎性细胞浸润。已有研究发现,小鼠暴露于颗粒物中2d 后,仅在心脏右心室组织切片中观察到心肌细胞肥大及炎症细胞浸润[18]。但也有部分研究者发现,Wistar 大鼠经气管滴注PM10 2d 后,在大鼠心脏组织切片中未观察到心肌细胞炎性反应改变[19]。究其原因,可能与本实验中采用心脏的心尖部分作HE 染色切片有关,而心尖组织大部分属于左心室,可能也与颗粒物暴露时间长短有一定的关联。
总之,暴露于沙尘暴PM2.5 可诱导血清炎症因子CRP、TNF-α、IL-1、IL-6、IL-8、MIP-2 的产生及心脏的炎性损伤,从而导致心血管疾病的发生和发展。本实验未对沙尘暴颗粒物的成分及理化性质等进行研究,这些因素也会对上述实验结果产生一定的影响,今后的实验中应进一步改进。

