围手术期停用抗凝药物对于输尿管软镜治疗肾结石疗效及安全性研究
李文峰 潘惟昕 茅原申 顾豫飞
1 上海交通大学医学院附属第九人民医院泌尿外科200011 上海
长期口服抗凝药的肾结石患者,由于围术期 停药会增加血栓栓塞事件的发生,不适合采用可能诱发围术期严重出血的体外冲击波碎石术或经皮肾镜碎石术治疗结石[1-2]。随着近年来输尿管镜器械及钬激光设备的改进和发展[3-4],输尿管软镜钬激光碎石术可以更加有效及安全处理肾集合系统各个位置的结石[5-6],是现阶段此类肾结石患者唯一的有效的治疗方法。但这类患者围手术期持续使用抗凝药物的安全性和有效性鲜有临床报道。我们收集近5 年来此类患者的临床资料,比较围手术期间是否停用抗凝药物对于输尿管软镜治疗肾结石疗效及安全性的影响。
1 资料与方法
1.1 临床资料
选取2013 年7 月-2018 年7 月长期口服抗凝药物同时罹患肾结石的患者167 例,排除有同侧输尿管结石患者,以及合并明显肉眼血尿、先天性肾脏畸形、肾功能不全者。其中43 例(25.7%)口服华法林,36 例(21.6%)口服波立维,88 例(52.7%)口服阿司匹林。根据围手术期使用抗凝药物情况,患者共分为两组:A 组为实验组,入组患者86 例,术前根据原方案继续口服抗凝药物,并根据所服用抗凝药物不同,分为3 个亚组:华法林亚组(n=23)、波立维亚组(n=24)及阿司匹林亚组(n=39);B 组为对照组,入组患者81 例,术前1 周均暂停使用所有抗凝药物。
1.2 手术方法
两组均采用全身麻醉,患者取截石位,用F8/9.8Wolf 输尿管硬镜进入患侧输尿管到达肾盂处,留置斑马导丝。置入输尿管导引鞘(COOK,美国),首选F12/14,如置入困难则改用F9.5/12置入,所有患者均置入成功。使用输尿管软镜(Storz,德国)在肾盏内寻找结石,对于肾下盏结石,可先使用F2.4(COOK,美国)镍钛合金取石网篮钳取结石后再进行钬激光碎石。通过输尿管软镜工作通道插入200 μm 钬激光光纤,钬激光参数设置为1.0 J/10 Hz,击碎视野内可见结石,使用取石网篮取出部分较大结石碎片,通过输尿管软镜仔细检查各肾盏,确保结石碎片均小于2 mm 且肾下盏无明显结石碎片。所有患者均留置F6双J 管(COOK,美国)1 根,术后2 周视情况拔除双J 管。A 组在术后24 h 内恢复使用抗凝药物。所有患者在术后48 h 确认血红蛋白、尿液颜色和生命体征稳定后出院回家并随访至拔除双J 管后1 d。
1.3 观察指标
记录入组患者术前1 d 凝血功能包括凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶 时 间(activated partial thromboplastin time,APTT)及国际标准化比值(international normalized ratio,INR)、同时检查术前肾功能(血肌酐)、美国麻醉医师协会评分(American Society of Anesthesiologists,ASA);患者均经输尿管CT 平扫证实结石存在并测量其最大径。记录两组手术时间(自输尿管硬镜开始至双J 管放置完毕)、两组患者血红蛋白下降值(术前与术后3 d 内血红蛋白最低值的差值),分析其手术及出血情况。对术后取出的结石碎片进行结石成分分析。术后1 个月所有患者均行输尿管CT 平扫,治疗侧上尿路存在大于2 mm 的残余碎石被认为是治疗失败[7],根据结石清除率评价两组的治疗效果。比较两组患者术中术后并发症发生情况,评价停用抗凝药与否对输尿管软镜钬激光治疗安全性的影响。
1.4 统计学方法
采用SPSS 22.0 软件分析处理数据,计数资料以(n/%)表示,并采用χ2检验。计量资料以表示,根据正态性与否,选择t 检验或Wilcoxon 秩和检验。为使用Kruskal-Wallis 检验对3 个亚组(华法林、波立维、阿司匹林亚组)与对照组进行比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 患者基线临床资料
两组患者的年龄、ASA 评分、肾结石负荷、肾下盏结石数量、初始血红蛋白和血清肌酐差异无统计学意义。观察组与对照组的PT(14.1 vs.10.9 s,P<0.001),APTT(32.0 vs. 28.0 s,P<0.001)和INR(1.4 vs. 1.2,P=0.001)差异有统计学意义,详见表1。
2.2 患者围手术期情况
A 组的手术所需时间更长(50.0 vs.44.0 min,P=0.020),术中视野清晰度,患者顺利完成手术。两组均无患者需要输血,两组患者围手术期均未出现大出血并发症。本研究仅1 例对照组患者出现浅表肾盂黏膜穿孔,术者迅速完成手术,无特殊处理。术后1 d 行输尿管CT 平扫检查示双J 管位置可,肾周渗出不明显。A 组中有10 例患者出现术后并发症,其中9 例患者出现持续3 d以上明显肉眼血尿,1 例患者出现尿路感染。对照组5 例患者出现并发症:2 例患者出现持续3 d以上明显肉眼血尿、2 例患者出现尿路感染,1 例患者出现尿潴留。3 个亚组之间及A、B 两组之间术后1 个月结石清除率均差异无统计学意义(89.5% vs.85.2%,P=0.826)。详见表2。

表1 两组患者基线临床资料比较

表2 患者疗效及并发症情况
2.3 两组患者血红蛋白下降值
华法林、波立维、阿司匹林亚组及整个A 组患者术后血红蛋白下降平均值为7.4、6.9、3.7、5.6 g/L,分别与B 组患者(下降2.1 g/L)比较,均P<0.001。术前和术后血红蛋白的变化见图1。
2.4 结石成分分析
术后取出结石行结石成分分析,各组之间均无明显差异(P>0.05),详见表3。
3 讨论
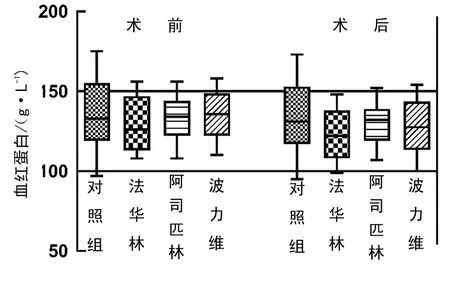
图1 各组手术前后血红蛋白变化

表3 各组结石成分比较 n(%)
在过去的十多年间,各种用于碎石取石的小口径输尿管镜、钬激光和辅助器械得到了迅猛的发展,使处理肾结石的外科手段日益增多[8-11]。然而,在面对持续口服抗凝药的肾结石患者时,临床医生往往陷入两难:持续口服抗凝药是体外冲击波碎石,经皮肾镜碎石取石术等方法的绝对手术禁忌证[1-2];围手术期停用抗凝药又会导致血栓引起的并发症发生的可能性增加[12]。对于输尿管软镜钬激光碎石术,尽管理论上患者持续服用阿司匹林、波立维或华法林行输尿可致围手术期出血风险增加,但是本研究结果发现,与围手术期停用抗凝药物患者相比,出血相关并发症的发生率并没有增加。此外,两组最终结石清除率相仿,持续接受抗凝药物治疗患者并未出现严重术中出血影响手术视野,最终导致手术失败的情况。
目前,长期服用抗凝药物患者的数量逐步增加,处理此类患者时,需要在停药后出现血栓栓塞风险与持续服用时加重围术期出血风险之间进行权衡[13]。由于服用阿司匹林、波立维或华法林患者接受输尿管软镜手术时的出血风险的相关临床数据较少。因此围绕围手术期是否可以持续抗凝药物治疗仍存在争议。孙毅海等[14]研究认为尽管输尿管镜钬激光碎石具有损伤小、出血少、碎石效率高等优势,对于抗血小板治疗的输尿管结石患者,术前仍应调整抗血小板药物。此外,Daels 等[15]分析了全球近12 000 名患者的输尿管镜手术结果发现,口服抗凝药物患者的术后出血率明显高于未服用患者(1.1% vs.0.4%,P<0.01)。然而,Westerman 等[16]收集了314 例长期服用抗凝药物的上尿路结石患者的临床资料,其中包括围手术期持续服用抗凝药物的患者80名,研究发现持续服药组患者的结石清除率、术后并发症、出血发生率与停药组相似,但是其血栓栓塞发生率明显减少。Sharaf 等[17]评估了25例接受输尿管镜钬激光治疗后出血风险增加的患者的手术资料,其中17 例患者接受华法林治疗,患者的整体结石清除率为96%,只有1 例患者同时接受ESWL 治疗患者需要输血。我们在临床研究中发现在输尿管软镜围手术期间继续服用抗凝药并不会引起额外的出血相关风险,最终的结石清除率也并未下降。
对于服用抗凝药物预防心脏病发作或中风的患者,抗凝药物停用与心脑血管意外风险增加有关,并且这些事件的70%发生在停用7~10 d内[18-19]。Toepfer 等[20]回顾 性研究其近5 年行 输尿管镜治疗的患者,出现1 例由于停用抗凝药物出现术后心肌梗死并死亡事件的发生。因此,虽然本研究两组均未出现严重的心脑血管事件,但是我们仍然支持AUA/ICUD 的立场,即在输尿管软镜对患者造成最小风险并且不影响手术结果的情况下,应继续使用抗凝药物[21]。
虽然不同种类的抗凝药物由于药理机制不同,抗凝能力及出血风险之间存在差异。但是Turna 等[22]研 究37 名 持 续 口 服 抗 凝 药 物 肾 结 石患者,其中包括华法林(n=14),波立维(n=5),81 mg 阿司匹林(n=13),325 mg 阿司匹林(n=5),各组分别行输尿管镜治疗后患者的结石清除率、术后并发症、出血及血栓等不良事件情况均无明显差异。本研究收集了更多的病例数,发现口服不同的抗凝药物血红蛋白下降幅度存在差异(P<0.001),但是各亚组的疗效及安全性是相似的。因此在输尿管软镜手术期间继续使用各种类型的抗凝药物均是安全的。由于此类研究纳入的患者都仅接受了结石方面的治疗,因此这些发现是否适用于诊断及治疗上尿路的尿路上皮癌或输尿管狭窄方面尚无定论。
综合以上,在大多数情况下,持续抗凝治疗并不会影响输尿管软镜处理肾结石的结果。然而对于一些患者,停用抗凝药物的风险却非常高。因此权衡手术疗效及围手术风险后,我们认为肾结石患者在输尿管软镜钬激光碎石术围手术期无需暂停使用抗凝药物。
——可重复性或一次性输尿管软镜孰优孰劣?

