N末端脑钠肽前体与血尿酸在妊娠期高血压疾病中的水平和相互关系
李熠 吴静娟 王志坚
【摘要】 目的:分析血N末端脑钠肽前体和尿酸在妊娠期高血压疾病中的水平和相互关系。方法:选取2017年9月至2019年3月来本院就诊的70例单胎妊娠晚期妊娠期高血压疾病孕妇作为研究对象,其中妊娠期高血压组35例,非重度子痫前期组19例,重度子痫前期组16例,并选取同期286例单胎正常妊娠孕妇作为对照组,分析:1)血N末端脑钠肽前体和尿酸在四组孕妇中的水平;2)血N末端脑钠肽前体与尿酸在上述四组中的相关性。结果:1)血N末端脑钠肽前体在正常妊娠组、妊娠期高血压组、非重度子痫前期组和重度子痫前期组中呈依次上升表现,各组间比较,差异均具有统计学意义(P<0.05);虽然血尿酸在上述四组中也呈依次上升表现,但在非重度子痫前期组和重度子痫前期组之间的差异无统计学意义(t=-0.013,P=0.99),其余各组间比较,差异具有统计学意义(P<0.05);2)仅在正常妊娠组中发现血NTproBNP与尿酸之间存在着显著的正相关(r=0.207,P=0.001),而在妊娠期高血压组(r=0.181,P=0.298)、非重度子痫前期组(r=0.302,P=0.176)和重度子痫前期组(r=0.193,P=0.267)中均未发现显著的相关性。结论:血N末端脑钠肽前体和尿酸对妊娠期高血压疾病病情严重程度的判断具有一定的价值,建议在临床工作中对两者进行联合监测。
【关键词】
脑钠肽;N末端脑钠肽前体;血尿酸;妊娠期高血压;子痫前期;妊娠期高血压疾病
在临床工作中,N末端脑钠肽前体(NTproBNP)已被用于对心脏功能及心衰情况的评估[1],血尿酸(UA)在心功能不全的患者中升高[2]。在产科领域,研究也认为血NTproBNP[3]、UA[4]与妊娠期高血压疾病的病情严重程度有着密切的相关性,但血NTproBNP与UA在妊娠期高血压疾病中是否具有相关性,此方面的研究较少。本文作者对70例单胎妊娠晚期妊娠期高血压疾病孕妇的血NTproBNP和UA水平进行研究,初步探讨两者在妊娠期高血压疾病中相关性,为妊娠期高血压疾病的病情监测提供一定的帮助。
1资料与方法
1.1研究对象
收集2017年9月至2019年3月来本院就诊的70例单胎妊娠晚期妊娠期高血压疾病孕妇作为研究对象,其中妊娠期高血压组为35例,非重度子痫前期组为19例,重度子痫前期组为16例,并选取同期286例单胎正常妊娠孕妇作为对照组。在这四组中,孕妇年龄、孕周、身高、体质量及孕产次等一般资料无统计学差异(P>0.05)。
妊娠期高血压和子痫前期诊断标准参照《中国妊娠期高血压疾病诊治指南(2015)》[5],因目前指南不再设定“轻度子痫前期”这一诊断名称,为研究便利,故笔者将达不到重度子痫前期诊断标准的子痫前期孕妇,归类为“非重度子痫前期”。
1.2血NTproBNP和尿酸检测
同一时间采外周静脉血用生化仪测血尿酸,应用罗氏公司电化学发光法测定血清NTproBNP水平。
1.3统计学方法
采用SPSS 17.0统计学软件进行数据处理,计量资料以(±s)表示,采用单因素方差分析法进行多组间均值比较,使用pearson相关分析法对各组血NTproBNP与尿酸相关性进行分析,以P<0.05表示差异有统计学意义。
2结果
2.1血NTproBNP、尿酸在四组孕妇中的比较
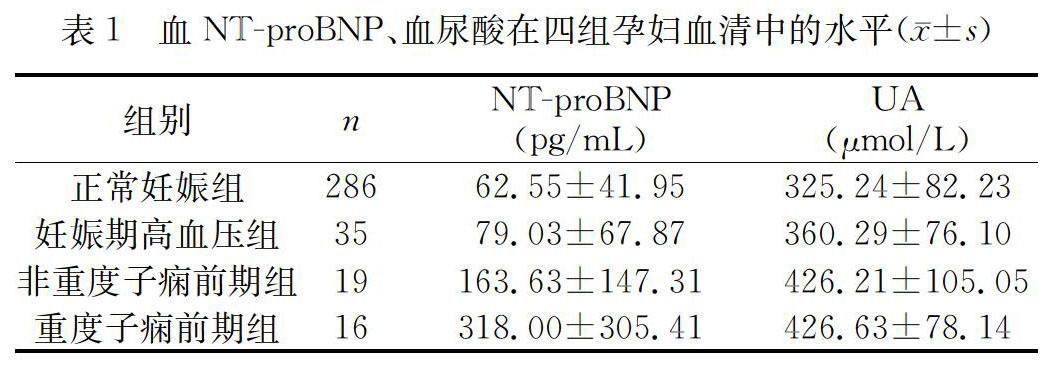
血NTproBNP和尿酸在四组孕妇中的水平详见表1,血NTproBNP在正常妊娠組、妊娠期高血压组、非重度子痫前期组和重度子痫前期组中呈依次上升表现,各组间比较,差异均具有统计学意义(P<0.05);虽然血尿酸在上述四组中也呈依次上升表现,但在非重度子痫前期组和重度子痫前期组之间的差异无统计学意义(t=-0.013,P=0.99),其余各组间比较,差异均具有统计学意义(P<0.05)。
2.2血NTproBNP、尿酸在四组孕妇中的相关性分析
通过Pearson相关分析发现,仅在正常妊娠组中发现血NTproBNP与尿酸之间存在着显著正相关(r=0.207,P=0.001),而在妊娠期高血压组(r=0.181,P=0.298)、非重度子痫前期组(r=0.302,P=0.176)和重度子痫前期组(r=0.193,P=0.267)中均未发现显著的相关性。
3讨论
脑钠肽(BNP)是心脏利钠肽家族中的一员,主要由心室肌细胞合成和分泌。当心脏负荷增加时,心肌细胞首先合成BNP前体(proBNP),然后蛋白水解酶将proBNP裂解为BNP和N末端proBNP(NTproBNP),故BNP和NTproBNP来源相同且等摩尔分泌,检测BNP和NTproBNP的临床应用结果是相同的,但NTproBNP与BNP相比,具有更长的半衰期(120min vs 20min),且在体外更为稳定,因此临床检测NTproBNP更为便利[6]。BNP和NTproBNP的检测已广泛用于临床心脏功能的评估、确定心衰的存在和严重程度,在非妊娠人群中,当血BNP<100pg/mL或NTproBNP<300pg/mL时,基本可排除心力衰竭的存在[7]。目前BNP和NTproBNP在妊娠高血压疾病方面也有相关的研究,认为BNP、NTproBNP与妊娠期高血压疾病的严重程度相关[3,810],在本研究中也得到了类似的结果,血NTproBNP在正常妊娠组、妊娠期高血压组、非重度子痫前期组和重度子痫前期组中呈依次上升表现,各组间比较,差异均具有统计学意义(P<0.05),特别要注意的是,在重度子痫前期组,NTproBNP数值为:(318.00±305.41)pg/mL,均值已超过非妊娠人群NTproBNP的心衰排除标准(<300pg/mL),因此对于这部分人群,应该结合其临床表现,行心电图、超声心动图等检查,确定其心功能状况,作出相应临床决策,减少母胎不良并发症的发生。
UA是嘌呤的代谢产物,绝大多数来源于体内,少部分由食物中嘌呤代谢产生,在妊娠期,UA随孕周的增加而逐渐升高,升高的主要原因是:1)胎儿的代谢产物逐渐增多,后经母体排泄;2)从妊娠中期开始,基础代谢率渐增加,到妊娠晚期可增加15%~20%,母体自身代谢产生的UA也增多;3)妊娠后女性身体经历一系列的生理性变化,其中心脏负荷的增加,使得次黄嘌呤生成UA的限速酶—黄嘌呤氧化酶活性增强,也使得UA产生增加[11]。研究认为,在非妊娠人群中,UA在心功能不全患者中升高,并和心功能分级密切相关[1213]。在妊娠人群中,由于妊娠期UA生理性升高,UA在妊娠期正常参考值范围尚未确立,限制了其在妊娠期高血压疾病中的应用,也未将UA升高到某一阈值作为诊断重度子痫前期的标准。但事实是,很多研究认为妊娠妊娠期高血压疾病孕妇血UA水平随疾病严重程度增加而升高[4,14]。妊娠期高血压疾病时UA升高的原因除了生理性妊娠晚期UA产生增多外,近端肾小管尿酸的再吸收增加和肾排泄减少也是UA升高的重要原因[15]。此外,研究还认为高尿酸水平的妊娠期高血压疾病患者不良妊娠结局发生的风险更高[16],因此《2019年ACOG妊娠期高血压和子痫前期实践指南》[15]也指出虽然UA水平不作为重度子痫前期诊断标准之一,但是动态监测血尿酸水平对妊娠期高血压疾病的病情发展的判断具有一定的帮助。本研究也认为UA可以反映妊娠期高血压疾病的严重程度,UA在正常妊娠组、妊娠期高血压组、非重度子痫前期组和重度子痫前期组中也呈依次上升表现,但在非重度子痫前期组和重度子痫前期组之间差异无统计学意义(t=-0.013,P=0.99),余各组间比,差异均具有统计学意义(P<0.05),非重度子痫前期组和重度子痫前期组之间无显著差异的原因,目前尚不明确,不排除样本量较少所致,有待于日后扩大样本量进一步研究证实。
在非妊娠人群的心衰患者中,BNP、UA与慢性心衰有着密切的联系,NTproBNP与UA呈显著的正相关[1718]。在妊娠人群中,特别是妊娠期高血压疾病严重的人群,两者相关性的研究很少。本研究发现,在正常妊娠时NTproBNP与UA呈显著的正相关,但是在妊娠期高血压和子痫前期的患者中却未发现这一相关性,可能的原因是:在正常妊娠时,随着妊娠的进展,心脏负荷和母胎代谢产物等均呈生理性的增加,此时NTproBNP与UA的变化呈同步性,当出现妊娠期高血压疾病时,心室肌细胞对妊娠期高血压疾病所带来病理生理改变可能更为敏感,从而使得NTproBNP更易发生异常升高,但此时肾排泄功能可能还未显著下降,使得UA上升程度并不明显,从而在妊娠期高血压疾病中出现NTproBNP与UA的变化不同步现象。
综上所述,血N末端脑钠肽前体和尿酸能够反映妊娠期高血壓疾病病情的严重程度,但两者并不具有明显的相关性,建议妊娠期高血压疾病时,对两者进行联合监测,以提高对娠期高血压疾病病情评估的准确性。
参考文献
[1] 胡晓飞,许世佳,孙红,等.三种生物学标志物在心力衰竭患者诊断中的应用[J].中华老年心脑血管病杂志,2018,20(02):161163.
[2] 刘倩,任凤学,苏豪.血尿酸水平与慢性心力衰竭患者心功能状态的相关性分析[J].中国心血管病研究,2018,16(05):424427.
[3] 苏妍,陈永立,高慧.NTproBNP对子痫前期孕妇心功能的评价[J].中国妇幼保健,2016,(02):256259.
[4] 张立军,钟利若,梁训宏.妊娠期高血压疾病患者血清尿素氮、肌酐和尿酸水平变化的探讨[J].临床和实验医学杂志,2016,15(07):682685.
[5] 中华医学会妇产科学分会妊娠期高血压疾病学组.妊娠期高血压疾病诊治指南(2015)[J].中华产科急救电子杂志,2015,04(04):206213.
[6] Chow S L,Maisel A S,Anand I,et al.Role of Biomarkers for the Prevention, Assessment,and Management of Heart Failure:A Scientific Statement From the American Heart Association[J].Circulation,2017,135(22):10541091.
[7] 中国医师协会急诊医师分会,中国心胸血管麻醉学会急救与复苏分会.中国急性心力衰竭急诊临床实践指南(2017)[J].中国急救医学,2017,(12):10631074.
[8] Verlohren S,Perschel F H,Thilaganathan B,et al.Angiogenic Markers and Cardiovascular Indices in the Prediction of Hypertensive Disorders of Pregnancy[J].Hypertension,2017,69(06):11921197.
[9] Giannubilo S R,Pasculli A,Tidu E,et al.Relationship between maternal hemodynamics and plasma natriuretic peptide concentrations during pregnancy complicated by preeclampsia and fetal growth restriction[J].J Perinatol,2017,37(05):484487.
[10]Yu L,Zhou Q,Peng Q,Yang Z.Left ventricular function of patients with pregnancyinduced hypertension evaluated using velocity vector imaging echocardiography and Nterminal probrain natriuretic peptide[J].Echocardiography,2018,35(04):459466.
[11]徐美蘭.正常妊娠妇女血清尿素氮及肌酐水平变化的分析[J].检验医学与临床,2010,07(16):1695,1697.
[12]Gergei I,Krmer B K,Scharnagl H,et al.Renal function, Nterminal ProBType natriuretic peptide, propeptide bigendothelin and patients with heart failure and preserved ejection fraction[J].Peptides,2019,111:112117
[13]郑青敏,赵荣生,林阳.重组人脑利钠肽对急性充血性心衰患者肾功能影响的系统评价[J].中国体外循环杂志,2016,14(03):136140.
[14]Paula L G,Pinheiro da Costa B E,Hentschke M R,et al.Increased proteinuria and uric acid levels are associated with eclamptic crisis[J].Pregnancy Hypertens,2019,15:9397.
[15]American College of Obstetricians and Gynecologists.Gestational hypertension and preeclampsia.ACOG Practice Bulletin No.202[J].Obstet Gynecol,2019,133:125.
[16]俞锡灿,张长英,杨林苗.妊娠期高血压疾病合并高尿酸血症孕妇血清尿酸监测的临床意义[J].中国计划生育学杂志,2018,26(05):397399.
[17]张春红,黄莺,罗晶,等.心力衰竭患者N末端脑钠肽前体与肾功能指标的相关性研究[J].临床内科杂志,2012,29(09):631632.
[18]Oki Y,Kawai M,Minai K,et al.High Serum Uric Acid is Highly Associated with a Reduced Left Ventricular Ejection Fraction Rather than Increased Plasma Btype Natriuretic Peptide in Patients with Cardiovascular Diseases[J].Scientific Reports,2019,09(01):682.

