UPLC测定不同方式干燥的猴头菌中麦角甾醇的含量
寇晓涵 张 强 李洋洋 闫宝松 阎秀峰 郑 健*
(1东北林业大学盐碱地生物资源环境研究中心/东北盐碱植被恢复与重建教育部重点实验室,黑龙江哈尔滨150040;2黑龙江省林副特产研究所黑龙江省非木质林产品研发重点实验室,黑龙江牡丹江157011)
猴头菌(Hericiumerinaceus)属担子菌纲,多孔菌目,齿菌科,猴头属,表面长满具有肉质感的长毛,子实体圆形而粗大,肉质鲜嫩,味道香甜,鲜美可口。研究表明猴头菌的营养及药用价值很高,其中的麦角甾醇成分具有抑菌、抗肿瘤、抗氧化[1]、抗病毒[2]、降血糖和免疫调节[3]等作用。麦角甾醇对抑制肿瘤生长具有非常显著的疗效,可通过抑制血管生长、激活抑癌基因发挥作用[4],或者直接通过细胞毒性直接杀死肿瘤细胞[5],并且麦角甾醇具有显著的抑菌活性[6],新抗菌剂可以用蘑菇来替代[7],其他研究也表明麦角甾醇能够增强免疫力[8],具有免疫调节作用。除此之外,维生素D2的产生是通过紫外光照射麦角甾醇得到的,所以食用菌是天然的维生素D来源[9]。
笔者以猴头菌麦角甾醇为研究对象,采用不同干燥方式对猴头菌进行处理,使用超高效液相色谱检测不同干燥方法对猴头菌中麦角甾醇含量的影响。以往研究中使用高效液相色谱检测麦角甾醇含量居多[10-13],但是笔者使用了UPLC进行检测,具有操作简便、灵敏度高等特点,旨在为今后猴头菌的质量检测和营养分析提供稳定可靠的评估方法,为制药和食品行业开发、应用提供理论依据。
1 材料与方法
1.1 试验原料与试剂
猴头菌采购于黑龙江省海林市土砬子村菇棚,菌株为TC-2;甲醇和乙腈为色谱纯,购自美国Sigma公司;乙醇为分析纯,购自天津市富宇精细化工有限公司;麦角甾醇标准品(纯度为95%),购自成都化夏化学试剂有限公司。
1.2 试验仪器
WatersACQUITYUPLCBEH超高效液相色谱仪,2695紫外检测器,Empower2色谱工作站(美国Waters公司);DZF-6020型真空干燥箱(上海一恒科学仪器有限公司);101-2AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司);SorvallLegendMicro17型离心机(美国Thermo公司);MCFD5-3型冷冻干燥机(美国GoldSIM公司);QW-4HV型微波真空干燥箱(广州科威微波能有限公司);3510EDTH型超声波清洗器(美国Branson公司);Laborota4011型旋转蒸发仪(德国Heidolph公司)。
1.3 色谱条件
采用美国WatersACQUITYUPLCBEH超高效液相色谱仪,联合2695紫外检测器进行检测;色谱柱:WatersACQUITYUPLCBEHC18色谱柱(50mm×2.1mm,1.7µm);流动相为乙腈;流速为0.3mL/min;检测波长282nm,进样体积4µL,室温条件下检测,运行时间为6min。
1.4 试验方法
1.4.1 干燥方法
自然干燥:将猴头菌置于阳光下自然晾干;
加热干燥:将猴头菌置于电热鼓风干燥内,分别以50℃、60℃和70℃加热烘干;
真空冷冻干燥:将猴头菌于-80℃低温放置24h,然后置于真空冷冻干燥机内冻干;
真空干燥:将猴头菌置于真空干燥箱内,设置真空干燥箱内真空度为0.06MPa,温度分别为50℃、60℃和70℃;
微波真空干燥:将猴头菌置于微波真空干燥箱内,分别在1.34kW、2.68kW和4.02kW下干燥。
干燥指标:在干燥皿内放置2d,质量变化不超过2mg为干燥指标。
1.4.2 标准曲线的绘制
精密称取麦角甾醇标准品4.0mg,用无水乙醇溶解并定容至10mL的容量瓶中,得到浓度为400µg/mL的麦角甾醇母液,用无水乙醇依次稀释,得到200、100、50、25、12.5和6.25µg/mL的标准溶液。将上述标准溶液加入到进样瓶中,UPLC检测。分别以麦角甾醇浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,得线性回归方程。
1.4.3 猴头菌样品中麦角甾醇含量的测定
参照刘京晶等[14]的提取方法,精密称取猴头菌粉末0.10g加入到10mL离心管中,然后加入无水乙醇2mL,静置过夜后14000×g离心10min,取上清液于新的离心管中。残渣中加入无水乙醇2mL,90℃恒温水浴30min,14000×g离心10min,合并两次上清液,用无水乙醇定容至10mL,摇匀,0.45µm滤膜过滤,进行UPLC分析。
选择不同提取溶剂(50%乙醇溶液、95%乙醇溶液、无水乙醇、50%甲醇溶液和甲醇)、不同水浴时间(15、30、45、60min)和不同料(g)液(mL)比(1∶20、1∶50、1∶100、1∶200)进行提取工艺的优化。
1.4.4 方法验证
选用最佳的提取条件,对猴头菌样品中麦角甾醇含量进行测定,并检验本方法的稳定性、精密度、重复性和回收率。
1)稳定性:取同一样品溶液,按色谱检测方法,分别在0h、1h、2h、4h、8h、12h测定样品溶液中麦角甾醇的含量。
2)精密度:取同一样品溶液,按色谱检测方法,连续测6次。
3)重复性:取6份同一样品溶液,按色谱检测方法,测定样品溶液中麦角甾醇的含量。
4)加样回收率:精密吸取6份1mL已知浓度的猴头菌试样,其中三份直接用UPLC测定浓度,另外三份分别加入1mL同等浓度的标准品溶液,用UPLC测定其浓度,根据标准曲线方程计算样品中麦角甾醇的含量,计算回收率。
1.4.5 数据分析
所有数据均取三次数据的平均值,用平均值±标准差表示,采用MicrosoftExcel2007进行绘图,运用SPSS17.0Duncan法进行显著性分析。
2 结果与分析
2.1 猴头菌中麦角甾醇的UPLC色谱图
在选定的色谱条件下,麦角甾醇对照品和供试品的峰型良好,保留时间为2.9min(图1)。
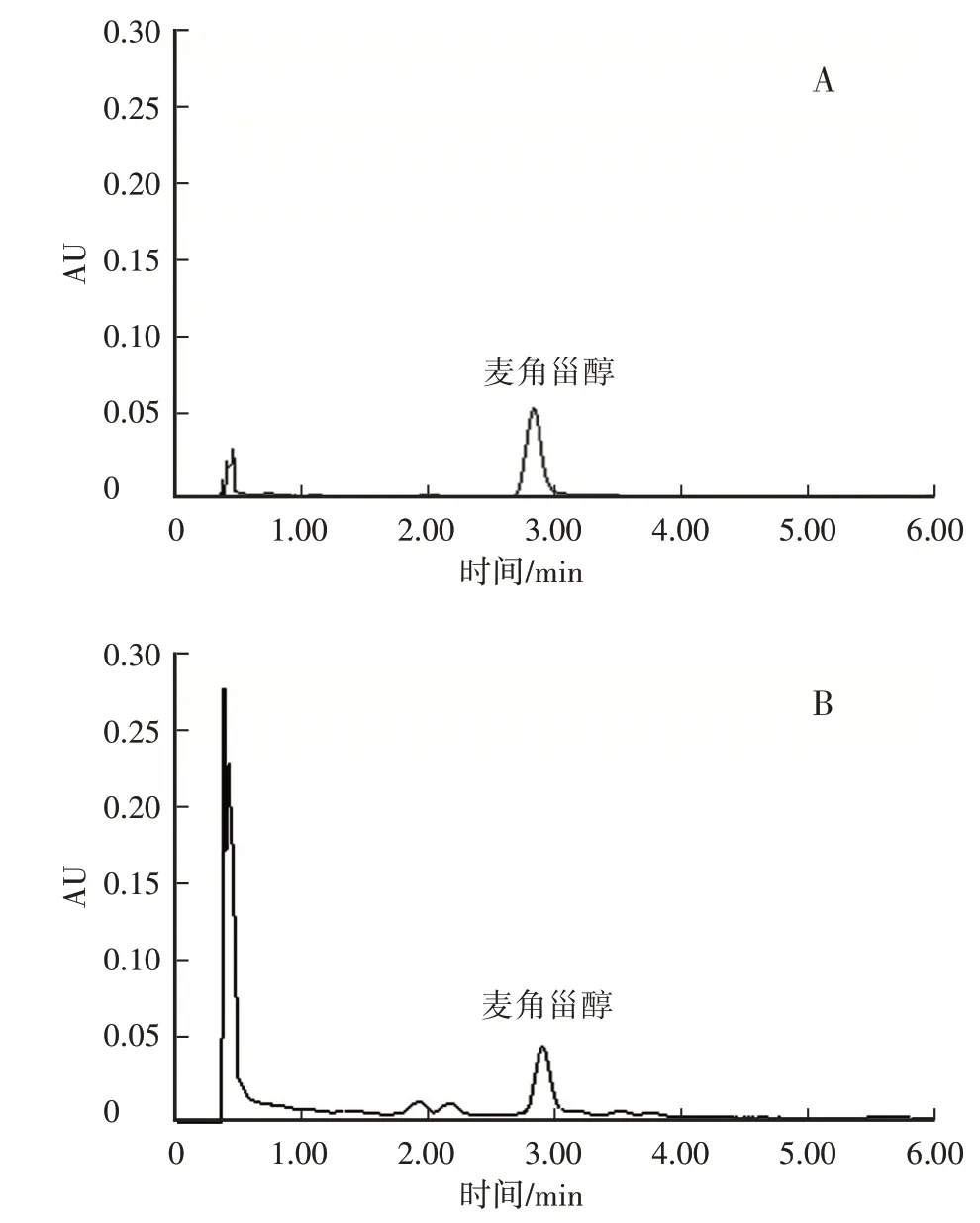
图1 麦角甾醇标准品(A)和供试品(B)的UPLC色谱图
2.2 标准曲线的绘制
以麦角甾醇浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,得线性回归方程Y=9609.4X+4955.6,R2=0.9998。标准曲线见图2。
2.3 单因素试验
2.3.1 提取溶剂对猴头菌样品中麦角甾醇提取含量的影响
将料(g)液(mL)比定为1∶50,水浴时间为30min,使用50%乙醇溶液、95%乙醇溶液、无水乙醇、50%甲醇溶液和甲醇作为提取溶剂,提取猴头菌中的麦角甾醇,并进行UPLC检测。结果如图3。提取溶剂为无水乙醇时,猴头菌中麦角甾醇的含量最高,为(3.25±0.09)mg/g,其次是提取溶剂为100%甲醇的猴头菌样品,麦角甾醇含量为(3.15±0.25)mg/g,两者没有显著性差异,均显著高于95%乙醇作为提取溶剂时提取的样品。而50%乙醇和50%甲醇溶液提取的麦角甾醇的含量远远低于其他溶液,说明乙醇(或甲醇)的浓度越高,提取效果越好。由于甲醇的毒性较大,且价格昂贵,因而选用无水乙醇作为提取溶剂。
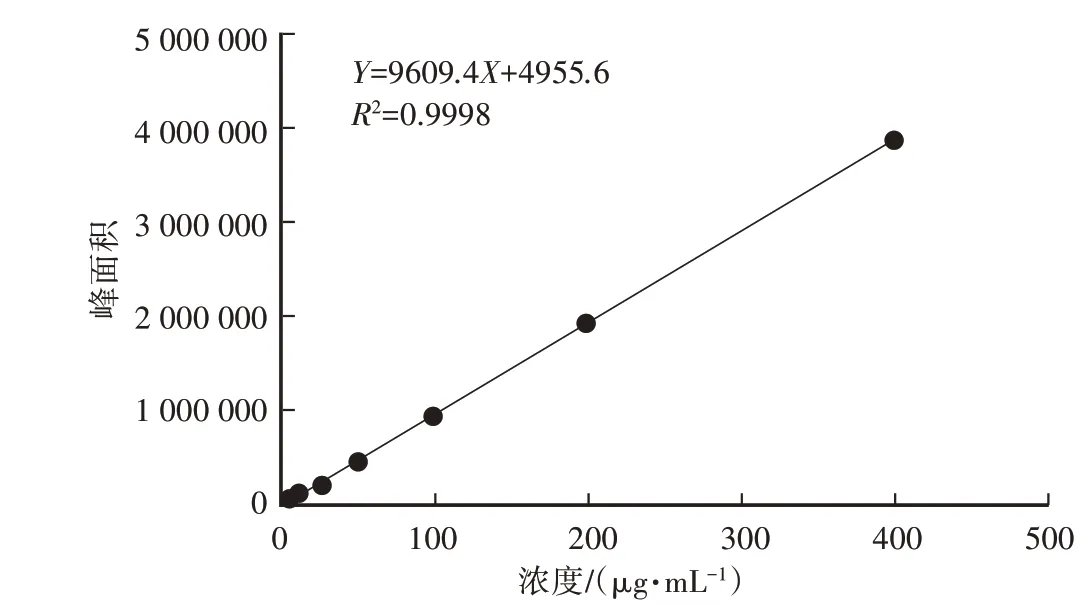
图2 麦角甾醇标准曲线

图3 提取溶剂对猴头菌中麦角甾醇提取含量的影响(P<0.05)
2.3.2 水浴时间对猴头菌样品中麦角甾醇提取含量的影响
将料(g)液(mL)比为1∶50,提取溶剂为无水乙醇,选取不同水浴时间(15min、30min、45min和60min)提取麦角甾醇,研究不同水浴时间对猴头菌中麦角甾醇含量的影响。结果如图4所示:在水浴时间为60min时,麦角甾醇含量最高,为(3.39±0.09)mg/g,其次是水浴时间为30min时,麦角甾醇含量为(3.35±0.34)mg/g,两者之间没有显著差异性。为节省时间,选择30min作为最佳水浴时间。
2.3.3 料液比对猴头菌样品中麦角甾醇提取含量的影响
将无水乙醇作为提取溶剂,水浴时间为30min,样品分别以料液比按照1∶200、1∶100、1∶50、1∶20的比例进行提取,研究不同料液比对猴头菌中麦角甾醇含量的影响,结果如图5所示。料液比为1∶20时,提取得到的甾醇含量最高,为(3.78±0.11)mg/g,其次料液比为1∶200时,甾醇含量为(3.69±0.11)mg/g,两者差异不显著,然后依次是料液比1∶100和1∶50均显著低于料液比为1∶20时提取得到的麦角甾醇含量。因而选用1∶20作为最佳料液比。
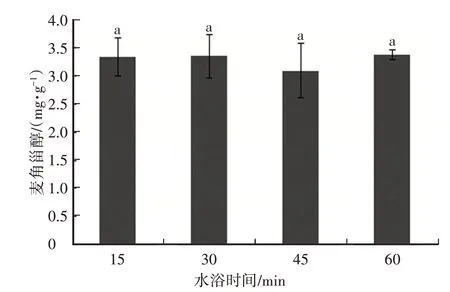
图4 水浴时间对猴头菌中麦角甾醇提取含量的影响(P<0.05)
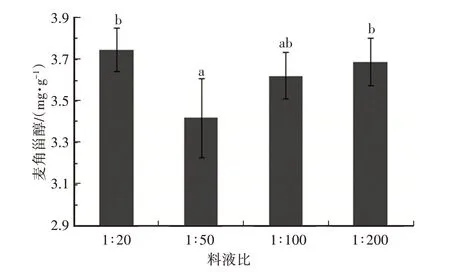
图5 料液比对猴头菌中麦角甾醇提取含量的影响(P<0.05)
2.3.4 方法验证
按照1.4.4的试验方法,对本研究所采用的UPLC方法的稳定性、精密度、重复性和加样回收率进行评价,结果分别见表1和表2。
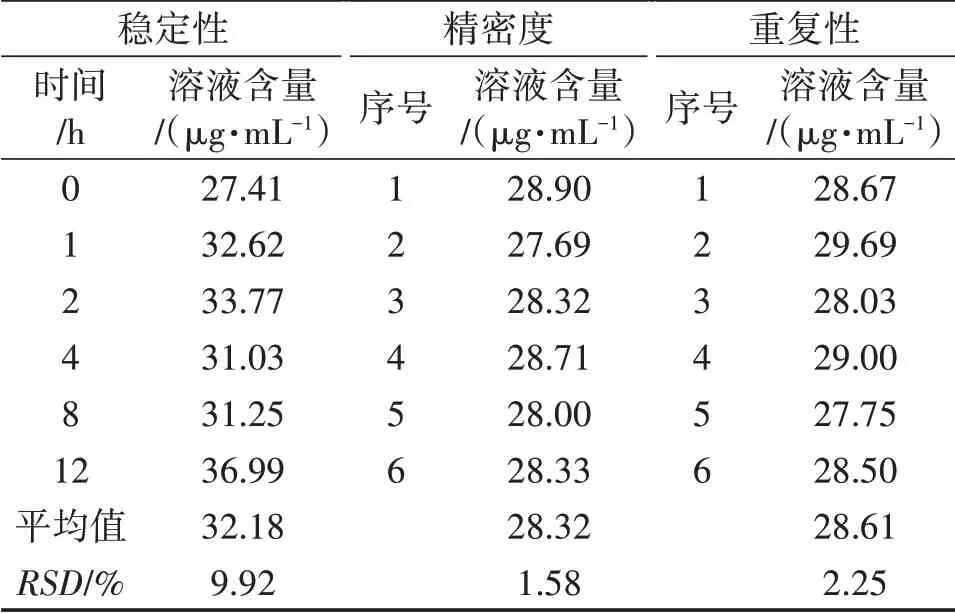
表1 稳定性、精密度和重复性试验结果
由表1可以得出,稳定性试验测得麦角甾醇色谱峰面积的RSD为9.92%,精密度试验测得麦角甾醇色谱峰面积的RSD为1.58%,重复性试验测得麦角甾醇色谱峰面积的RSD为2.25%。
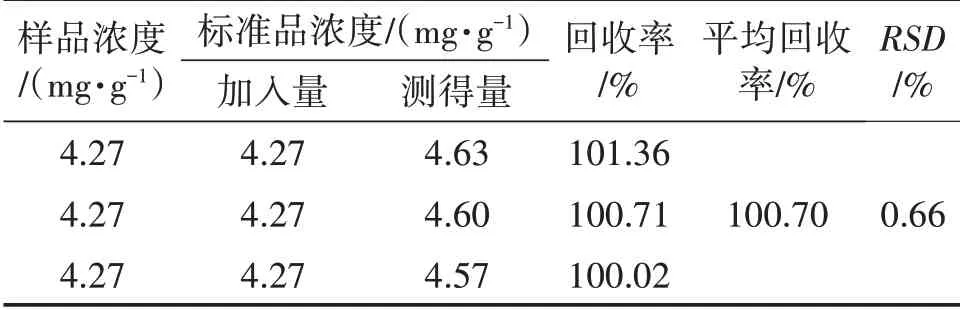
表2 回收率试验的结果
由表2可知,平均回收率为(100.70±0.67)%,RSD为0.66%。该方法灵敏度较高、准确可靠,可重复性较好,比较稳定,适用于对猴头菌样品中麦角甾醇进行定量测定。
2.4 不同干燥方法处理的猴头菌样品中麦角甾醇的含量分析
按照上述得到的最佳的提取条件,提取不同干燥方式处理的猴头菌样品中的麦角甾醇,通过UPLC联合紫外检测器进行检测,根据标准曲线得到麦角甾醇的含量。结果如图6所示,不同干燥方式处理的猴头菌样品中麦角甾醇的含量为2.09~3.89mg/g,而且不同干燥方式之间麦角甾醇的含量差异显著。其中,真空干燥处理的猴头菌中麦角甾醇的含量较其他处理方式得到的猴头菌中麦角甾醇的含量高。而在70℃真空干燥处理的猴头菌中提取得到的麦角甾醇含量最高,为(3.89±0.37)mg/g,其次为60℃真空处理的猴头菌样品,麦角甾醇含量为(3.88±0.28)mg/g,两者之间无显著性差异。微波干燥处理的猴头菌样品提取得到的麦角甾醇含量最低,其中麦角甾醇含量最低的是1.34kW微波干燥下,为(2.09±0.10)mg/g。自然干燥、冷冻干燥和热风干燥处理的猴头菌样品中麦角甾醇的含量没有显著差异。

图6 不同方式干燥对猴头菌样品中麦角甾醇含量的影响(P<0.05)
3 小结与讨论
微波干燥和冷冻干燥会对猴头菌样品中麦角甾醇含量造成影响,经微波干燥的样品中麦角甾醇含量有所降低,鲁文静等[15]研究发现可能是由于微波干燥会导致麦角甾醇结构发生变化,使之分解成维生素D2,从而使麦角甾醇含量降低。理论上说,真空冷冻干燥能够避免样品中有效成分的分解。然而,笔者试验结果表明,冷冻干燥处理的猴头菌样品中麦角甾醇的含量并没有显著高于其他处理方式得到的猴头菌样品中麦角甾醇的含量。这可能与冷冻干燥的技术和工艺有关,也有可能是冷冻干燥导致了样品局部组织细胞水分快速散失,形成的空腔中的空气并没有随之排出,且细胞组织中的酶没有被灭活,从而导致样品组织中有效成分降解[16],因此真空冷冻干燥可能导致麦角甾醇含量降低。真空干燥处理的猴头菌麦角甾醇的含量较其他处理方式得到的猴头菌中麦角甾醇的含量高,且60℃和70℃真空干燥得到的猴头菌样品中麦角甾醇的含量最高。因此,为了提高猴头菌中麦角甾醇的含量,可以优先采用真空加热的方式干燥猴头菌样品。同时,基于猴头菌中麦角甾醇在慢性胃炎方面的显著疗效,猴头菌在食品和医疗行业中具有重要作用,因而研究也为猴头菌的干燥处理方式优化提供了一定理论依据。

