标准剂量表阿霉素新辅助化疗的疗效与安全性及疗效相关因素分析
李蔷薇,单本杰,刘 伟,潘跃银,张敬杰
乳腺癌已成为危害妇女健康最常见的恶性肿瘤之一[1],新辅助化疗的出现为乳腺癌患者提供了降低复发率、获得手术及保乳的机会。目前多种指南建议方案多参照于术后辅助化疗,以蒽环类药物为主。在中国,由于担心蒽环类药物的毒副反应往往没有严格按照标准剂量实施因而疗效不能达到预期。近几年二代测序(next generation sequencing,NGS)技术在乳腺癌治疗领域的应用取得了突破性进展,已有研究使用NGS对乳腺癌致病基因进行测序,发现了新的治疗靶点,并对常见的突变基因与化疗疗效相关性进行了探讨,结果显示部分基因的突变或功能缺失与常见化疗药物的疗效相关[2-3]。该研究将探究标准剂量下表阿霉素(epirubicin,EPI)新辅助化疗的有效性与安全性及疗效相关因素、NGS技术是否可以有效地预测其疗效。
1 材料与方法
1.1 纳入标准及排除标准标准剂量组纳入标准为:患者年龄18~70 岁,经细针或空芯针穿刺活检,病理学证实为Ⅱ~Ⅲ期原发性乳腺癌(除外Luminal A型 );ECOG评分≤2分;有明确可测量的肿瘤病灶,且在MRI扫描中病灶长径≥10 mm;治疗前1周内的血液学及影像学检查需同时满足以下要求:白细胞(white blood cell,WBC)≥3.0×109/L,血红蛋白(hemoglobin,Hb)≥100 g/L,中性粒细胞绝对值(absolute neutrophil count,ANC)≥1.5×109/L,血小板(platelet,PLT)≥90×109/L,总胆红素(total bilirubin,TBIL)≤1.5×正常值上限(upper limit of normal,ULN),碱性磷酸酶(alkaline phosphatase,ALP)、谷草转氨酶(aspartate aminotransferase,AST)和谷丙转氨酶(alanine aminotransferase,ALT)≤2.5×ULN,尿素氮(blood urea nitrogen,BUN)≤1.5×ULN,肌酐(creatinine,Cr)≤1.5×ULN,心脏彩超:左室射血分数的基线≥50%。标准剂量组排除标准为:伴有心脏疾病,已接受过化疗、放疗、内分泌治疗或靶向治疗的患者。低剂量组纳入标准及排除标准与标准剂量组相同,入组患者临床及病理特征与标准剂量组相匹配。
1.2 方法
1.2.1标准剂量组 采用EC-TC 方案(此方案通过伦理委员会审核,项目编号1704a0802148)(EPI 100 mg/m2,环磷酰胺600 mg/m2每2周1次,共4个疗程,序贯紫杉醇80 mg/m2+卡铂血药浓度-时间曲线下面积(area under the curve,AUC)=1.5每周1次共12个疗程)第1个疗程均接受足剂量方案化疗,常规给予预防性止吐治疗,为避免影响第1次化疗后的血液检查,第1个疗程不推荐预防性升白治疗。每一位患者均在第1次新辅助化疗前与手术前接受过乳腺MRI检查,并且均在第1次新辅助化疗前及化疗后第3、5、7、10、14天各检查1次血常规。在第1次新辅助化疗前、化疗后的每周各检查1次血液生化指标。
1.2.2低剂量组 使用FEC-T方案(氟尿嘧啶500 mg/m2,EPI 75 mg/m2,环磷酰胺600 mg/m2每3周1次,共4个疗程,序贯紫杉醇80 mg/m2每周1次,共8个疗程)。
1.2.3曲妥珠单抗使用说明 为了保证所有患者化疗方案的均衡性,所有入组的Her-2过表达患者均来自因经济情况而放弃使用曲妥珠单抗的乳腺癌患者。
1.2.4重组人粒细胞集落刺激因子(G-CSF)及右丙亚胺使用说明 除第1个疗程外其余疗程可进行预防性升白治疗,发生血液系统毒性时可给予升白治疗。给予高龄患者(>65岁)右丙亚胺预防性用药。
1.3 疗效评估标准依据实体肿瘤的疗效评价标准RECIST 1.1进行评定,评估结果分为:完全缓解(CR):所有靶病灶消失;部分缓解(PR):原发肿瘤病灶直径之和比基线肿瘤病灶减少≥30%;疾病稳定(SD):靶病的变化介于CR与PR两者之间(以直径之和的最小值作为参考);疾病进展(PD):以治疗过程中所有测量的原发肿瘤病灶直径之和的最小值为依据,直径之和增加≥20%或出现的新病灶。有效率以CR与PR之和表示。病理学完全缓解(pCR)以ypT0ypN0(乳腺及腋窝淋巴结均无浸润性癌及原位癌残留),ypT0/is ypN0(乳腺及腋窝淋巴结均无浸润性癌残留,但乳腺导管癌原位癌)为标准。标准剂量组分别以RECIST 1.1标准及pCR率评估疗效,低剂量组使用pCR率评估疗效。
1.4 磁共振检查标准MRI检查采用GE Signa HDxT 3.0T MR扫描仪,8通道Torsor相控阵线圈。扫描序均采用常规序列横断位T1WI、矢状位T2WI及DCE-MRI及IVIM-DWI扫描,并于最后补充常规横轴及矢状位增强扫描。其中磁共振动力学指标肿瘤时间-信号强度曲线(TIC)以患者新辅助化疗前的结果为依据分为I型(渐增型)、Ⅱ型(平台型)、Ⅲ(流出型)及Ⅱ~Ⅲ型。其中I型多为良性病变,Ⅲ型为恶性病变。TIC的变化分为:下降(Ⅲ型下降至Ⅱ型或Ⅰ、Ⅲ~Ⅱ型下降至Ⅱ型或Ⅰ型、Ⅱ型下降至Ⅰ型)及上升或无变化(除外上述的变化)。TIC变化中的下降视为化疗有效,上升或无变化视为化疗无效。
1.5 NGS技术及其结果分析使用患者的基线血样标本,对乳腺癌化疗药物相关基因、疗效预测相关基因、驱动基因等416个基因的全部外显子及相关内含子进行测序。将测序结果经生物信息学分析得到与乳腺癌标准剂量新辅助化疗疗效相关的突变基因及单核苷酸多态性(single nucleotide polymorphism,SNP)。
1.6 毒副反应评估标准根据WHO的化疗毒副反应分级标准进行评估,将化疗药物的毒副反应由轻到重分评估为0、I、Ⅱ、Ⅲ、Ⅳ级。分别对骨髓抑制、肝肾功能、心脏不良反应进行评估。
1.7 统计学处理采用SPSS 16.0软件进行数据分析,组间比较选用χ2或Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 标准剂量组与低剂量组患者临床特征经比较,标准剂量组与低剂量组组间在临床特征病理特征上为均衡状态,无显著差异。见表1。
2.2 标准剂量组临床疗效经RECIST1.1标准评估标准剂量组CR率(24例)为36.92%,PR率(33例)为50.77%,SD率(5例)为7.69%,PD率(3例)为4.62%,有效率(CR+PR)(57例)为87.69%。
2.3 标准剂量组与低剂量组pCR率的比较标准剂量组pCR率明显高于低剂量组,差异有统计学意义(P<0.05),见表2。
2.4 毒副反应标准剂量组的Ⅱ~Ⅳ级WBC减少、Ⅲ~Ⅳ中性粒细胞减少、Ⅱ~Ⅲ级肝功能损害、异常心电图发生率高于低剂量组,但差异无统计学意义。见表3。
2.5 标准剂量组疗效相关因素分析分析标准剂量组患者的临床病理特征与pCR率的相关性,结果显示年龄≤50岁、临床分期为Ⅲ期、肿瘤大小为T2期、淋巴结为N1或N2、三阴性乳腺癌、TIC类型为Ⅲ型、Ki-67%≥14%的乳腺癌患者具有较高的pCR率。其中Ki-67%≥14%的pCR率(28.26%)与Ki-67%<14%(15.79%)相比差异有统计学意义(P<0.05),其余特征间的差异均无统计学意义。见表4。
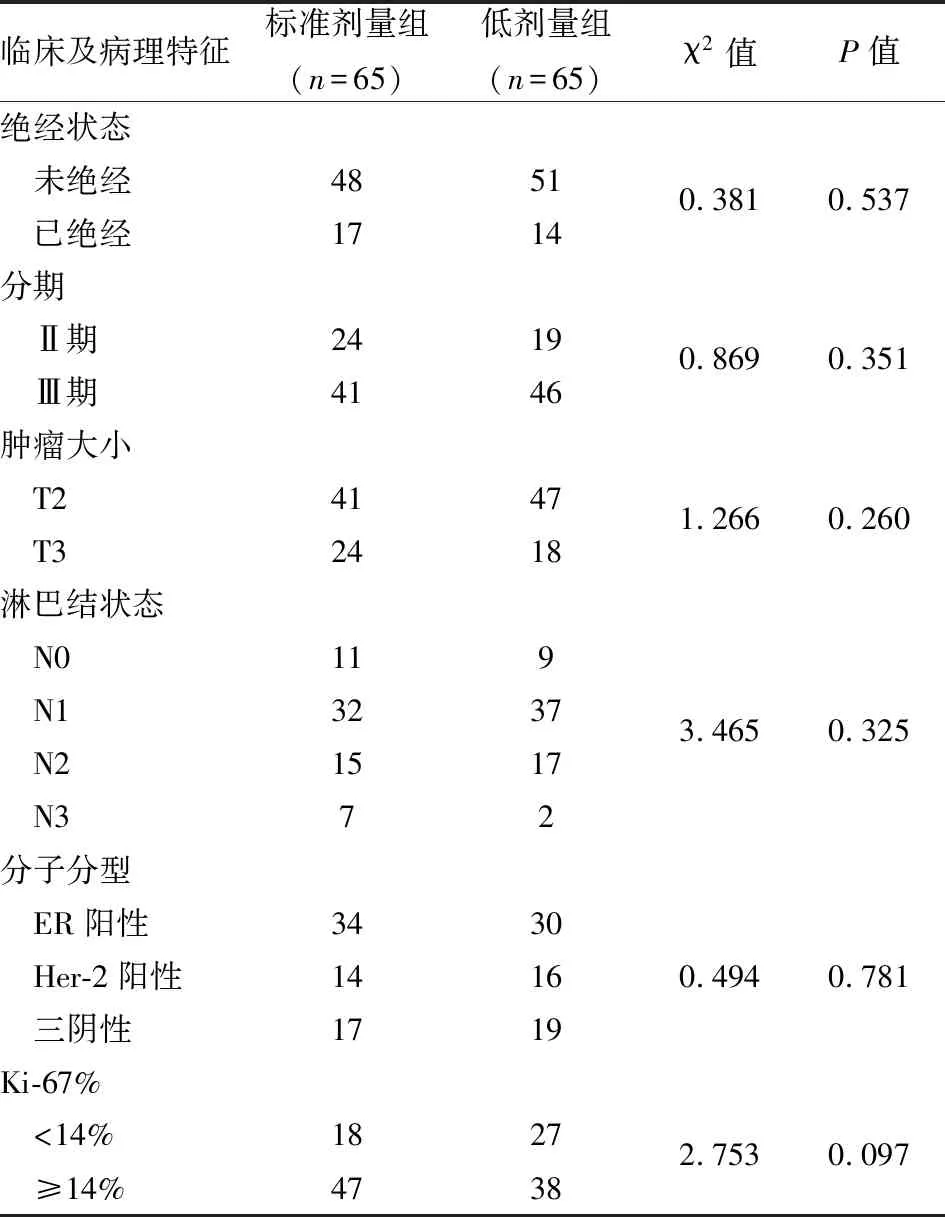
表1 标准剂量组与低剂量组患者临床特征对比

表2 标准剂量组与低剂量组患者pCR比较[n(%)]
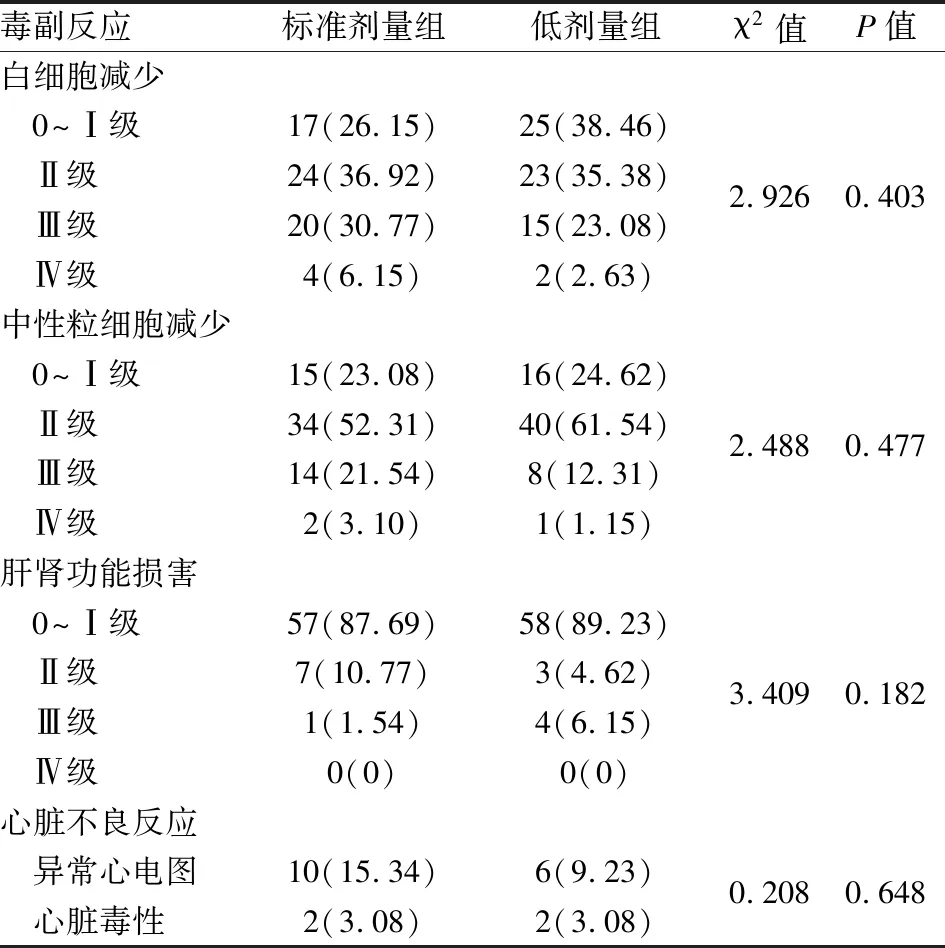
表3 标准剂量组与低剂量组毒副反应比较[n(%)]
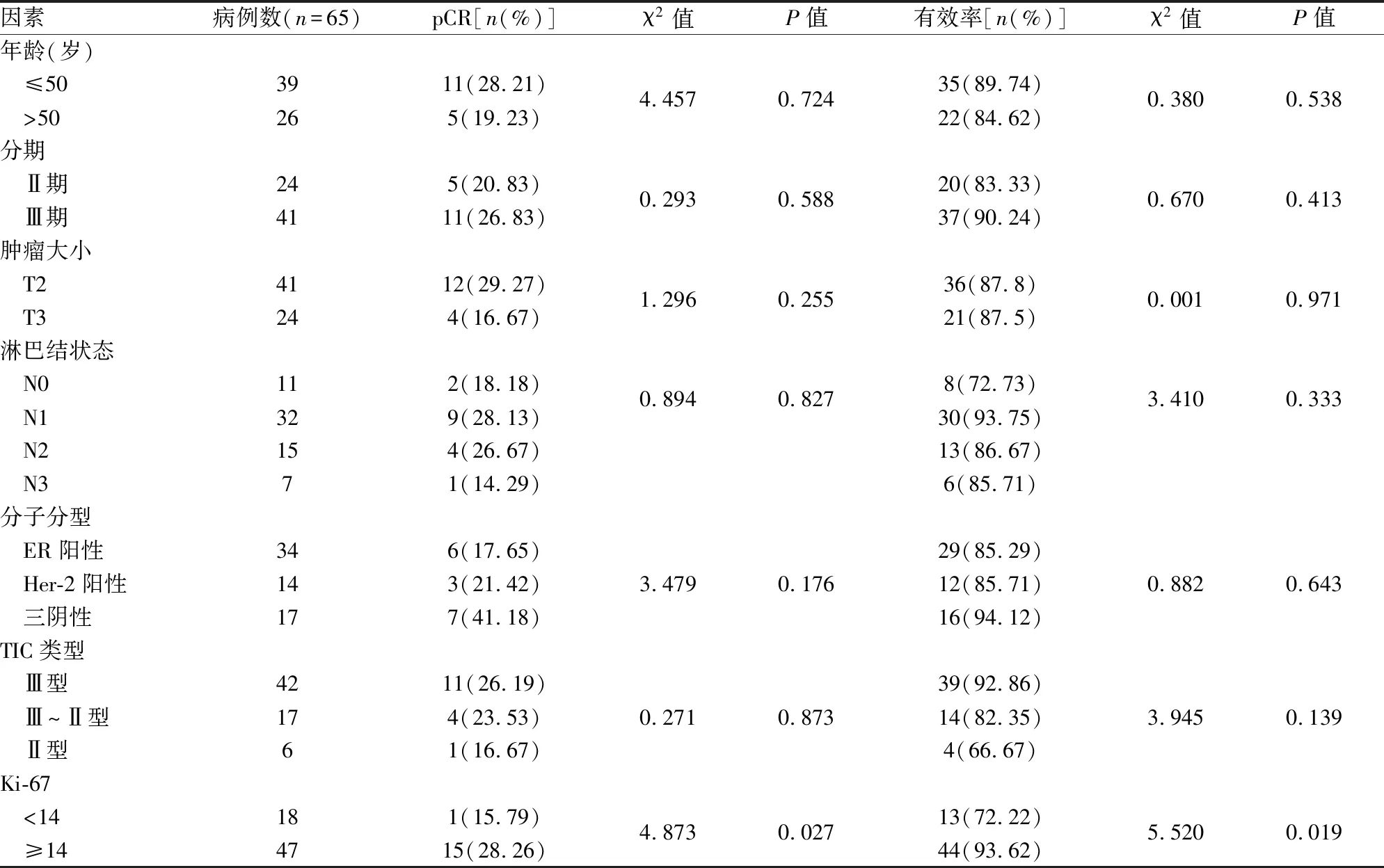
表4 标准剂量组疗效相关因素分析
2.6 标准剂量组NGS结果对标准剂量组中32例患者进行测序,分为pCR组12例,Non-pCR组20例。

图1 标准剂量组32例患者肿瘤特有突变图谱

图2 TP53基因突变位点分布
2.6.1乳腺癌相关基因突变及其与新辅助化疗疗效的关系 标准剂量组32例患者乳腺癌相关基因突变中最常见的变异为TP53、ERBB2、PIK3CA、FBXW7、GATA3。其中TP53突变率最高共8例(25%),TP53在Non-pCR组突变率为30%(6/20),高于pCR组的16.7%(2/12),见图1。TP53所有突变中G376-1T突变意义未知,其余突变均分布于DNA结合域,都为错义突变。见图2、表5。

表5 TP53基因突变位点分析
2.6.2乳腺癌相关SNP及其与新辅助化疗疗效的关系 pCR组与Non-pCR组突变频率有差异的SNP位点包括SETD2rs4082155、XPCrs1870134、CYP2B6rs2279343、ERBB2rs1058808,差异有统计学意义(P<0.05)。其中SETD2rs4082155、XPCrs1870134在Non-pCR组中突变频率更高,而CYP2B6rs2279343、ERBB2rs1058808在pCR组中突变频率更高,见表6。
3 讨论
EPI为蒽环类的常用药物,是阿霉素的同分异构体,作用与阿霉素相似。以往在中国因担心EPI毒副反应普遍使用剂量不足,而EPI的疗效与其剂量存在明显的剂量-效应关系,已有多项研究[4]表明提高EPI的剂量强度或密度可提高其有效性。研究[5]显示中国患者使用低剂量EPI(80 mg/m2)方案时的pCR率远低于国际上使用标准剂量时的pCR率。本研究中标准剂量组pCR率高于低剂量组,且差异有统计学意义(P<0.05)。但增加EPI剂量的同时其毒副反应发生率及程度也会增加[6]。EPI主要毒副反应为骨髓抑制及剂量限制性心脏毒性。本研究中在G-CSF及右丙亚胺的支持下,患者顺利完成标准剂量新辅助化疗,两组间毒副反应差异不显著(P>0.05)。结果表明Ⅱ~Ⅲ期乳腺癌患者使用标准剂量EPI方案有效性优于低剂量,且耐受性良好。

表6 pCR与Non-pCR组突变频率有差异的SNP位点
研究[7]显示Ki-67高表达(Ki-67≥14%)可能与预后不良相关并可作为预测新辅助化疗疗效的敏感指标。本研究在标准剂量组对患者年龄、临床分期、肿瘤大小、淋巴结状态、分子分型、TIC类型、Ki-67表达与疗效的相关性做了分析,结果显示仅Ki-67高表达与低表达间pCR率的差异有统计学意义(P<0.05)。证实了Ki-67作为新辅助化疗疗效预测指标的可行性。
MRI可显示出肿瘤因血管增生而产生不同于正常组织的动力学特征,以时间-信号强度曲线(TIC)表示,乳腺癌患者在接受化疗后肿瘤血管减少或消失,且渗透性下降,最终发生血流动力学变化即血供减少,TIC由高级别向低级别转变如Ⅲ型向Ⅰ型、Ⅱ型转变,其中Ⅲ型往往具有更好的疗效。TIC应用于乳腺癌新辅助化疗疗效预测时具有较高的灵敏度与准确度[8]。本研究中标准剂量组TIC-Ⅲ型的pCR率高于其他类型,与已有研究[9]相符,同样证明TIC-Ⅲ型患者具有更好的疗效。
本研究通过对标准剂量组pCR与Non-pCR患者的乳腺癌相关基因突变及SNP对比分析,发现TP53为突变率最高的乳腺癌相关基因且在Non-pCR组中的突变率高于pCR组,提示TP53基因突变率越高,标准剂量EPI新辅助化疗的疗效越差。并且发现具有SETD2rs4082155、XPCrs1870134这两型SNP的乳腺癌患者可能从标准剂量EPI新辅助化疗中获益较少。而具有CYP2B6rs2279343、ERBB2rs1058808的乳腺癌患者可能更适合接受标准剂量EPI新辅助化疗。TP53是一种抑癌基因,与乳腺癌的发生有关。近年来研究[10]发现,TP53胚系突变在家族或遗传性乳腺癌中,尤其在年轻乳腺癌患者中与乳腺癌的发生相关。SNP是指基因组水平上由单个核苷酸变异所引起的DNA序列多态性,在人类基因组中广泛存在。大多数SNP被认为是功能中性的,但是一些SNP可能与癌症的发生及预后相关。SETD2是组蛋白甲基转移酶,为生成H3K36me3主要催化酶。SETD2 P1962L为胚系突变,并在不同种族的人群中分布频率有差异[11]。XPC即着色性干皮病基因C,参与全基因组的核苷酸剪切修复,有研究[12]显示XPC基因多态性与肺癌发生相关。CYP2B6为血红素-硫醇盐单加氧酶,已知该酶可代谢一些外源性物质,例如环磷酰胺和异环磷酰胺。研究[13]发现携带CYP2B6rs2279343的乳腺癌患者使用阿霉素和环磷酰胺联合方案疗效较差。 ErbB2为表皮生长因子受体家族成员,ErbB2阳性乳腺癌浸润性强,预后较差。ERBB2rs1058808在汉族人群中与乳腺癌ErbB2高表达相关[14]。

