加味不忘散对阿尔茨海默病模型大鼠海马神经元细胞凋亡及炎症反应的影响❋
李晓琼,何玲玲,刘晓蕾,李新毅
(山西医科大学附属医院,太原 030032)
阿尔茨海默病(alzheimer’s disease,AD)是一种不可逆的进行性神经系统退行性疾病,约占老年痴呆的50%~75%,临床症状主要表现为记忆认知功能的进行性减退或伴有人格和情感控制等方面的损害[1],其病理特征主要包括β淀粉样蛋白(Aβ)聚集形成的淀粉样斑块即老年斑,以及tau蛋白过度磷酸化导致的神经元纤维缠结、神经元不同程度的丢失和胶质细胞活化造成的炎症介质释放[2]。目前AD发病机制仍未明确,近年来越来越多的研究发现,Aβ沉积诱导的炎症反应参与AD发生发展[3]。据国际阿尔茨海默病协会(ADI)2016年公布的数据,全世界有4.7×107例痴呆患者,预计到2050年这一数字将增加到1.31×108以上[4]。目前国内AD患者人数已高达800万人之多,这为人类带来沉重的经济和社会负担[5],因此阿尔茨海默病的防治已成为全世界关注的热点。本课题组先前研究提示,加味不忘散可以改善AD大鼠学习记忆能力。本次研究在之前研究基础上探讨其对AD模型大鼠海马神经元细胞凋亡及炎症反应的影响及其发挥作用的可能机制,为中药治疗AD患者提供科学依据。
1 材料与方法
1.1 实验动物与分组
选取8周雄性SD大鼠30只,体质量(275±25)g,由中国军事医学科学院实验中心提供。环境温度为21±1 ℃,湿度适宜,每天12 h光照/12 h 黑暗,自由进食进水。
实验动物随机分为假手术组、模型组、低剂量及高剂量组4组,各组大鼠数量分别为7、8、7、8只。低剂量及高剂量组分别给予低浓度及高浓度加味不忘散,而假手术组、模型组给予蒸馏水。4组大鼠均灌胃给药(每日1次,1 ml/100 g),连续给药20 d。本次实验已通过山西医科大学实验动物伦理委员会审查。
1.2 实验药物
加味不忘散组成:远志20 g,人参、熟地黄各15 g,茯神、当归、白术各10 g,石菖蒲、黄连各5 g,共计100 g(具体剂量基于徐淑云编写的《药理实验方法学》[6]),制成免煎颗粒共22 g。加味不忘散溶液:加味不忘散低浓度 0.15 g/ml(3.67 g免煎颗粒+111 ml煮沸的水)和高浓度0.30 g/ml(7.33 g免煎颗粒+111 ml煮沸的水)。
1.3 主要试剂
Aβ1-42:浓度2 μg/μL,美国Sigma-Aldrich公司;TUNEL 凋亡检测试剂盒:美国Merck-Calbiochem;ELISA试剂盒:上海酶联生物科技有限公司。
1.4 动物模型制备及验证
模型组:将大鼠用10% 水合氯醛麻醉,固定于立体定位仪;用碘伏棉球消毒手术区,在大鼠头顶中间部皮肤作一纵切口,剥离皮下组织,用10% H2O2清洁颅骨表面的肌肉和筋膜并剥离,用颅骨钻双侧颅骨钻孔,定位前囟后3.84 mm,旁开2.2 mm,颅骨下2.5 mm(参考包新民等编写的《大鼠脑立体定位图谱》)[7],双侧海马缓慢注射Aβ1-42(2.5 μl/侧),注射完成留针5 min后局部清洁消毒缝合头项皮肤,伤口局部注射适量庆大霉素以预防感染;假手术组:除双侧海马注射等量生理盐水外,余与模型组相同。
模型验证:造模14 d后进行Morris水迷宫实验验证,大鼠学习记忆功能减退者即为造模成功,之后对造模成功的模型组大鼠连续灌胃给药20 d。
1.5 观察海马组织结构及海马神经元凋亡情况
灌胃结束后用10%水合氯醛麻醉大鼠,用4%多聚甲醛经心脏灌注,于冰块上迅速取出海马后进行石蜡包埋,分别用HE染色、TUNEL观察海马组织结构及海马神经元细胞凋亡情况。
1.6 检测血清及海马炎症因子IL-1β、IL-6、TNF-α含量
血清采集:使用采血针刺入左室心尖处搜集;海马组织:用10%水合氯醛麻醉大鼠,断头取脑后迅速分离双侧海马制备海马匀浆,根据ELISA试剂盒说明书检测炎症因子含量。
1.7 统计学方法
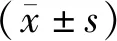
2 结果
2.1 各组大鼠海马组织形态学改变
图1显示,假手术组海马神经元细胞形态正常,结构完整,排列整齐,未见到坏死的神经元;模型组海马神经元细胞可见形态异常,结构疏松,排列紊乱,可观察到胞核固缩;低剂量组和高剂量组海马神经元细胞较模型组均有不同程度改善。
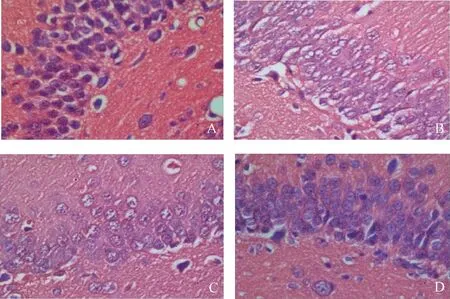
注:A.假手术组;B.模型组;C.低剂量组;D.高剂量组图1 各组大鼠海马组织HE染色比较(×400)
2.2 各组大鼠海马神经元细胞凋亡比较
表1图2显示,假手术组海马组织内凋亡细胞(即TUNEL染色阳性细胞)数极少,模型组较假手术组相比可见到大量的凋亡细胞(P<0.0001),低剂量组与模型组相比未见凋亡细胞数减少(P>1.0),高剂量组较模型组凋亡细胞数减少(P=0.01),而低剂量组凋亡细胞数未见明显差异(P=0.12)。提示Aβ1-42可导致海马神经元细胞凋亡,低浓度加味不忘散未能改善海马神经元凋亡情况,高浓度加味不忘散可以在一定程度上改善Aβ1-42所致的海马神经元凋亡。
2.3 各组大鼠血清及海马组织炎症因子水平比较
表1显示,4组大鼠血清中IL-1β、IL-6、TNF-α含量比较差异无统计学意义(P>0.05),提示加味不忘散并不影响血清炎症因子水平。

表1 各组大鼠血清炎症因子水平、海马TUNEL阳性率及炎症因子水平比较
注:与假手术组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01;与低剂量组比较:△P<0.05
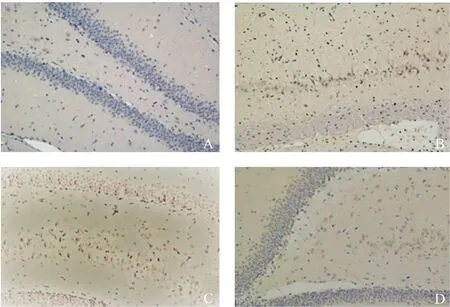
注:A.假手术组;B.模型组;C.低剂量组;D.高剂量组图2 各组大鼠海马组织TUNEL染色比较(×100)
表1显示,海马组织中IL-1β模型组较假手术组水平增加(P<0.0001),低剂量组较模型组比较并未降低(P=0.80),高剂量组较模型组水平降低(P<0.0001),高剂量组较低剂量组水平降低(P=0.01);海马组织中IL-6模型组较假手术组水平增加(P<0.0001),低剂量组较模型组比较并未降低(P=0.60),高剂量组较模型组水平降低(P=0.001),高剂量组与低剂量组比较未降低(P=0.24);海马组织中TNF-α模型组比较假手术组水平增加(P<0.0001),低剂量组、高剂量组较模型组水平降低(P=0.02,P<0.0001),高剂量组较低剂量组相比未减少(P=0.23)。提示Aβ1-42增加了海马组织中IL-1β、IL-6、TNF-α水平,而低浓度加味不忘散能够降低TNF-α水平,但未能降低IL-1β及IL-6水平,高浓度加味不忘散可以减弱Aβ1-42所致的IL-1β、IL-6、TNF-α水平增加。
3 讨论
AD作为老年痴呆最常见的原因,其发病与年龄相关,隐匿起病,病程发展缓慢且不可逆,临床主要表现为近记忆力损害[4]。目前AD病因机制不明,主要包括Aβ神经毒性学说、tau蛋白学说、中枢胆碱能机制及越来越受到重视的神经炎症机制[4]。AD属于中医学“呆病”范畴[8],其中肾虚脑髓失养是其基本病机[9]。目前FDA用于批准治疗AD的药物仅能改善患者的生存质量,对AD病程的进展及患者的长期预后并无显著影响。近年来,针对AD主要病理特征Aβ及tau蛋白免疫治疗因其不可避免的副作用尚未达到预期效果[10]。
结合现代中医药理论基础以及AD相关基础研究,中药在AD治疗方面的优势为防治AD提供了一个新的思路。有研究表明,中药单体姜黄素、丹参素及何首乌等[11]以及中药复方开心散、脑灵汤等[12]在AD临床治疗方面确实存在一定疗效,因此关于中药治疗AD的研究受到人们来越多的关注。
有研究发现,古方不忘散可以改善雌激素缺乏AD大鼠模型认知功能损害,并降低海马组织炎症反应[13]。加味不忘散是在不忘散基础上增加熟地黄、当归、白术、黄连4味中药而成,组方较前更加科学合理。本课题组前期研究已发现,加味不忘散可以改善AD模型大鼠学习记忆功能,说明加味不忘散的神经保护作用[14]。
神经元细胞大量丢失是AD典型的病理特征之一,神经元丢失是以细胞凋亡形式出现[15]。有研究发现,Aβ能够诱导脑内神经元细胞凋亡[16],然而其具体机制仍未明确。此外,神经炎症反应同样在AD的发生发展中发挥重要作用,尤其是在疾病早期阶段,胶质细胞活化启动的恶性循环会促使炎症因子释放和神经元损害[17]。尽管有些临床研究显示AD患者症状略有改善,但非甾体抗炎药的疗效在总体上并不乐观[18]。近年来,中药复方的基础研究[19]体现出中药在抗AD神经炎症反应方面的优势。
本次实验结果显示,模型组海马神经元凋亡及炎症反应较其他组严重,低、高剂量组海马神经元凋亡数量较其余3组有改善,高剂量组同样可以减少Aβ1-42所致的IL-1β、IL-6、TNF-α释放,而低剂量组上述作用不明显。这可能是因为Aβ1-42诱导神经元凋亡及神经炎症反应发生,同时高浓度加味不忘散对神经元凋亡及神经炎症反应有效。在本次实验中尚未对AD模型大鼠神经炎症指标与AD病理学标志物(如Aβ)之间的关系进行探讨,在以后的研究中将会进一步探索加味不忘散对AD大鼠神经炎症相关通路及其与AD典型病理学标志物关系的影响,以期为AD的治疗提供一个新的策略。
综上所述,加味不忘散可以抑制Aβ1-42诱导AD大鼠模型海马炎症因子释放及神经元细胞凋亡,提示加味不忘散可能通过抑制炎症反应发挥其神经元保护作用。

