温度对浒苔生长及不同氮源吸收特性的影响*
葛红星 陈 钊 李 健 常志强 赵法箴
温度对浒苔生长及不同氮源吸收特性的影响*
葛红星1,2陈 钊1李 健1①常志强1赵法箴1
(1. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛 266071;2. 江苏海洋大学 江苏省海洋生物技术重点建设实验室 连云港 222005)
为了评估浒苔()对养殖废水的净化效果,本文研究了4个温度水平(22.5℃、25.5℃、28.5℃和31.5℃)和3种氮源(NH4Cl、NaNO2和NaNO3)下,浒苔对工厂化养殖水环境的适应能力及其净化效果。结果显示,96 h内4个温度处理组浒苔对总氨氮(TAN,包括NH4+-N和NH3)的平均吸收速率分别为14.65、14.88、14.48和13.53 μmol/(g×h),144 h内温度各处理组对亚硝态氮(NO2–-N)的平均吸收速率分别为11.28、10.48、9.11和8.38 μmol/(g×h),144 h内各温度处理组对硝态氮(NO3–-N)的平均吸收速率分别为9.41、8.62、8.80和7.35 μmol/(g×h);温度对浒苔的生长速率有极显著的影响(<0.01),而氮源对浒苔的生长速率有显著影响(<0.05);在相同氮源条件下,浒苔的生长速率随着温度的升高而逐渐降低;在相同温度条件下,氮源为氨氮(NH4+-N)时,浒苔的生长速率大于氮源为NO2–-N和NO3–-N的生长速率;温度和氮源对浒苔叶绿素的含量影响不显著(>0.05),氮源为NH4+-N和NO2–-N时,随着温度的升高,浒苔中叶绿素的含量均有升高的趋势,而氮源为NO3–-N时,浒苔中叶绿素的含量呈先降低再升高的趋势;温度和氮源对浒苔中类胡萝卜素的含量均有极显著影响(<0.01)。随着温度的升高,各处理组浒苔中类胡萝卜素的含量均呈升高的趋势,其中,在28.5℃和31.5℃条件下,NO3–-N处理组浒苔类胡萝卜素的含量明显高于其他各处理组(<0.05)。研究表明,温度在22.5℃~31.5℃范围内,浒苔可以有效吸收TAN、NO2–-N和NO3–-N等对虾工厂化养殖废水中的营养盐,浒苔对NH4+-N的吸收速率最大,但随着水温的升高,浒苔对NH4+-N、NO2–-N和NO3–-N的吸收速率均呈降低的趋势。
浒苔;水温;氮源;生长
近年来,随着养殖技术和设施的不断创新,对虾养殖业取得迅速发展,2014年全国对虾养殖总产量达1.16×106t (渔业统计年鉴, 2015)。然而,养殖对虾对饵料的利用率较低,Thakur等(2003)研究表明,在对虾养殖过程中,收获对虾的含N量在N输出总量中所占比例仅为23%~31%,其他饵料N主要以残饵和排泄物等形式存在于养殖系统中。而残饵、排泄物等经微生物分解后,可能直接或间接产生大量氨氮(NH4+-N)、亚硝态氮(NO2–-N)和硝态氮(NO3–-N)等溶解性无机氮。Funge-Smith等(1999)研究表明,NH4+-N、NO2–-N等可溶性无机氮是造成养殖水体污染的主要原因。养殖水体中的NH4+-N和NO2–-N不仅危害对虾生长和存活,不经合理处理而直接排放,还会引起周围水域的富营养化。面对日益恶化的养殖环境,国内外学者普遍认为,大型海藻能够吸收溶解态的无机N、P等,可以作为养殖废水的“生物净化器”。利用江篱() (李卓佳等, 2007)、海带() (沈淑芬等, 2013)、石莼() (李秀辰等, 1998)和紫菜() (田景波等, 2008)等大型藻类净化富营养化的养殖废水已在国内外获得了广泛应用。
浒苔()含有多种活性物质和丰富的蛋白质,是一种可食用、可药用的大型海藻(郑恒睿等, 2014)。浒苔具有适应能力强、生长速度快的特点。李瑞香等(2009)研究表明,浒苔的最大相对生长率可达27.57%/d。因此,利用浒苔净化对虾养殖废水,不仅具有生态效益,还可以增加经济效益。然而,对虾工厂化养殖水温一般维持在30℃左右(Ge, 2016),而浒苔适宜温度为23℃~26℃(李雪娜等, 2016),这可能对浒苔生长造成一定的影响。另外,对虾工厂化养殖车间为了维持水温的稳定,一般采取隔热保温的设计方案,这就可能造成养殖车间光照强度的减弱及光照时间的缩短。温度和光照是浒苔生长和繁殖的重要生态因子。因此,本研究根据对虾养殖水体生态环境,在低光照条件下,研究不同温度浒苔生长及其对不同氮源吸收的特性,旨在探讨浒苔处理对虾工厂化养殖废水的可能性,为探讨大型海藻转化利用对虾养殖废水中营养物质提供理论依据。
1 材料与方法
1.1 材料来源及预培养
浒苔由浙江省象山旭文海藻开发有限公司提供。浒苔主枝长为2~3 cm。实验用水为无氮海水。将藻体培养于除N以外的f/2培养液中,在光照培养箱(武汉瑞华)中进行3 d氮饥饿条件下的预培养。预培养条件:温度为(25.5±0.5)℃,盐度为29.5±0.5,光照强度为3000 lx,光暗周期为12 h∶12 h,CO2浓度为700 mg/L。预培养期间,每天定时摇瓶4次。接种用海水及锥形瓶均经过高压灭菌处理,且接种在无菌环境中进行。
1.2 实验设计
将经N饥饿处理后的浒苔表面水分吸干,分别称取0.4 g (鲜重),置于装有700 ml f/2培养液的1000 ml锥形瓶中,进行一次性培养。用锡箔封口,每天定时摇瓶4次。实验在光照培养箱(武汉瑞华)中进行,培养条件除温度外与预培养相同。
实验设置3个不同氮源和4个不同温度共12个处理组合。f/2培养液中氮源分别为等浓度(8.83×102µmol/L)的NO3–-N、NO2–-N和NH4+-N。本研究设置4个温度梯度(22.5℃、25.5℃、28.5℃和31.5℃),每个处理设3个重复。
1.3 无机氮的测定
每隔24 h,分别取水样10 ml用于总氨氮(TAN,包括NH4+-N和NH3)、NO2–-N和NO3–-N浓度的测定。测定时使用PhotoLab S12 (WTW, 德国),根据操作说明,直接读取TAN、NO2–-N和NO3–-N浓度。取样及测定方法参见葛红星等(2014)的方法。
1.4 浒苔对不同氮源的吸收速率
分别计算24、48、72、96和144 h时浒苔对不同氮源的吸收速率。在96 h时,水体中NH4+-N处理组中TAN基本消耗殆尽;而在144 h时,水体中NO3–-N和NO2–-N基本消耗殆尽,故浒苔的吸收速率测定到96 h,对NO3–-N和NO2–-N的吸收速率测定到144 h。因此,不同氮源对浒苔生长实验的时间也分别设定为96、144和144 h。
吸收速率(Uptake rate,UR)=(t–t–1)/(24×)
式中,C和C–1分别为和–1时氮源浓度,单位为μmol/L;为浒苔初始鲜重,单位为mg。
1.5 浒苔生长
根据无机氮消耗情况,分别将氮源为NH4+-N、NO2–-N和NO3–-N的各处理组培养96、144和144 h后,将浒苔表面水分吸干后称重,并计算浒苔生长速率。
生长速率(Growth rate,RT)=(W0)/
式中,W和W分别为实验结束和初始时的浒苔鲜重,单位为mg;氮源为NH4+-N时,=96 h,氮源为NO2–-N和NO3–-N时,=144 h。
1.6 光合色素含量分析
分别称取各处理组新鲜浒苔0.2 g,丙酮研磨提取后用于测定叶绿素和类胡萝卜素,测定方法参见徐智广等(2016)的方法。
1.7 统计分析
所得数据以平均值±标准差(Mean±SD)表示。所有数据经Kolmogorov-Simirov检验均符合正态分布(>0.05),单因素方差分析(One-way ANOVA)氨态氮、NO2–-N和NO3–-N浓度和浒苔对氮源吸收速率;用双因素方差分析(Two-way ANOVA)比较浒苔生长速率、类胡萝卜素、叶绿素和温度及氮源差异,双因素方差分析时以温度和氮源为变量,所有数据均经Duncan比较,以<0.05为显著性差异,<0.01为极显著性差异。
2 实验结果
2.1 不同温度培养条件下总氨氮、亚硝态氮和硝态氮浓度变化
从图1A可以看出,TAN浓度下降迅速,第96 小时,22.5℃、25.5℃、28.5℃和31.5℃各温度处理组TAN浓度分别为开始实验时的13.6%、3.2%、4.8%和16.8%。NO2–-N下降缓慢,第144小时,22.5℃、25.5℃、28.5℃和31.5℃各温度处理组NO2–-N浓度分别为1.79、75.00、178.58和235.71 μmol/L (图1B)。NO3–-N浓度下降最慢,实验结束时,22.5℃、25.5℃、28.5℃和31.5℃各温度处理组NO3–-N浓度分别为64.29、78.57、85.71和128.57 μmol/L (图1C)。
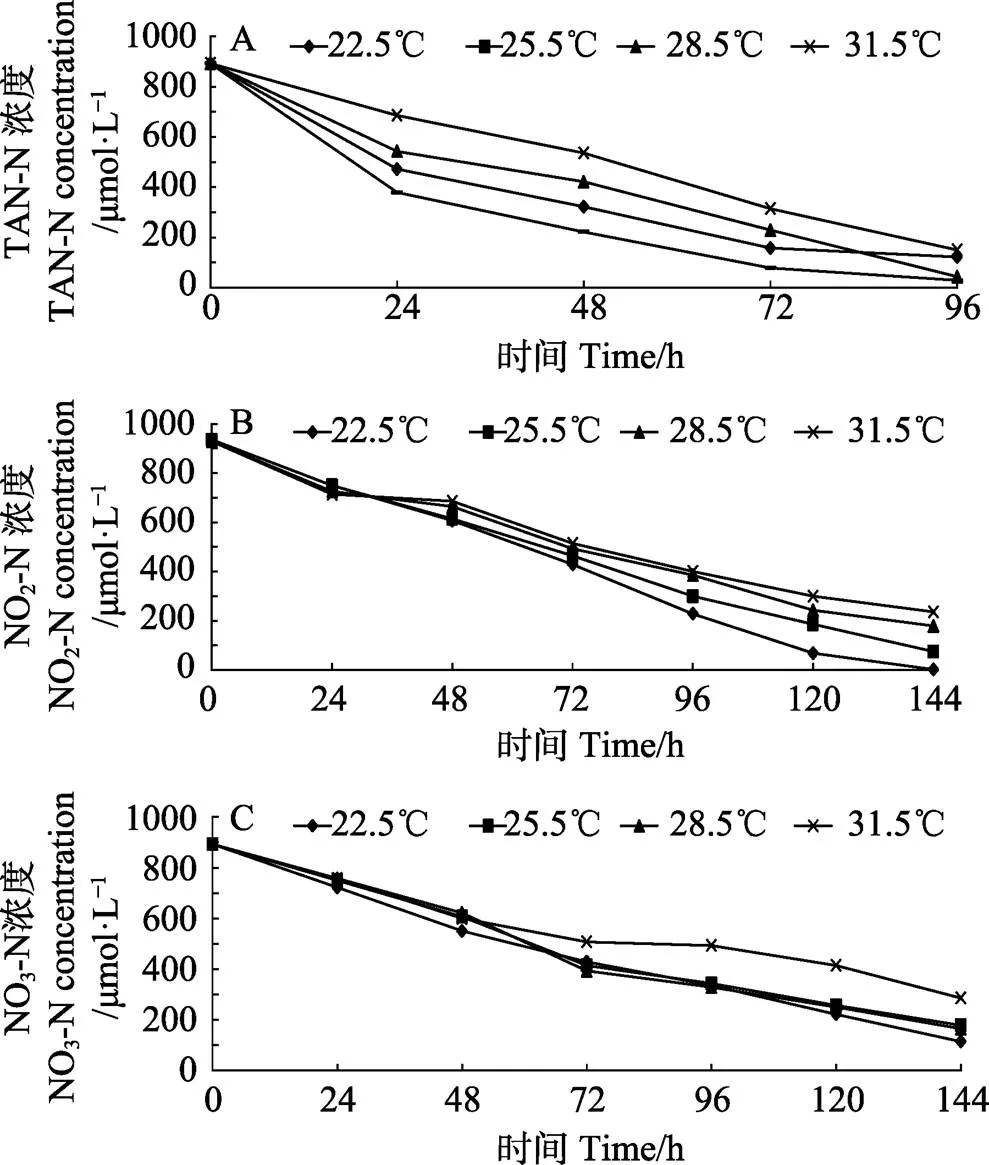
图1 不同温度培养条件下总氨氮(A)、亚硝态氮(B)和硝态氮(C)浓度变化
2.2 不同温度培养下浒苔对不同氮源的吸收速率
从图2可以看出,相同温度条件下,浒苔对TAN的吸收速率最大,其次是NO2–-N,吸收NO3–-N的速率最小。96 h内,22.5℃、25.5℃、28.5℃和31.5℃各温度处理组对TAN的平均吸收速率分别为14.65、14.88、14.48和13.53 μmol/(g×h)。各温度处理组中,浒苔对TAN的吸收速率在24 h时最大,各温度处理组TAN(图2A)的吸收速率分别为30.55、37.29、25.42和15.10 μmol/(g×h),随着时间的延长,22.5℃、25.5℃和28.5℃处理组浒苔的TAN吸收速率呈先下降,48 h后吸收速率趋于稳定,31.5℃处理组浒苔TAN的吸收速率始终在10.93~16.14 μmol/(g×h)之间波动。在不同温度条件下,浒苔对NO2–-N吸收速率见图2B。从图2B可以看出,144 h内各处理组对NO2–-N的平均吸收速率分别为11.28、10.48、9.11和8.38 μmol/(g×h)。实验期间,31.5℃处理组浒苔对NO2–-N的吸收速率始终小于22.5℃、25.5℃和28.5℃处理组。从图2C可以看出,144 h内各处理组对NO3–-N的平均吸收速率分别为9.41、8.62、8.80和7.35 μmol/(g×h)。22.5℃处理组浒苔对NO3–-N的吸收速率随着实验的进行呈下降趋势。25.5℃和28.5℃处理组对NO3–-N的吸收速率呈先上升再下降的趋势,在72 h时均达极值,分别为13.97和16.57 μmol/(g×h)。31.5℃处理组吸收速率呈先降低、96 h达最低值、后上升的趋势。
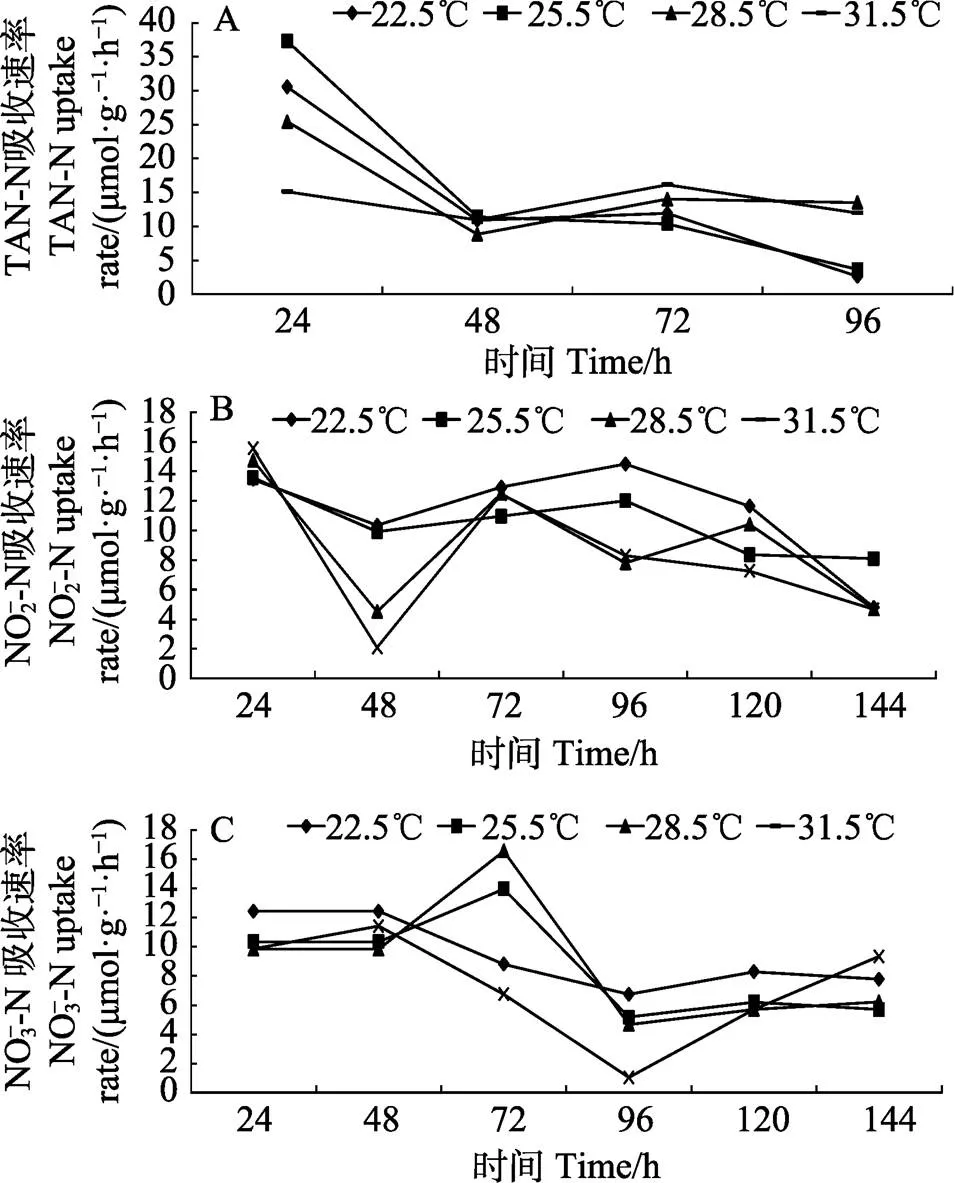
图2 不同温度下浒苔对总氨氮(A)、亚硝态氮(B)和硝态氮(C)的吸收速率
2.3 不同温度和氮源条件下浒苔生长及叶绿素a组成
不同温度和氮源条件下,浒苔生长速率、叶绿素和类胡萝卜素含量的变化情况见表1。从表1可以看出,各氮源处理条件下,温度对浒苔的生长速率有极显著的影响(<0.01),而温度处理条件下,氮源对浒苔的生长速率有显著影响(<0.05)。相同氮源条件下,浒苔的生长速率随着温度的升高而逐渐降低,相同温度条件下,氮源为NH4+-N时,浒苔的生长速率大于NO2–-N和NO3–-N。其中,当温度为22.5℃,氮源为NH4+-N时,浒苔的生长速率最大;温度为31.5℃,氮源为NO3–-N时,浒苔的生长速率最小。温度和氮源对叶绿素的含量均有影响,但影响不显著(>0.05)。氮源为NH4+-N和NO2–-N时,随温度的升高,浒苔中叶绿素的含量均有升高的趋势,而氮源为NO3–-N时,浒苔中叶绿素的含量呈先降低再升高的趋势。温度和氮源对浒苔中类胡萝卜素的含量均有极显著影响(<0.01)。在22.5℃、25.5℃和28.5℃条件下,氮源为NH4+-N和NO2–-N时,浒苔类胡萝卜素含量无显著差异(>0.05),但均明显低于NO3–-N处理组(<0.05)。随着温度的升高,各处理组浒苔中类胡萝卜素的含量均呈升高的趋势,其中,在28.5℃和31.5℃条件下,NO3–-N处理组浒苔中类胡萝卜素的含量明显高于其他各处理组(<0.05)。温度和氮源对浒苔生长速率、叶绿素和类胡萝卜素含量均有交互作用。
表1 不同温度和氮源条件下浒苔生长及叶绿素组成

Tab.1 The growth of U. prolifera at different temperature and nitrogen source
注:不同字母表示差异显著
Note: Different letters indicated significant differences
3 讨论
3.1 不同温度条件下浒苔对不同氮源的吸收
本研究发现,在低光照条件下,4个温度处理组中,浒苔对NH4+-N、NO2–-N和NO3–-N均有吸收能力,表明温度在22.5℃~31.5℃范围内,浒苔可以正常存活。相同温度条件下,浒苔对NH4+-N的吸收速率大于NO2–-N和NO3–-N的吸收速率,表明浒苔对NH4+-N有较强的吸收能力。这与徐智广等(2016)关于氮源加富条件下,海带对NH4+-N的吸收速率大于硝氮的结果是一致的。这可能是因为大型海藻对NO3–-N的吸收为主动运输,需要耗费能量,而对NH4+-N的吸收是不需要耗能的被动扩散(Pritchard, 2015)。本研究发现,同一氮源条件下,浒苔对无机氮的吸收速率随着温度的升高而降低。徐军田等(2013)研究了浒苔对无机碳的利用对温度响应的机制发现,温度对浒苔利用无机碳的能力有显著影响,高温(30℃)条件下,缘管浒苔()的最大光合作用能力与最适温度相比下降了56%。表明温度高于浒苔的最适温度会抑制浒苔的光合作用能力。而张晓红等(2012)研究了不同温度(5℃~32℃)、不同盐度(14、20、26和32)对浒苔群体增长和生殖的影响,发现温度为20℃时,浒苔特定生长率最高,达37.80%。而本研究中,最低温度为22.5℃,随着温度的升高,浒苔对无机氮的利用速率降低,而对虾工厂化养殖水温往往在30℃左右(Ge, 2016),表明对虾工厂化养殖由于水温较高,可能会影响浒苔对无机氮的净化速率。
3.2 不同温度条件下氮源对浒苔生长速率的影响
包括浒苔在内的大型海藻的生长都是一个通过机体光合作用积累C、N代谢产物的复杂的生理过程 (Xu, 2009)。该过程受到温度(王阳阳等, 2010)、光照(程丽巍等, 2010)、营养盐(李文慧等, 2015)等诸多生态因子的调控。本研究发现,相同氮源条件下,温度对浒苔的生长速率有极显著影响。吴洪喜等(2000)研究了温度对浒苔生长的影响表明,浒苔在水温为10℃~30℃范围内,均可以正常生长,最适生长水温为15℃~25℃。本研究发现,在22.5℃~31.5℃温度范围内,浒苔均能保持生长,但相同氮源情况下,随着温度的升高,浒苔的生长速率呈先升高后下降趋势,可能超过其最适生长范围。水温超过藻类生长的最适范围,即可能损伤其叶绿体构造,抑制光合效率 (Wen, 2005),这与吴洪喜等(2000)关于浒苔最适生长水温的研究也是一致的。忻丁豪等(2009)研究发现,水温高于32℃,浒苔仅能存活3 d。而本研究中,浒苔在31.5℃水温条件下能正常生长,这可能是因为浒苔的生长是一个受到水温、光照和营养盐等诸多生态因子综合作用的生理过程。本研究发现,相同温度条件下,氮源对浒苔的生长速率有显著影响。藻类的生长与N营养盐吸收和N代谢产物的积累及调节分配密切相关(徐智广等, 2016)。陈建业等(2014)研究了不同氮源、磷源营养盐对亚心形扁藻()生长的影响发现,以NH4+-N为氮源时,其生长速率大于以NO3–-N为氮源,这与本研究结果是一致的。一般情况下,因为藻类对NH4+-N吸收属于被动运输,而NO2–-N和NO3–-N等其他形式的氮源属于主动运输,因此,NH4+-N更易于被藻体吸收(Pritchard, 2015),这与本研究中关于浒苔对NH4+-N的吸收速率大于NO2–-N和NO3–-N的结论也是一致的。而陆德祥等(2004)研究了不同氮源对球等鞭金藻() 3011增殖的影响,发现NO3–-N的增殖效果好于氨态氮。这与本研究的结果也是不矛盾的。因为,不同氮源的形态及其浓度对藻类生长的影响存在差异。
3.3 不同温度条件下氮源对浒苔主要光合色素成分的影响
大型海藻光合色素的组成及含量在一定程度上可以反映生态因子对其光合作用强度的影响(王阳阳等, 2010)。其中,叶绿素是藻类最丰富,也是最基本的光合色素(梁磊等, 2014),其含量受光照(卢晓等, 2014)、营养盐(徐智广等, 2016)及温度(卢晓等, 2014)等影响。本研究中,温度和氮源对浒苔叶绿素的含量均有影响,表明温度和氮源的改变,均可能影响浒苔中叶绿素的含量,进而影响浒苔的生长速率,这也与本研究中温度和氮源影响浒苔生长速率的结论是一致的。氮源为NH4+-N和NO2–-N时,随着温度的升高,浒苔叶绿素的含量均有升高的趋势,而氮源为NO3–-N时,浒苔叶绿素的含量呈先降低再升高的趋势。叶绿素含量升高,这可能是因为本研究中光照强度较低,适当的升温,浒苔通过提高叶绿素等光合色素含量最大限度的利用光能,以适应低光照强度。这也说明浒苔可以适应对虾养殖较低光照的环境,进而起到净化水质的作用。类胡萝卜素是藻类重要的光合色素之一,起着吸收光能的作用,也是机体内重要的抗氧化剂 (Xia, 2005)。本研究中,温度和氮源对浒苔中类胡萝卜素的含量均有极显著的影响,这是因为随温度及氮源等营养盐的变化,导致机体吸收和传递光能的过程可能有所改变,以避免叶绿素的氧化损伤 (汤俊等, 2010)。随着温度的升高,各处理组浒苔中类胡萝卜素的含量均呈升高的趋势,这可能是随着水温的升高,导致机体内产生氧化胁迫,机体通过产生类胡萝卜素以解除氧化胁迫(Xia, 2005)。色素的合成是一个消耗能量的过程,藻类大量合成色素,会导致生长能分配的减少,导致其生长受到抑制(Han, 2008)。这也与本研究中浒苔的生长速率随着温度升高而呈降低的趋势是一致的。
Chen JY, Lin D, Huang J,. Effect of different nitrogen and phosphorus sources on the growth of. Journal of Fujian Fisheries, 2014, 36(4): 258–263 [陈建业, 林丹, 黄健, 等. 不同氮源、磷源营养盐对亚心型扁藻()生长的影响. 福建水产, 2014, 36(4): 258–263]
Cheng LW, Zou DH, Zheng QS,. Effects of temperature and light intensity on the nitrate uptake kinetics of nitrogen starved and replete.Chinese Journal of Ecology, 2010, 29(5): 939–944 [程丽巍, 邹定辉, 郑青松, 等. 光照和温度对氮饥饿及饱和营养条件下石莼()的硝态氮吸收动力学影响. 生态学杂志, 2010, 29(5): 939–944]
Funge-Smith SJ, Briggs MRP. Nutrient budgets in intensive shrimp ponds:Implications for sustainability. Aquaculture, 1999, 164(1–4): 117–133
Ge HX, Li J, Chang ZQ,. Effect of microalgae with semicontinuous harvesting on water quality and zootechnical performance of white shrimp reared in the zero water exchange system. Aquacultural Engineering, 2016, 72–73: 70–76
Ge HX, Li J, Chen P,The immune response ofand its susceptibility tounder stress caused by ammonia nitrogen at different concentrations. Progress in Fishery Sciences, 2014, 35(6): 76–82 [葛红星, 李健, 陈萍, 等. 氨氮胁迫下凡纳滨对虾对副溶血弧菌的易感性. 渔业科学进展, 2014, 35(6): 76– 82]
Han T, Kang SH, Papk J S,. Physiological responses ofandcopper exposure. Aquatic Toxicology, 2008, 86(2): 176–184
Li RX, Wu XW, Wei QS,. Growth ofunder different nutrient conditions. Advances in Marine Science, 2009, 27(2): 211–216 [李瑞香, 吴晓文, 韦钦胜, 等. 不同营养盐条件下浒苔的生长. 海洋科学进展, 2009, 27(2): 211–216]
Li WH, Zhu M, Liu R,. Effects of nitrogen and phosphorus nutrients on growth, photosynthesis and enrichment of nitrogen and phosphorus of. Journal of Ecology and Rural Environment, 2015, 31(4): 553–558 [李文慧, 朱明,刘冉, 等. 氮磷营养盐因子对缘管浒苔生长、叶绿素荧光特性和氮磷富集的影响.生态与农村环境学报, 2015, 31(4): 553–558]
Li XC, Zhang GC, Cui YA. Static purification ofkjellman for abalone effluents. Transactions of the Chinese Society of Agricultural Engineering, 1998, 14(1): 173–176 [李秀辰, 张国琛, 崔引安. 孔石莼对养鲍污水的静态净化研究.农业工程学报, 1998, 14(1): 173–176]
Li XN, Han Z, Liu XJ,. A study of the relationship between the processes of Enteromorpha and Sargassum and sea surface temperature.Transactions of Oceanology and Limmology, 2016(5): 125–130 [李雪娜, 韩震, 刘贤博, 等. 浒苔和马尾藻的生消与海表面温度的相互影响研究. 海洋湖沼通报, 2016(5): 125–130]
Li ZJ, Luo YS, Wen GL. A research on purification of intensive shrimp effluent byvar. liuiand probiotics. Journal of Tropical Oceanography, 2007, 23(6): 72–75 [李卓佳, 罗勇胜, 文国梁. 细基江蓠繁枝变种与益生菌净化养殖废水的研究.热带海洋学报, 2007, 23(6): 72–75]
Liang L, Fang Z, Huang HQ,. The effect of temperature on the growth and pigment content of. Marine Sciences, 2014, 38(3): 86–90 [梁磊, 方哲, 黄惠琴, 等. 温度对琼枝麒麟菜生长及色素含量的影响.海洋科学, 2014, 38(3): 86–90]
Lu DX, Zhang M, Wang XH,. Effects of different nitrogen sources on proliferation ofsphaeroides 3011. Journal of Aquaeulture, 2004, 25(3): 21–23 [陆德祥, 张敏, 王小红. 不同氮源对球等鞭金藻3011增殖的影响. 水产养殖, 2004, 25(3): 21–23]
Lu X, Li MZ, Wang ZG,. Effects of different temperature and illumination intensity on growth and biochemical constituents of.Journal of Fishery Sciences of China, 2014, 21(6): 1236–1243 [卢晓, 李美真, 王志刚, 等. 光照和温度对脆江蓠的生长和生化组成的影响. 中国水产科学, 2014, 21(6): 1236–1243]
Ministry of Agriculture Fishery Administration. China fishery statistical yearbook. Beijing: China Agricultural Press, 2015, 17–25 [农业部渔业渔政管理局. 中国渔业统计年鉴. 北京: 中国农业出版社, 2015, 17–25]
Pritchard DW, Hurd CL, Beardall J,. Restricted use of nitrate and a strong preference for ammonium reflects the nitrogenecophysiology of a light-limited red alga. Journal of Phycology, 2015, 51(2): 277–287
Shen SF, Wei T, Sun QH,. Bioremediation of mariculture area byin Luoyuan Bay. Journal of Fujian Normal University (Natural Science), 2013, 29(4): 103–108 [沈淑芬, 魏婷, 孙琼花, 等. 海带对罗源湾养殖区海水的生物修复研究.福建师范大学学报(自然科学版), 2013, 29(4): 103–108]
Tang J, Song LR, Sun SS,. Recruitment ability ofunder low light low temperature combination. Environmental Sciences,2010,31(12): 2932–2937 [汤俊, 宋立荣, 孙松松, 等. 低光低温联合作用对铜绿微囊藻复苏能力的影响. 环境科学, 2010, 31(12): 2932–2937]
Thakur DP, Lin CK. Water quality and nutrient budget in closed shrimp () culture systems. Aquacultural Engineering, 2003, 27(3), 159–176
Tian JB, Wang YG, Sun XT,. The change of dissolved oxygen and pH of themarine microalgae cultivation in air- lift photobioreactor. Fishery Modernization, 2008, 35(2): 1– 5 [田景波, 王印庚, 孙修涛, 等. 海水池塘养殖废水净化减排系统的设计和工程化技术. 渔业现代化, 2008, 35(2): 1–5]
Wen X, Gong H, Lu C. Heat stress induces an inhibition of excitation energy transfer from phycobilisomes to photosystemⅡ but not to photosystem I in a cyanobacterium. Plant Physiology and Biochemistry, 2005, 43(4): 389–395
Wang YY, Huo YZ, Cao JX,. Influence of low temperature and low light intensity on growth of. Journal of Fishery Sciences in China, 2010, 17(3): 593–599 [王阳阳, 霍元子, 曹佳春, 等. 低温、低光照强度对扁浒苔生长的影响. 中国水产科学, 2010, 17(3): 593–599]
Wu HX, Xu AG, Wu MN. Effects of nitrogen and phosphorus nutrients on growth, photosynthesis and enrichment of Nitrogen and Phosphorus of. Journal of Ecology and Rural Environment (Natural Science), 2000, 19(3): 230–234 [吴洪喜, 徐爱光, 吴美宁. 浒苔实验生态的初步研究. 浙江海洋学院学报(自然科学版), 2000, 19(3): 230–234]
Xia JR, Gao KS. Impacts of elevated CO2concentration on biochemical composition, carbonic anhydrase, and nitrate reductase activity of freshwater green algae. Journal of Integrative Plant Biology, 2005, 47(6): 668–675
Xin DH, Ren S, He PM,. Preliminary study on experimental ecology ofin Yellow Sea. Marine Environmental Science, 2009, 28(2): 190–192 [忻丁豪, 任松, 何培民, 等. 黄海海域浒苔属()生态特征初探. 海洋环境科学, 2009, 28(2): 190–192]
Xu JT, Wang XW, Zhong ZH,. The mechanism of the characters of inorganic carbon acquisition to temperature in twos. Acta Ecologica Sinica, 2013, 33(24): 7892–7897 [徐军田, 王学文, 钟志海, 等. 两种浒苔无机碳利用对温度响应的机制. 生态学报, 2013, 33(24): 7892–7897]
Xu ZG, Gao KS. Impacts of UV radiation on growth and photosynthetic carbon acquisition in(Rhodophyta) under phosphorus-limited and replete conditions. Functional Plant Biology, 2009, 36(12): 1057–1064
Xu ZG, Wu HY, Sun FX,. Effects of enrichment with different nitrogen sources on growth, photosynthetic carbon fixation and nitrogen uptake of. Journal of Fisheries of China, 2016, 40(4): 577–584 [徐智广, 吴海一, 孙福新, 等. 不同氮源加富对海带生长、光合固碳和氮吸收特性的影响.水产学报, 2016, 40(4): 577–584]
Zhang XH, Wang ZL, Li RX,. Microscopic observation on population growth and reproduction ofunder different temperature and salinity. Advances in Marine Science, 2012, 30(2): 276–283 [张晓红, 王宗灵, 李瑞香, 等. 不同温度、盐度下浒苔() 群体增长和生殖的显微观测.海洋科学进展, 2012, 30(2): 276– 283]
Zheng HR, Li RG. A preliminary study on extraction of protion fromin Qingdao sea area and its antineoplastic activity. Acta Acdaemiae Medicinae Qingdao University, 2014, 50(2): 124–126 [郑恒睿, 李荣贵.青岛海域浒苔蛋白提取及其抗肿瘤活性的初步研究. 青岛大学医学院学报, 2014, 50(2): 124–126]
Effects of Temperature on the Growth Rate and Nitrogen Uptake of
GE Hongxing1,2, CHEN Zhao1, LI Jian1①, CHANG Zhiqiang1, ZHAO Fazhen1
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences,Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao 266071; 2. Jiangsu Key Laboratory of Marine Bioresources and Environment, Jiangsu Ocean University, Lianyungang 222005)
Marine macroalgae is used as a biofilter for aquaculture wastewater treatment. Marine macroalgae is used as a biofilter for aquaculture wastewater treatment.was cultivated at four different water temperatures (22.5℃, 25.5℃, 28.5℃, and 31.5℃) with a different inorganic nitrogen source (NH4Cl, NaNO2, and NaNO3) for each temperature to evaluate the purification efficiency of marine macroalgaeon wastewater; all measurements were carried out in triplicate. The results show that, in the temperature range 22.5℃~31.5℃, the TAN uptake rates were 14.65, 14.88, 14.48, and 13.53 μmol/(g·h) in 96 h; the nitrite and nitrate uptake rates were 11.28, 10.48, 9.11, and 8.38 μmol/(g·h) and 9.41, 8.62, 8.80, and 7.35 μmol/(g·h) in 144 h, respectively. Both the temperature (<0.01) and the nitrogen source (<0.05) had significant effects on the growth rate of. The growth rate decreased as the temperature increased; further, at the same temperature with an ammonium source,showed the largest growth rate, followed by that with nitrite and nitrate sources. For the ammonium and nitrite sources, the content of chlorophyll(Chl-) increased with an increase in temperature; however, for the nitrate source, the content of Chl-decreased first and then increased. Both the temperature and the nitrogen source had a significant effect on the carotenoid content (<0.01), which increased with an increase in temperature. In the temperature range of 28.5℃~31.5℃, the carotenoid content in the nitrate source were found to be significantly higher than that in the other sources (<0.05). The temperature and nitrogen source, thus, has a significant influence on the growth rate, Chl-, and carotenoid content of. Overall, the TAN uptake rate was the highest, followed by the nitrite and nitrate uptake rates. However, the inorganic nitrogen uptake rate decreased as the temperature increased.
; Temperature; Nitrogen source; Growth
S917.3
A
2095-9869(2019)06-0138-07
10.19663/j.issn2095-9869.20180718003
http://www.yykxjz.cn/
葛红星, 陈钊, 李健, 常志强, 赵法箴. 温度对浒苔生长及不同氮源吸收特性的影响. 渔业科学进展, 2019, 40(6): 138–144
Ge HX, Chen Z, Li J, Chang ZQ, Zhao FZ. Effects of temperature on the growth rate and nitrogen uptake of. Progress in Fishery Sciences, 2019, 40(6): 138–144
* 国家虾产业技术体系–北方养殖岗位(CARS-48)、山东省泰山产业领军人才工程项目(LNJY2015002)和江苏省海洋生物技术重点实验室开放课题(HS2017002)共同资助[This work was supported by China Agriculture Research System (CARS- 48), the Program of Shandong Leading Talent (LNJY2015002), and Open Funds of Jiangsu Key Laboratory of Marine Biotechnology (HS2017002)]. 葛红星,E-mail: hongxinggeliu@163.com
李 健,研究员,E-mail: lijian@ysfri.ac.cn
2018-07-18,
2018-08-27
LI Jian, E-mail: lijian@ysfri.ac.cn
(编辑 陈 严)

