P38、MAPK-1和AQP-4在糖皮质激素调节大鼠创伤性脑水肿中的作用
方俊 姜永亮 黄波
摘要:目的 探討糖皮质激素对P38、丝裂原活化蛋白激酶(MAPK-1)的调节作用及其对大鼠创伤后脑组织水通道蛋白 4(AQP-4)表达的影响。方法 选择SPF级雄性SD大鼠140只,随机分为假手术组、模型组、低剂量治疗和高剂量治疗组,各35只。假手术组单纯实施开颅手术,模型组、低剂量治疗组和高剂量治疗组用Feeney's自由落体法制备大鼠脑创伤模型,高剂量治疗组和低剂量治疗组分别予高、低甲泼尼龙尾静脉注射。分别于伤后0、6、24、72 h、7 d处死动物,取脑组织标本,透射电镜观察各组大鼠神经细胞结构变化,免疫组化法测定各组大鼠AQP-4、P38、MAPK-1的表达水平,用荧光探针原位杂交法测定AQP-4mRNA的表达。结果 ①假手术组大鼠脑神经结构基本正常,细胞质、细胞膜及细胞核完整清晰。模型组神经细胞体积缩小,细胞膜结构破坏,胞浆疏松,细胞核固缩,凋亡小体形成。与模型组相比,低剂量治疗组、高剂量治疗组大鼠神经细胞坏死程度均较轻。②低剂量治疗组及高剂量治疗组大鼠伤后24、72 h及7 d的AQP-4阳性表达率均低于模型组,差异有统计学意义(P<0.05),低剂量与高剂量治疗组间表达比较,差异无统计学意义(P>0.05)。低剂量治疗组及高剂量治疗组大鼠在伤后24、72 h及7 d的P38、MAPK-1阳性表达率均低于模型组,差异有统计学意义(P<0.05),低剂量与高剂量治疗组间比较,差异无统计学意义(P>0.05)。③低剂量治疗组和高剂量治疗组的AQP-4mRNA阳性表达率在伤后24、72 h及7 d均低于模型组,高于假手术组,差异有统计学意义(P<0.05);低剂量与高剂量治疗组间比较,差异无统计学意义(P>0.05)。结论 糖皮质激素可以降低大鼠创伤后脑组织AQP-4 的表达及脑损伤,其作用机制可能与抑制P38、MAKP-1激活、降低下游 AQP-4 的表达有关。
关键词:颅脑创伤;脑水肿;水通道蛋白 4;P38;MAPK-1;糖皮质激素
中图分类号:R743.3 文献标识码:A DOI:10.3969/j.issn.1006-1959.2019.21.019
文章编号:1006-1959(2019)21-0056-05
Abstract:Objective To investigate the effects of glucocorticoids on P38 and mitogen-activated protein kinase (MAPK-1) and their effects on the expression of aquaporin-4 (AQP-4) in rat brain after trauma. Methods A total of 140 SPF male Sprague-Dawley rats were randomly divided into sham operation group, model group, low-dose treatment and high-dose treatment group, 35 each. The sham operation group was only performed with craniotomy. The model group, the low-dose treatment group and the high-dose treatment group were prepared by Feeney's free fall method. The high-dose treatment group and the low-dose treatment group were given high and low methylprednisolone. Injection into the tail vein. The animals were sacrificed at 0, 6, 24, 72 h and 7 d after injury, and brain tissue samples were taken.The changes of nerve cell structure in each group were observed by transmission electron microscopy. The expression levels of AQP-4, P38 and MAPK-1 in each group were determined by immunohistochemistry. The expression of AQP4 mRNA was determined by fluorescence probe in situ hybridization. Results ①In the sham operation group, the brain structure of the brain was basically normal, and the cytoplasm, cell membrane and nucleus were intact. In the model group, the volume of nerve cells was reduced, the cell membrane structure was destroyed, the cytoplasm was loose, the nucleus was pyknosis, and apoptotic bodies were formed. Compared with the model group, the degree of neuronal necrosis was lower in the low-dose treatment group and the high-dose treatment group. ②The positive expression rate of AQP-4 in the low-dose treatment group and the high-dose treatment group was lower than that in the model group at 24, 72 h and 7 d after injury,the difference was statistically significant (P<0.05). There was no significant difference in the expression between the low-dose and high-dose groups (P>0.05). The positive expression rates of P38 and MAPK-1 in the low-dose treatment group and the high-dose treatment group were lower than those in the model group at 24, 72 h and 7 d after injury,the difference was statistically significant (P<0.05). There was no significant difference between the low-dose and high-dose groups (P>0.05). ③The positive expression rate of AQP4 mRNA in low-dose treatment group and high-dose treatment group was lower than that in model group at 24, 72 h and 7 d after injury, which was significantly higher than that in sham operation group (P<0.05).There was no significant difference between the low-dose and high-dose groups (P>0.05). Conclusion Glucocorticoid can decrease the expression of AQP-4 and brain damage in rat brain after trauma, and its mechanism may be related to inhibition of P38, MAKP-1 activation and reduction of downstream AQP-4 expression.
Key words:Traumatic brain injury;Brain edema;Aquaporin 4;P38;MAPK-1;Glucocorticoid
创伤后脑水肿(cerebral edema)是颅脑损伤的重要病理生理过程,其发生由炎症因子、神经血管活性物质、血脑屏障结构改变等众多因素参与。尽管近年来临床进行了大量的研究,但患者病死率、致残率仍未显著降低[1]。糖皮质激素(glucocorticoid,GC)是临床广泛用于治疗各种炎性疾病和抗应激的药物,其抗炎作用主要通过与糖皮质激素受体(glucocorticoid receptor,GR)结合来实现。GR主要存在于细胞浆中,与GC结合后,能快速进入到细核内,通过多种通路发挥抗炎作用。其主要作用机制包括直接的转录过程调节,干扰其它转录因子的作用等[2]。已有研究发现,GR可通过抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路来实现其抗炎作用。MAPK家族主要包括 ERK(extracelluar signal-regulated kinase)、JNK(c-Jun N-terminal kinase)和P38MAPK,它们都参与了机体炎症反应的发生与发展过程。其中P38MAPK是各类炎症反应的重要激酶,参与炎症反应的发展与调节。研究证实,P38MAPK参与脑水肿的发生和发展,研究 GC与P38MAPK在创伤后脑水肿中的作用,有助于了解创伤后脑水肿的发生发展规律,以及评估GC在脑水肿治疗中的作用[3]。本研究主要探讨糖皮质激素对大鼠创伤后脑组织P38、MAPK-1的调节作用及其对脑组织水通道蛋白 4(AQP-4)表达的影响。
1材料与方法
1.1实验动物 2016年2月~2018年3月选择SPF級雄性SD大鼠140只,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2007-00058,体重200~250 g。按照随机数字表法分为假手术组、模型组、低剂量治疗组、高剂量治疗组,各35只。本研究已通过我院实验动物伦理委员会审批,实验过程符合实验动物伦理要求。
1.2试剂 二甲苯、苏木精染液、1%伊红酒精溶液、中性树胶(国药集团),抗 P38MAPK抗体(sc-7972)、抗P-P38MAPK(sc-7973)、抗MKP-1抗体(sc-1199)、抗AQP4抗体(Santa Cruz 公司),二抗(钰森生物)。
1.3模型制备 假手术组仅行开颅手术,模型组、低剂量治疗组、高剂量治疗组参考 Feeney's自由落体模型制作重度创伤性脑损伤模型,致伤力约为1000 g/cm2,致伤面积约6~8 mm2,下陷深度约 2 mm,造成右侧顶叶重度脑损伤;高剂量治疗组 使用甲泼尼龙20 mg/kg,于伤后即刻首剂尾静脉注入,之后每24 h注射1次,连续3次。低剂量治疗组使用甲泼尼龙2 mg/(kg·d),1日剂量分3次注射, 1次/8 h,于伤后即刻首剂尾静脉注入。
1.4动物模型评分标准 大鼠苏醒后立即按Zausinger法进行神经功能障碍评分:0分:大鼠不能自发行走;1分:大鼠自发活动时向损伤对侧进行旋转;2分:提起大鼠尾巴,大鼠向损伤对策进行旋转;3分:对抗病变部位阻力减低;4分:病变另一侧的前爪不能伸直;5分:无任何神经功能障碍;评分采用单盲法以减少误差。选择评分≤4分者,取出的脑组织检查,确定有很明显的脑损伤,视为造模成功。
1.5组织切片制备 达到预定时间(伤后0、6、24、72 h、7 d),各组分别取7只大鼠,麻醉大鼠,先后用4℃,0.9%氯化钠注射液100 ml、4%多聚甲醛150 ml心脏灌洗,取脑,-80℃冰箱备用及固定、石蜡包埋。
1.6透射电镜观察神经细胞结构 2.5%戊二醛,磷酸缓冲液配制固定2 h。用0.1 M磷酸漂洗液漂洗,1%锇酸固定液固定3 h,0.1 M磷酸漂洗液漂洗3次。4℃,50%乙醇、70%乙醇、90%乙醇、 90%丙酮(1∶1)、90%丙酮、100%丙酮分次脱水。纯丙酮+包埋液(2∶1)室温 4 h,纯丙酮+包埋液(1∶2)室温过夜,纯包埋液37℃3 h。37℃烘箱内过夜,45℃烘箱内12 h,60℃烘箱内24 h固化。超薄切片机切片 50~60 nm。3%醋酸铀-枸橼酸铅双染色。透射电镜观察,拍片。
1.7免疫组化检测AQP-4、P38、MAPK-1表达水平 取 4 μm 石蜡切片,常规脱蜡、水化处理后。立即投入3%H2O2甲醇(30%H2O2,1 ml,4 ℃避光+甲醇 9 ml,现配现用)浸泡10 min。水洗3 min×2次,除去内源性的过氧化氢酶。抗原修复:①高压锅修复:立即投入柠檬酸缓冲液,等到沸腾,浮子升起,计时 2 min,自然冷却至室温。②血清修复:PBS 5 min/次,洗2次,擦干外围,免疫组化笔勾圈,风干15 s。滴加5%BSA封闭液,然后放入37℃温箱30 min,甩去多余液体。加一抗,1∶100稀释,湿盒中于4℃冰箱中保存过夜。加二抗,恢复到室温后,PBS洗3次,5 min/次,湿盒中置于37℃温箱中0.5 h。加DAB-H2O2显色,显微镜下控制显色反应,苏木素复染,中性树胶封片。以细胞胞浆内棕褐色颗粒为阳性,扫描结果用图像分析软件(IMAGE J)处理,分析阳性表达率。
1.8荧光探针原位杂交检测AQP-4mRNA表达 4%多聚甲醛固定组织,蔗糖脱水,OCT包埋切片。0.1 mol枸橼酸缓冲液浸泡冰冻切片10 min,使组织细胞恢复水性。基因笔画圈,滴加蛋白酶K(20 μg/ml)消化8 min。纯水冲洗后PBS洗3次,5 min/次。预杂交,滴加预杂交液37℃恒温箱1 h。杂交,倾去预杂交液,滴加杂交液(含探针AQP-4 probe浓度 8 ng/μl),37℃杂交过夜。杂交后洗涤,洗去杂交液,2×SSC,37℃洗10 min,1×SSC,37℃洗2次,5 min/次,0.5×SSC 37℃洗10 min。镜检拍照,切片于尼康正置荧光显微镜下观察并采集图像。紫外激发波长330~380 nm,发射波长420 nm,发蓝光;FAM(488)绿光激发波长465~495 nm,发射波长515~555 nm,发绿光;CY3红光激发波长510~560 nm,发射波长590 nm,发红光。阳性表达为相应荧光素标记的荧光。
1.9统计学处理 所有数据均由SPSS13.0统计软件处理,数据以(x±s)表示,行t检验,统计分析釆用单因素方差分析。P<0.05表示差异有统计学意义。
2结果
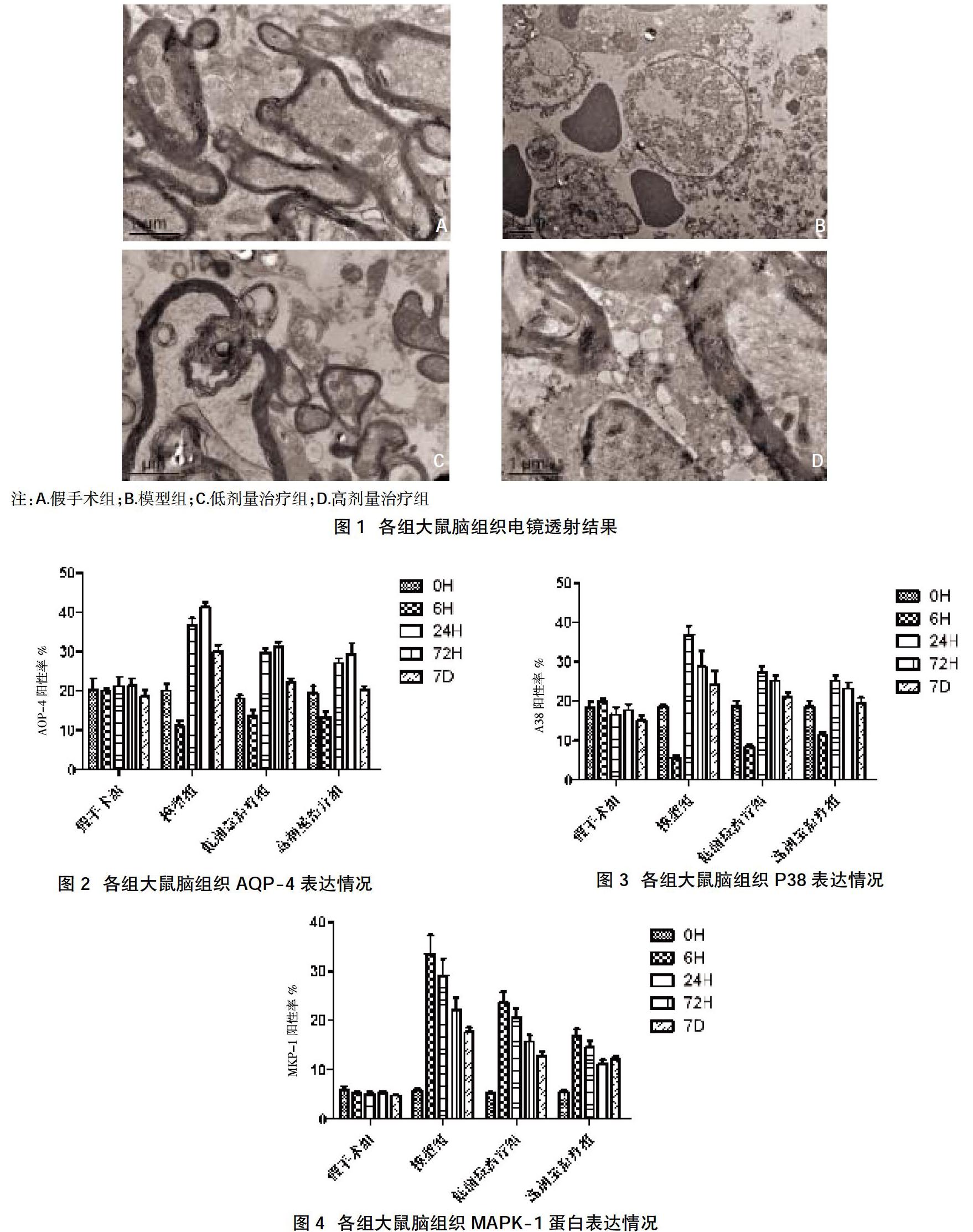
2.1各组大鼠脑组织透射电镜结果 假手术组大鼠脑神经结构基本正常,细胞质、细胞膜及细胞核完整清晰。模型组神经细胞体积缩小,细胞膜结构破坏,胞浆疏松,细胞核固缩,凋亡小体形成。与模型组相比,低剂量治疗组、高剂量治疗组大鼠神经细胞坏死程度均较轻。各组大鼠脑组织电镜照片见图1。
2.2各组大鼠脑组织AQP-4、P38与MAPK-1蛋白表达情况 大鼠脑组织AQP-4表达在伤后6 h降低,24 h开始增高,伤后72 h达到最高值,伤后7 d恢复正常水平;低剂量治疗组及高剂量治疗组大鼠伤后24 h、72 h、7 d的AQP-4阳性表达率均低于模型组,差异有统计学意义(P<0.05),低剂量与高剂量治疗组间表达比较,差异无统计学意义(P>0.05),见图2。大鼠脑组织P38、MAPK-1表达在伤后6 h开始增高,伤后72 h达到最高值,伤后7 d恢复正常水平。低剂量治疗组及高剂量治疗组大鼠在伤后24 h、72 h、7 d的P38、MAPK-1阳性表达率均低于模型组,差异有统计学意义(P<0.05);低剂量与高剂量治疗组间比较,差异无统计学意义(P>0.05),见图3、图4。
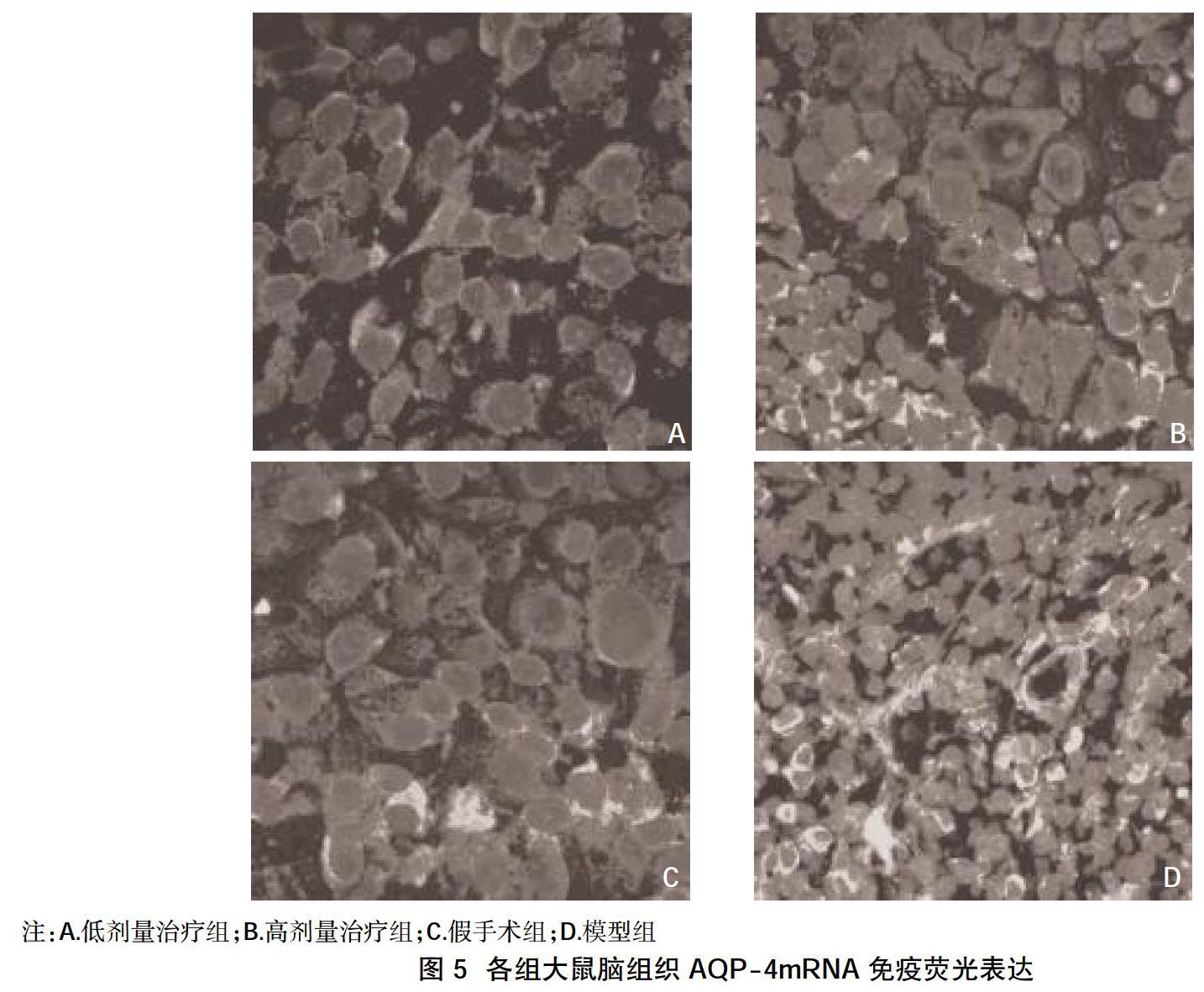
2.3大鼠脑组织AQP-4mRNA表达结果 从荧光强弱判断大鼠脑组织AQP-4mRNA的表达,其在伤后24 h开始增高,伤后72 h达到最高值,伤后7 d恢复正常水平。低剂量治疗组和高剂量治疗组的AQP-4mRNA阳性表达率在伤后24 h、72 h、7 d均低于模型组,高于假手术组,差异有统计学意义(P<0.05);低剂量与高剂量治疗组间比较,差异无统计学意义(P>0.05),見图5。
3讨论
P38、MAPK 是人体内广泛分布的信号通路蛋白,可被炎症反应、应激氧化与缺血缺氧等多种因素激活,在颅脑损伤后的病理生理信号传导中起着重要作用。AQP-4是目前已发现的存在于动物中枢神经系统的主要水通道蛋白,对脑组织的水平衡调节起着主要作用[4]。AQP-4的表达受蛋白磷酸化,蛋白间相互作用,缺氧等因素的影响[5,6]。本研究发现,与假手术组相比,模型组大鼠损伤脑组织 P38、MAPK-1、AQP-4 及 AQP-4mRNA 的表达增高且伴神经细胞破坏的增加,提示颅脑损伤后 P38-MAKP信号通路被激活,致使 AQP-4 高表达,进而促进脑水肿,加重神经损伤。P38 的激活对创伤后脑水肿有着重要作用,抑制 P38 的激活可有效减轻脑水肿。
本研究发现,与模型组相比,治疗组大鼠损伤区域脑组织 P38、MAPK-1、AQP-4 及 AQP-4 mRNA的表达降低且伴神经细胞破坏减轻,提示糖皮质激素可以抑制 P38、MAPK-1的激活,导致AQP-4 的表达下调,减轻脑水肿,降低脑损伤。但是抑制P38、MAPK-1,并不能完全下调AQP-4的表达,提示AQP-4可能是创伤后脑水肿发生的重要的或最终的靶效应蛋白。损伤直接引起的细胞及膜结构的改变,受破坏细胞内成分异常流动,缺血缺氧再灌注损伤,有害神经递质的释放等多种原因均可以通过多种途径引起AQP-4蛋白表达的改变,进而影响脑组织神经细胞内外水分子的流动分布[7]。
研究发现,糖皮质激素除了经典的基因组效应外还存在快速化非基因组效应,这一效应可以发生在中枢神经。这一快速化非基因组效应是GC直接透过血脑屏障与神经细胞GR结合,通过对细胞内信号系统的调节影响蛋白的转录表达。研究还发现GR在损伤脑组织中的表达水平降低,存在一定时相规律。在细胞水平,研究发现GC-GR结合后对MAPK系统的表现在:①直接或间接上调P38的表达;②抑制ERK的表达;③对JNK的作用具有细胞特异性。此外GC-GR还诱导上调MKP-1的活性和表达,对磷酸化的活性MAPK去磷酸化,进而灭活MAPK(主要是P38和JNK)。在急性肺水肿、缺血性脑水肿及一些肿瘤中,均证实了糖皮质激素的这种抑制作用,并通过这种抑制作用下调AQP的表达[8]。本研究证实了糖皮质激素作用的时间变化规律,并且还发现低剂量组与高剂量组比较,AQP-4、P38、MAKP表达结果没有明显差异。提示糖皮质激素对P38、MAPK-1的调节作用可能是通过与其位于神经细胞内的受体(GR)结合后发挥的,因此没有明显的量效关系,也解释了部分临床上糖皮质激素冲击治疗重型颅脑损伤效果不明显的原因。
综上所述,糖皮质激素可以降低大鼠创伤后脑组织AQP-4 的表达及脑损伤,其作用机制可能与抑制 P38、MAKP-1 激活、降低下游 AQP-4 的表达有关。然而,糖皮质激素对脑创伤后P38、MAPK-1及AQP-4表达的调节作用不具有量效关系,其对脑损伤的治疗作用有待进一步研究。
参考文献:
[1]Liu YL,Xu ZM,Yang GY,et al.Sesamin alleviates blood-brain barrier disruption in mice with experimental traumatic brain injury[J].ActaPharmacol Sin,2017,38(11):1445-1455.
[2]Zhang C,Lyu Z,Wang Y,et al.Mild hypothermia regulates aquaporin 4 expression in brain tissue of rats with cardiopulmonary resuscitation and reduces brain edema through p38 mitogen-activated protein kinase signaling pathway[J].Chinese Critical Care Medicine,2019,31(4):480-483.
[3]Zhang Y,Deng H,Hu Y,et al.Adipose-derived mesenchymal stem cells stereotactic transplantation alleviate brain edema from intracerebral hemorrhage[J].J Cell Biochem,2019,120(9):14372-14382.
[4]Wang B,Li W,Jin H,et al.Curcumin attenuates chronic intermittent hypoxia-induced brain injuries by inhibiting AQP4 and p38 MAPK pathway[J].Respir Physiol Neurobiol,2018(255):50-57.
[5]Chen Y,Gao F,Jiang R,et al.Down-Regulation of AQP4 Expression via p38 MAPK Signaling in Temozolomide-Induced Glioma Cells Growth Inhibition and Invasion Impairment[J].J Cell Biochem,2017,118(12):4905-4913.
[6]Chu H,Ding H,Tang Y,et al.Erythropoietin protects against hemorrhagic blood-brain barrier disruption through the effects of aquaporin-4[J].Lab Invest,2014,94(9):1042-1053.
[7]Xiong LL,Tan Y,Ma HY,et al.Administration of SB239063, a potent p38 MAPK inhibitor, alleviates acute lung injury induced by intestinal ischemia reperfusion in rats associated with AQP4 downregulation[J].IntImmunopharmacol,2016(38):54-60.
[8]Guo ST,Li Z,Jiang LB,et al.Effects of intravenous methylprednisolone pulse therapy on optic neuritis associated with AQP4 antibody seropositive neuromyelitisoptica[J].Chinese Journal of Ophthalmology,2019,55(3):180-185.
收稿日期:2019-9-11;修回日期:2019-9-23
編辑/成森

