常温下钠在空气中反应的实验探究
陈云


摘要: 依据常温下钠与氧气反应的原理,运用自制三口瓶改进传统实验,利用O2传感器、CO2传感器和相对湿度传感器进行实验探究。发现钠与空气中的O2、 CO2、水蒸气等物质发生反应最终生成碳酸钠,且同时可能发生多个反应。初始相对湿度越大,钠与空气中O2、 CO2、水蒸气反应速率也越快。
关键词: 钠在空气中反应; O2传感器; CO2传感器; 相对湿度传感器; 实验探究
文章编号: 1005-6629(2019)11-0057-04 中图分类号: G633.8 文献标识码: B
1 问题的提出
钠与氧气反应是苏教版高中化学必修教材《化学1》专题2第二单元第一节“金属钠的性质与应用”中的内容,教材中有这样一个实验设计环节: 取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色;将其放置在空气中,观察表面颜色的变化。从实验现象看,刚切开金属钠时,表面呈现金属光泽,然后变暗,再放置一段时间表面呈白色。一般教师的解释是由于钠被空气中的氧气氧化为氧化钠,还会继续与二氧化碳、水蒸气反应最终生成碳酸钠。这种解释虽然基本没什么问题,但是氧化钠是白色固体,而用钠的表面发暗的现象来说明钠被氧气氧化为氧化钠有些牵强[1],另外钠与氧气反应和与空气反应还是有一定区别的[2, 3]。
本实验设计透过自制玻璃仪器观察物质变化的宏观现象,借助电子传感器捕捉化学反应过程中的细微变化,对钠在空气中的反应进行实验改进和知识补充,进而帮助学生正确认识化学反应、物质及其变化的基本规律和方法,这也是新课程标准的重要内容之一。
2 实验探究分析钠在常温下的反应
2.1 实验原理
在室温下,钠能够迅速地与空气中的氧气反应,还很容易吸收空气中的二氧化碳;钠还会与空气中的水蒸气反应或被氧气氧化后又会与水反应生成氢氧化钠,氢氧化钠与空气中二氧化碳反应。一般认为,钠暴露于空气中,长期久置后最终产物就是碳酸钠。过程中主要涉及的反应如下:
4Na+O22Na2O①
Na2O+H2O2NaOH②
2Na+2H2O2NaOH+H2↑③
2NaOH+CO2Na2CO3+H2O④
2.2 实验药品与仪器
实验仪器: 自制三口瓶、Logger Pro 3(软件)、数据采集器、O2传感器、CO2传感器、相对湿度传感器、镊子、小刀、玻璃片、滤纸、铁架台、铁夹
实验药品: 金属钠、煤油、浓硫酸
本实验采用威尼尔公司的数字采集器、数据采集软件、O2传感器、CO2传感器以及相对湿度传感器
2.3 实验装置及操作要點
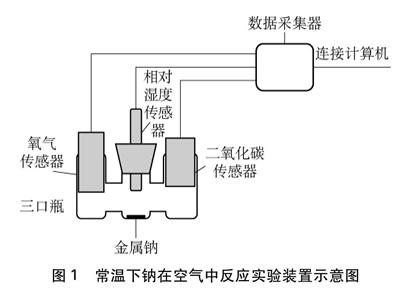
实验装置中,自制三口瓶的三个口分别插入O2传感器、相对湿度传感器和CO2传感器,三个口分别对应三个凹槽,金属钠放在中间凹槽内。若要改变密闭容器内的相对湿度,可先向三口瓶的左右两个凹槽内滴加浓硫酸,待相对湿度稳定后再进行实验。实验装置如图1所示。
图1 常温下钠在空气中反应实验装置示意图
实验操作时主要注意以下几点:
(1) 金属钠尽量切成薄片状,两面皆为新切切面,且大小相等,表面积约为1.5cm×0.5cm,便于透过玻璃观察钠表面的现象,也为对比实验探究提供真实有用的数据。
(2) 切好金属钠后立即放入三口烧瓶的中间凹槽内,迅速盖上橡皮塞,再进行数据采集。
(3) 干燥剂浓硫酸不能与金属钠接触。
2.4 实验过程
2.4.1 实验探究1: 空气中相对湿度对O2浓度和CO2浓度数据采集的影响
用USB数据线将计算机与数字采集器连接起来,将O2传感器、相对湿度传感器和CO2传感器连接到数据采集器上,三口瓶固定在铁架台上,按照图1搭好装置。在三口瓶两端凹槽内分别滴加少量浓硫酸,点击数据采集,观察曲线变化情况。
数据图像纵轴选择O2浓度(%)、CO2浓度(ppm)和相对湿度(%),横轴选择时间(s),开启仪器采集数据,观察O2浓度、CO2浓度和相对湿度随时间变化情况。实验结果如图2、图3和图4所示。
图2 密闭容器内O2浓度和相对湿度随时间变化的曲线1
图3 密闭容器内CO2浓度和相对湿度随时间变化的曲线1
图4 密闭容器内O2浓度和CO2浓度随相对湿度变化的曲线1
2.4.2 实验探究2: 探究金属钠在空气中反应的原理
(1) 用镊子夹取一小块钠,用滤纸把表面的煤油吸干,将钠放在玻璃片上,用小刀切下薄片状,观察钠表面的现象。
(2) 重复以上操作,迅速将片状金属钠放入如图1所示的三口瓶中间凹槽内。点击数据采集,观察钠表面的现象以及数据曲线的变化。实验结束,用镊子取出钠并放回原试剂瓶。实验结果如图5和图6所示。
图5 密闭容器内O2浓度和相对湿度随时间变化的曲线2
图6 密闭容器内CO2浓度和相对湿度随时间变化的曲线2
2.4.3 实验探究3: 探究空气相对湿度对金属钠在空气中反应消耗O2和CO2速率的影响
向三口瓶的左右两个凹槽内分别滴加浓硫酸,待相对湿度数值稳定后,再重复实验探究2实验操作(2)。初始相对湿度控制在30%以下,设置不同的初始相对湿度进行比较。实验结果如图7、图8和图9所示。
图7 密闭容器内相对湿度随时间变化的曲线
图8 密闭容器内CO2浓度随时间变化的曲线
图9 密闭容器内O2浓度随时间变化的曲线
2.5 结果与讨论
2.5.1 实验探究1
CO2传感器是基于气体的红外吸收光谱随物质的不同而存在差异的原理制成的。不同气体分子化学结构不同,对不同波长的红外辐射的吸收程度不同。由于空气中存在多种气体,其中水蒸气对CO2气体的红外吸收有一定的影响。若要探究钠在空气中的反应,则需要排除由于传感器自身原因造成的干扰。
由图2曲线说明加入干燥剂浓硫酸后,随时间变化,密闭容器内相对湿度逐渐降低,O2浓度基本不变;由图3曲线说明CO2浓度随着相对湿度的降低逐渐上升,CO2浓度上升约50ppm(原因有待进一步探究),且相对湿度降低到约为30%之后,CO2浓度基本保持不变;由图4曲线说明空气中相对湿度的变化对O2浓度的测定几乎无影响,对CO2浓度的测定影响较小,在相对湿度低于30%时,CO2浓度基本保持不变。
因此在实验探究2和实验探究3中,涉及CO2浓度测定的实验,设置密闭容器内初始相对湿度低于30%,为数据的真实有效提供了依据。
2.5.2 实验探究2
实验探究2中实验(1)可以观察到刚切开金属钠后,表面呈现银白色的金属光泽,然后迅速变暗,再放置一段时间表面变白,空气相对湿度较大时,可以观察到表面有气泡。说明钠与空气中的一些物质发生了反应,钠与空气中的水蒸气反应生成氢气。
实验探究2中实验(2)结果如图5和图6所示,由曲线说明随着反应的进行,密闭容器内O2浓度、CO2浓度和相对湿度随时间的推移逐渐降低。说明钠与空气中的O2、 CO2和H2O发生了反应。从反应开始时O2浓度、CO2浓度和相对湿度就逐渐降低,说明同时可能发生多个反应。
2.5.3 实验探究3
由图7曲线说明随着反应的进行,密闭容器中相对湿度逐渐降低。曲线①看出相对湿度由29.64%降低到20.43%, 2000s内降低9.21%;曲线②看出相对湿度由25.58%降低到17.36%, 2000s内降低8.22%;曲线③看出相对湿度由20.81%降低到16.11%, 2000s内降低4.7%。由以上数据说明初始相对湿度越大,空气中的水蒸气消耗速率就越快。
由图8曲线说明随着反应的进行,密闭容器中CO2浓度逐渐降低。曲线①看出CO2浓度在1000s时降到最低,且CO2浓度由336ppm降低到25ppm, CO2消耗速率为0.311ppm/s;曲线②看出CO2浓度在1050s时降到最低,且CO2浓度由302ppm降低到25ppm, CO2消耗速率为0.264ppm/s;曲线③看出CO2浓度在
1300s时降到最低,且CO2浓度由336ppm降低到25ppm, CO2消耗速率为0.239ppm/s。由以上数据表明初始相对湿度越大,空气中的CO2消耗速率就越快。
由图9曲线说明随着反应的进行,密闭容器中O2浓度逐渐降低。曲线①看出O2浓度由20.91%降低到20.57%, 2000s内降低0.34%;曲线②看出O2浓度由20.60%降低到20.41%, 2000s内降低0.19%;曲线③看出O2浓度由20.94%降低到20.80%, 2000s内降低0.14%。由以上数据表明初始相对湿度越大,空气中的O2消耗速率就越快。
2.6 结论
(1) 常温下,金属钠在空气中涉及的反应较为复杂。由以上实验可以得出,钠与空气中CO2、 O2、水蒸气等物质发生反应,且同时可能发生多个反应。
(2) 初始相对湿度越大,钠与空气中CO2、 O2、水蒸气反应速率就越快。
3 反思与启示
常温下钠在空气中的反应是物质转化的一个重要知识点,但是教学过程中现象的描述并不能有效地证明微观的变化。如何将反应的微观变化尽可能通过技术手段呈现出来,并能服务于日常的课堂教学已成为本实验设计的主要思想。
本实验中自制三口瓶的设计,主要是由于常规实验仪器无法与O2传感器、CO2传感器匹配使用。三口瓶瓶口设计与传感器匹配使用,形状简单、方便组装、便于携带。该实验设计运用于课堂教学,金属钠消耗少,微量化的实验设计,节约了试剂,但获得的信息量却很丰富。利用O2传感器、CO2传感器和相对湿度传感器同时进行实验探究,从图像曲线的变化可直观地看到常温下金属钠在空气中的多个反应,解决了常规实验现象无法解释的问题,为理论推理提供了真实有效的实验证据。
实验过程中发现有以下问题需要进一步反思与改进的:
(1) 如何设计实验更好地在短时间内观察钠表面的变化过程?
常温下金属钠在空气中反应,其表面现象发生变化比较缓慢,要想在课堂上短时间内观察到相关现象比较困难。一般能观察到金属钠表面变暗,接下来的现象就需要等待一段时间才行。相关影响因素中较容易改变的是金属钠的厚薄,但如何将钠在短时间内压成极薄的片状也是一个难题。是否还可以从其他途径着手呢?再者,如何设计“利用传感器实验探究氧气浓度、二氧化碳浓度、相对湿度、钠的表面积等因素对反应速率的影响”也是可深入探讨的一个问题。
(2) 如何利用三口瓶进一步设计实验?
三口瓶的设计新颖且简单,可以用于多种物质的化学反应原理探究,如本实验设计钠在空气中的反应,也可以设计实验探究氢氧化钠与CO2的反应、氢氧化钠的潮解等。如何有效利用自制三口瓶進行多样化的实验设计,并服务于课堂教学?
后续还有很多相关工作要做,需要我们不断去探索。
参考文献:
[1]扬金华. 常温下钠与空气中氧气反应生成氧化钠[J]. 化学教学, 1996, (11): 47~48.
[2]刘国庆. 钠与氧气反应实验的改进[J]. 实验教学与仪器, 2013, (4): 24~25.
[3]徐小健. 金属钠性质探究实验的创新改进[J]. 化学教学, 2017, (2): 66~67.

