基于16S rDNA测序技术探索白头翁汤灌肠对湿热型溃疡性结肠炎大鼠肠道菌群的影响
鲍炳州,朱 超,吴生兵,2,3,卢灿省,石 健,武 岳,李晓博,叶九林
(1.安徽中医药大学,安徽 合肥 230012;2.安徽省中医药科学院针灸经络研究所,安徽 合肥 230038;3.安徽中医药大学 新安医学教育部重点实验室,安徽 合肥 230038;4.安徽中医药大学第一附属医院,安徽 合肥 230031)
溃疡性结肠炎(ulcerative colitis,UC)是一种病因尚不明确的慢性肠道炎症性疾病,其临床表现为反复发作的血便、腹泻、腹痛并伴体质量下降。UC属于中医学“肠风”“大瘕泄”“肠癖”“滞下”等范畴,其基本病机为本虚标实,虚乃脾肾亏虚,实乃湿、热、瘀、毒壅滞大肠。白头翁汤始载于《伤寒论》,具有清热燥湿、凉血解毒之功,常作为主治热痢之方。现代药理研究发现,白头翁汤具有抗炎、抗过敏、抗菌作用。黄连、黄柏都含有小檗碱,二者提取物具有抗腹泻、抗炎以及抗溃疡作用,可调节机体免疫。秦皮具有抗炎作用[1],其治疗UC临床疗效明显[2]。为了探究UC的发病是否与肠道的菌群失调有关,白头翁汤治疗UC是否通过改变肠道菌群来进行调节,笔者开展了相关实验,现将实验研究结果汇报如下。
1 材料
1.1 动物 健康SPF级2个月龄SD雄性大鼠62只,体质量(200±20)g,购自安徽医科大学动物饲养中心[动物生产许可证号为SCXK(皖)2017-001],分笼饲养于安徽中医药大学第一附属医院动物饲养中心,饲养温度为(24±2)℃,相对湿度为50%~70%。
1.2 试药 白头翁汤按李冀主编的《方剂学》[3]中确定的药物组成和剂量(白头翁15 g,黄柏、黄连、秦皮各9 g),药物总量为42 g。所有的药材购于安徽中医药大学第一附属医院中药房,经水煮2次,混合过滤后,浓缩制备成4.31、8.62、17.24 g/mL的药液,经灭菌后置于4 ℃冰箱备用。美沙拉嗪缓释颗粒(国药准字 H20100062,批号 190404):上海爱的发制药有限公司。2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid solution, TNBS)(批号 SLBX3263):美国Sigma公司;QIAamp粪便DNA提取盒(批号 51604):上海浩然生物技术有限公司;无水乙醇。
1.3 仪器 脱水机:武汉俊杰电子有限公司;包埋机:广州兆康生物科技有限公司;病理切片机:深圳汇沃科技有限公司;CK2型倒置显微镜:日本Olympus公司;电子天平BS230S:sartorius公司;凝胶成像系统:Tanon公司。
2 方法
2.1 模型制备和分组 按照文献[4]的方法,先建立湿热型大鼠模型:在普通饲料喂养的基础上,自由饮用浓度为200 g/L的蜂蜜水,每日上午灌服猪油10 g/kg,30 min后灌服56度白酒10 mL/kg,共持续10 d,以造成内因湿热型模型。湿热型模型建立完毕后,按照随机数字表法将62只SPF级雄性大鼠分为正常组,模型组,白头翁汤高、中、低剂量组和美沙拉嗪组,其中正常组12只,其余各组10只。除正常组以外,其余各组均采用TNBS/乙醇法[5]复制UC模型。禁食、不禁水24 h,模型复制前用棉签擦拭肛门,促使大便排出,再用异氟烷气体麻醉后,采取头低脚高位约45°角,将直径约2 mm的聚乙烯管用石蜡油润滑后,自肛门缓慢插入直肠约8 cm,灌入TNBS原液100 mg/kg+50%乙醇0.25 mL,将大鼠倒置60 s,放回笼中,清醒后自由饮食,及时观察大鼠情况。UC模型复制后第3天,正常组、模型组各随机抽取2只大鼠剪取结肠组织病理切片后进行模型评价,确定模型复制是否成功。
2.2 药物治疗 按照标准动物的体表面积等效剂量折算系数法[6]确定大鼠给药剂量,成人和大鼠的换算系数为6.17,白头翁汤成人每日剂量是42 g/kg,换算成大鼠剂量为每日4.31 g/kg,设置大鼠白头翁汤低、中、高剂量组分别为每日2.15、4.31、8.62 g/kg,美沙拉嗪组为每日0.35 g/kg,按白头翁汤中剂量组等效剂量给药。
在UC模型复制成功后第2天对各组大鼠进行灌肠治疗,白头翁汤低、中、高剂量组每日分别给予2.15、4.31、8.62 g/kg白头翁汤药液灌肠,美沙拉嗪组每日给予0.35 g/kg美沙拉嗪灌肠液灌肠,正常组、模型组大鼠均使用生理盐水灌肠,每日1次,每次灌肠容积均为0.5 mL,连续灌肠治疗14 d。
2.3 标本收集及指标观察
2.3.1 各组大鼠一般状态观察及疾病活动指数(disease activity index,DAI)评分 治疗14 d后,观察并记录大鼠体质量、大便性状及大便隐血情况并计算DAI评分[7],包括体质量下降、大便性状和血便3项。①体质量无下降,计0分;下降1%~5%,计1分;下降5%~10%,计2分;下降10%~15%,计3分;下降15%以上,计4分。②大便性状:正常,计0分;大便松散,计2分;稀便,计4分。③血便:无血便,计0分;大便隐血阳性,计2分;肉眼血便,计4分。
2.3.2 各组大鼠病理状态观察 异氟烷气体麻醉后,无菌操作,经腹正中线剖腹,于肛门上端8 cm处,剪取病变结肠组织约2 cm,4 ℃生理盐水清洗,浸入4%多聚甲醛中固定24 h,自动脱水机脱水,石蜡包埋,切片,选取相邻的切片分别用于常规苏木精-伊红(hematoxylin-essence,HE)染色,中性树胶封片,光镜观察。
2.3.3 大鼠肠道菌群分析
(1)粪便的收集 治疗结束后收集各组大鼠相应结肠位置的新鲜粪便,置于无菌冻存管中,-80 ℃冰箱中保存。
(2)结肠内容物细菌基因组DNA的提取 使用QIAamp粪便DNA提取盒提取DNA,用紫外分光光度计在260 nm波长下测定吸光度值(absorbance,A),计算其浓度,通过A260/A280值鉴定纯度,进行0.8%的琼脂糖电泳验证其完整性。
(3)测序及分析 PCR扩增基因组DNA,引物为细菌16S rDNA V4区特异性引物,扩增片段长度约为225个碱基,构建测序文库,采用Miseq平台测序,随后对高质量测序数据进行生物信息学分析。

3 结果
3.1 各组大鼠湿热型UC模型复制结果及一般状态观察 模型复制成功后第2天开始,正常组大鼠精神活泼,反应敏捷,毛发光亮,饮食正常,大小便正常,模型组、美沙拉嗪组、白头翁汤各治疗组大鼠均出现黏液血便,精神不振,食量下降,毛发散乱,体质量下降。治疗3 d后模型组、正常组随机选取2只进行模型评价。治疗过程中因灌肠方法不当,正常组死亡1只,美沙拉嗪组死亡1只,白头翁汤中剂量组死亡3只,白头翁汤高剂量组死亡3只。给药后白头翁汤各剂量组、美沙拉嗪组大鼠体质量逐渐回升,肉眼血便逐渐减少,逐渐成形,毛发及精神状态逐渐好转。
3.2 各组大鼠DAI评分比较 与正常组比较,模型组DAI评分显著升高(P<0.05);与模型组比较,各治疗组DAI评分显著降低(P<0.05);白头翁汤各剂量组与美沙拉嗪组DAI评分比较,差异无统计学意义(P>0.05),提示白头翁汤各治疗组和美沙拉嗪组在缓解症状方面作用相当。见图1。

注:A.正常组(n=9);B.模型组(n=8);C.白头翁汤低剂量组(n=10);D.白头翁汤中剂量组(n=7);E.白头翁汤高剂量组(n=7);F.美沙拉嗪组(n=9);与模型组比较,*P<0.05

3.3 光镜下各组大鼠结肠组织形态学变化 正常组大鼠结肠上皮组织均完整,组织结构正常,无炎症细胞浸润;模型组黏膜层欠完整,可见一溃疡面深达肌层,腺体排列不规则,大量炎症细胞浸润及明显毛细血管扩张充血;白头翁汤各剂量组和美沙拉嗪组大鼠结肠组织上皮尚完整,黏膜层稍有缺损,无深达肌层的溃疡面,有较多炎症细胞浸润,腺体排列尚规则,有毛细血管充血。见图2。
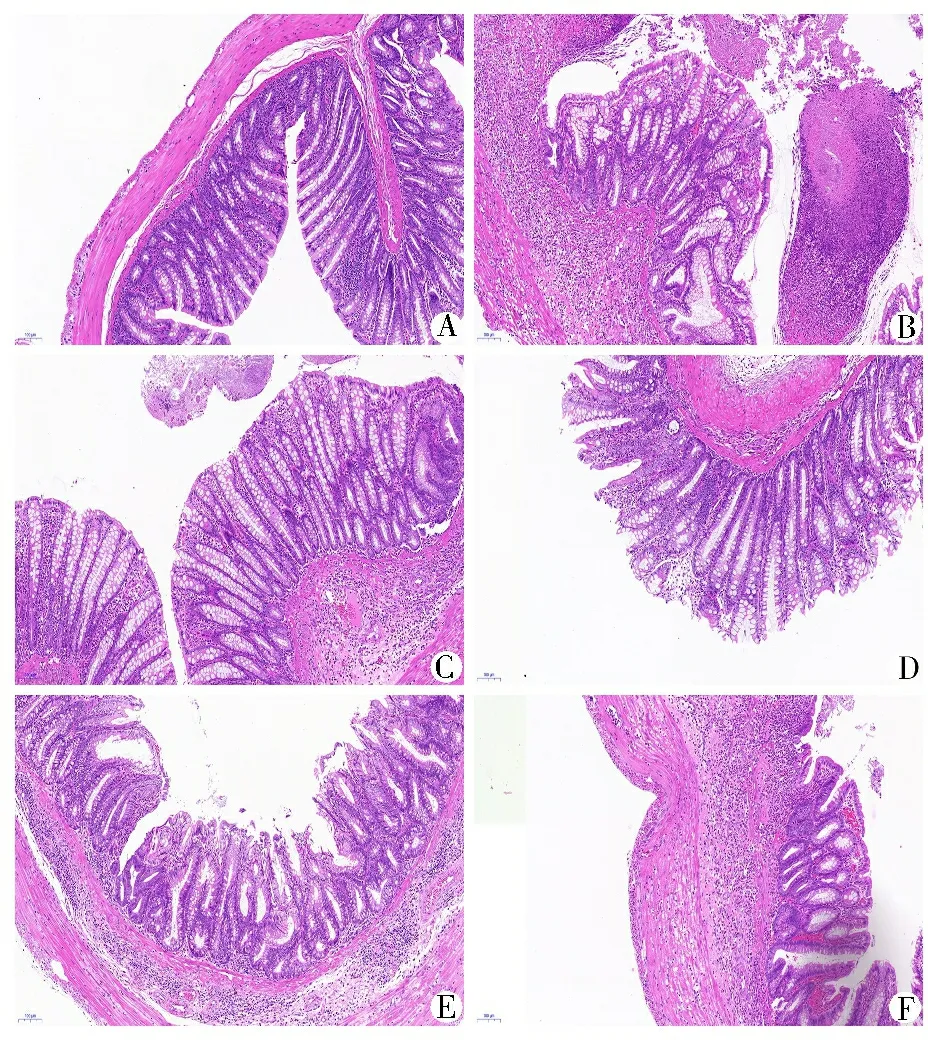
注:A.正常组;B.模型组;C.美沙拉嗪组;D.白头翁汤低剂量组;E.白头翁汤中剂量组;F.白头翁汤高剂量组
图2光镜下大鼠结肠组织形态学变化比较(HE染色,10×40倍)
3.4 各组大鼠肠道菌群对比分析
3.4.1 测序质量及肠道菌群多样性评估 实验的50个样本一共得到1 117个操作分类单元(operational taxonomic units,OTUs)。由图3A可以看出,当样本量接近50时,增加样品量很少产生新的OTUs,表明样品量足够;根据样品的共有OTUs以及OTUs所代表的物种,可以找到核心微生物组。如图3B所示,各组共有36个相同的核心微生物组,其中正常组有6个特征核心微生物组,模型组有2个特征核心微生物组,白头翁汤低剂量组有3个特征核心微生物组,白头翁汤中剂量组有5个特征核心微生物组,白头翁汤高剂量组有3个特征核心微生物组,美沙拉嗪组有3个特征核心微生物组。
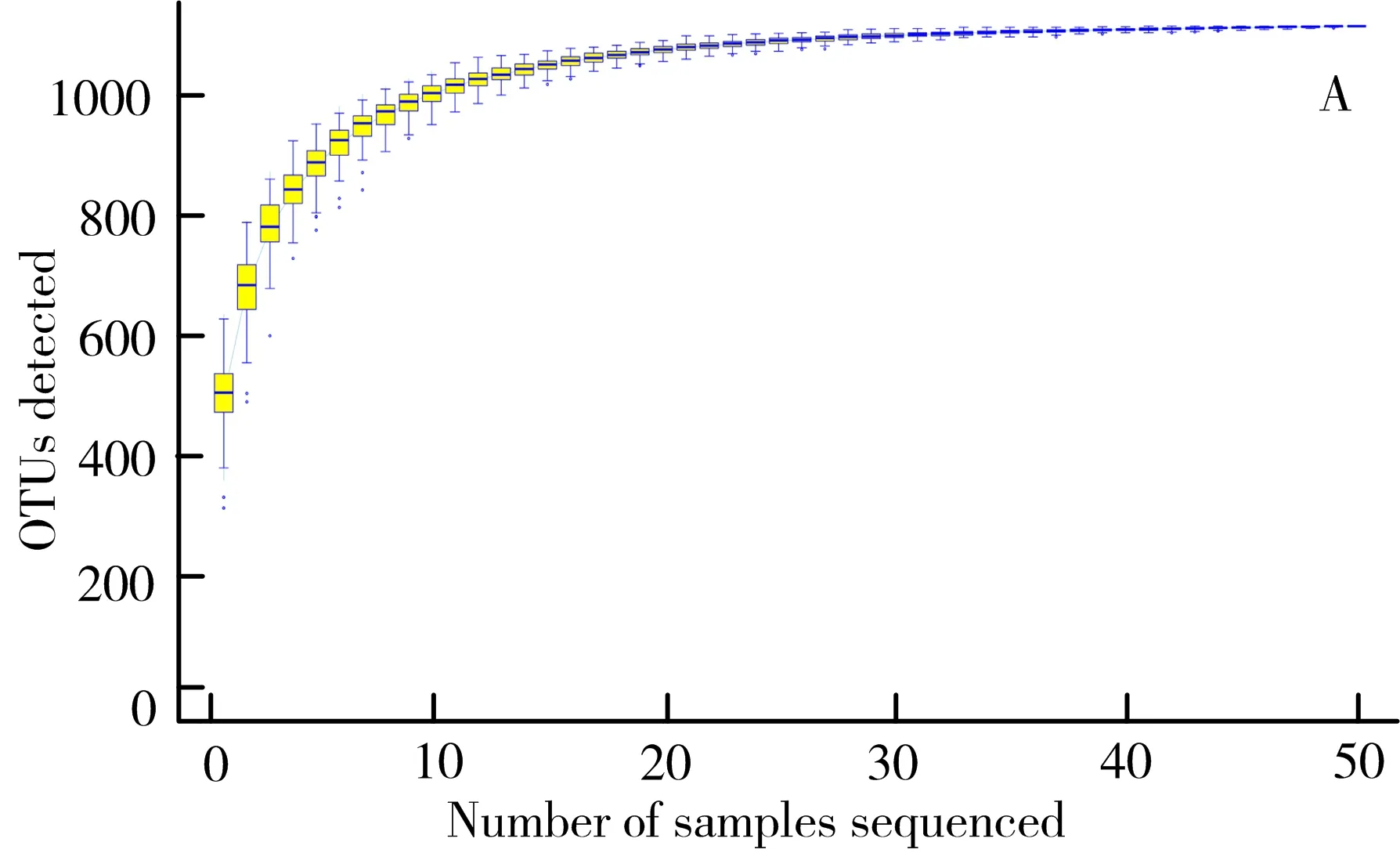

注:A. Specaccum物种累积曲线;B. OTUs花瓣图
3.4.2 各组大鼠肠道菌群在门水平上结构组成分析 根据物种注释结果,物种丰度在门水平筛选出排名前20优势物种,制作物种谱柱状图(见图4)。在门水平上各组优势菌门均为厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)。厚壁菌门/拟杆菌门(Firmicutes/Bacteroidetes,F/B)值在正常组大鼠为0.78,模型组大鼠上调为1.51,白头翁汤低剂量组下调为1.33,白头翁汤中剂量组下调为0.90,白头翁汤低剂量组下调为1.39,美沙拉嗪组下调为1.00。见表1。

图4 门水平中不同组的物种谱柱状图

组 别厚壁菌门拟杆菌门F/B正 常41.5353.320.78模 型52.3334.791.51白头翁汤低剂量50.6437.861.33白头翁汤中剂量44.2448.910.90白头翁汤高剂量51.3736.791.39美沙拉嗪44.40 44.171.00
3.4.3 各组大鼠在属的水平上肠道菌群物种分类树及优势菌属分析 根据物种分类结果,筛选出优势物种,对物种丰度前20进行分类树统计,从整个分类系统上了解各组的优势物种的丰度差异和进化关系图。其中在属水平上优势菌属前3位分别为普氏菌属(占38.75%)、拟杆菌属(占9.05%)、乳杆菌属(占7.11%),见图5。模型组和正常组比较,普氏菌属在模型组中丰度降低,治疗组中白头翁汤低、高剂量组,美沙拉嗪组与模型组相比丰度回调,中剂量组与模型组基本持平;拟杆菌属丰度各组基本持平;模型组和正常组比较,乳杆菌属在模型组中丰度降低,治疗后白头翁汤低、中、高剂量组,美沙拉嗪组与模型组相比丰度回调。见图6。
4 讨论
UC常见的病理特点为黏膜的急慢性炎症、溃疡及腺瘤性息肉形成[8]。肠道正常微生物群可以对肠道黏膜免疫功能、肠上皮细胞的更新、黏液分泌、黏膜血流及肠蠕动产生影响[9-11],因此肠道微生物群失调可能是促进UC发生的重要诱因。多项研究表明,UC患者存在粪便异常及肠道菌群失调,其发病机制包括局部微脉管系统损伤,产生趋化因子,引起白细胞游出,导致组织被金属蛋白酶和其他活性物质损伤,从而扩大炎症反应,导致上皮屏障破坏,进而使更多的肠道有害菌产物进入血液系统导致发病[12]。

注:不同颜色表示不同的分类水平,圆圈的大小代表该分类的相对丰度大小;分类名下方的数字表示相对丰度百分率

图6 属水平中不同组的物种谱柱状图
肠道菌群的物种多样性和丰富度是反映肠道菌群组成的重要指标[13]。本研究中模型组与正常组相比,核心微生物组数量下调,经过治疗后,白头翁汤低、中、高剂量组,美沙拉嗪组核心微生物组数量均回调。人体肠道菌群90%由四大门组成,其中以厚壁菌门(49%~76%)与拟杆菌门(16%~23%)占据主要优势,其次是变形菌门及放线菌门[14-15],大鼠优势菌门与人体相似,均以厚壁菌门、拟杆菌门为主,F/B可有效反映肠道菌群的紊乱情况。有研究表明,在急性UC的发病过程中F/B是显著升高的[16]。此次研究中,模型组大鼠F/B较正常组升高,而经过白头翁汤以及美沙拉嗪干预后出现回调,其中以白头翁汤中剂量组和美沙拉嗪组回调幅度最大,表明白头翁汤和美沙拉嗪在一定程度上可以改善肠道紊乱的情况。
普氏菌属和乳杆菌属作为人体肠道中重要的益生菌属,普氏菌属主要参与了碳水化合物以及植物蛋白的分解及代谢过程[17];乳杆菌属可使肠道微生态系统发生有益的变化[18],其可以抑制肠道炎症因子的产生。有研究表明,肠道内丙二醛水平与乳杆菌属水平呈负相关,白细胞介素10指标与乳杆菌属则呈正相关[19]。在本次研究对属水平的观察中,笔者发现模型组大鼠普氏菌属与乳杆菌属丰度明显下降,但经过白头翁汤及美沙拉嗪干预后均出现回调,普氏菌属以美沙拉嗪组回调幅度最大,乳杆菌属以白头翁汤中剂量组回调幅度最大。故白头翁汤和美沙拉嗪可能通过增加普氏菌属和乳杆菌属等益生菌的丰度,恢复肠道吸收功能,减少丙二醛炎症因子的合成,增加白细胞介素10抑炎因子的释放,进而间接或者直接地治疗UC。
综上所述,肠道湿热贯穿了UC的发病始末,治疗上应以清热利湿为原则,药用苦寒燥湿之品,方可用白头翁汤治疗[20]。本研究通过白头翁汤对比美沙拉嗪干预治疗UC大鼠,发现不同浓度的白头翁汤对该病的治疗效果具有差异性,白头翁汤中剂量组疗效更接近于美沙拉嗪组。白头翁汤和美沙拉嗪均可能通过回调发病大鼠肠道菌群物种丰富度和多样性,增加普氏菌属和乳杆菌属等益生菌的丰度,从而减轻炎症反应,恢复肠道吸收功能,达到对UC的治疗。但中药复方成分多样,其作用机制复杂,课题组还需进一步设计实验,通过中药网络分析法在分子水平上去探究白头翁汤治疗UC的作用靶点,并利用粪菌移植验证和筛选出可能与UC发病相关的靶菌,为白头翁汤治疗UC提供更为可靠的理论依据。

