海水淡化浓盐水制碱工艺研究
王松晓,谢智勇,李治水
(天津渤化永利化工股份有限公司 天津300456)
随着经济的快速发展及人口的急剧增加,人类对自然资源的需求逐渐加大[1]。淡水资源短缺日益严重,海水淡化技术在一定程度上暂时解决了淡水资源短缺的危机,成为增加淡水资源量的一个有效的方法和途径[2],同时也带来一系列问题:产生大量的浓盐水该如何处理,如果直接排放,不仅造成资源的大量浪费,还对周围的环境造成污染[3]。
为了实现固体废盐的资源化利用,本文以 Na+、NH4+//HCO3-、Cl-、SO42--H2O 体系相图为依据,对海水淡化浓盐水中氯化钠和硫酸钠混盐制碱的工艺进行了研究,确定了循环制碱方案,在此基础上开展相关试验,制备出纯碱及农铵,为海水淡化浓盐水的综合利用提供了新的方向。
1 Na+NH4+//HCO3-Cl-SO42--H2O体系相图
以氯化钠和硫酸钠饱和溶液为原料制备碳酸氢钠,其反应式如下:


绘制 35℃ Na+、NH4+//HCO3-、Cl-、SO42--H2O体系正三棱柱的干盐相图,如图1所示。

图1 35℃ Na+,NH4+// HCO3-、Cl-、SO42--H2O 体系三棱柱相图Fig.1 Triangular phase diagram of Na+, NH4+//HCO3-,Cl- and SO42--H2O systems at 35℃
根据图1可知,初始饱和溶液组成为 R0,(NH4HCO3)2加入后,体系点沿着 R0和(NH4HCO3)2的组成点 F1联线移动到 R点。由于 R点处于NaHCO3结晶区内,液相点就会在(NaHCO3)2顶点A1与R点联线的延长线上移动。若R体系点含水量合适,液相点正好与处在 NaHCO3-NH4Cl的共饱面M点重合,此时析出(NaHCO3)2量最多。由于三棱柱具有空间结构,M 点的位置无法确定,从(NaHCO3)2顶点出发,将(NaHCO3)2和其他盐的共饱面放射投影到(NaCl)2-(NH4Cl)2-(NH4)2SO4-Na2SO4面上,作(NaHCO3)2的放射投影图以及(NaHCO3)2图和 H2O图,求出R点与M点的H2O量和(NaHCO3)2量,便可确定析出(NaHCO3)2理论量,其投影图如图2所示。
由于R点与M点的H2O量和(NaHCO3)2量与(NH4HCO3)2的加入量有一定关系,即假设在 1mol干盐的饱和盐水 R0中加入 0.700mol(NH4HCO3)2,此时作出放射投影图,便可求出 R点 H2O量和(NaHCO3)2量,具体结果列于表1。
结合图2:在图2(a)中联结C3M并延长交A4B4于 a点,由于 A4和 B42点的 H2O量和(NaHCO3)2量已知[5],将图2(a)的 a投影到图2(b)的 A4wB4w和A4bB4b上就可求得a点的H2O量aw和(NaHCO3)2量ab;在图2(b)上连接 C3waw和 C3bab,将图2(a)的 M点投影于其上即可求出Mw=9.700molH2O/mol总干盐和 Mb=0.159mol/mol无(NaHCO3)2干盐。Rw、Rb、Mw和 Mb已求,通过计算便可得 R 溶液生成(NaHCO3)2理论量为 0.6312mol/mol总干盐。用同样的方法计算不同(NH4HCO3)2加入量下生成(NaHCO3)2的理论量,结果如表2所示。

图2 35℃ Na+,NH4+// HCO3-、Cl-、SO42--H2O 体系的放射投影图、(NaHCO3)2图和H2O图Fig.2 Radiographic projections of Na+, NH4+//HCO3-, Cland SO42--H2O systems and diagrams of(NaHCO3)2 and H2O at 35℃

表1 35 ℃饱和盐水加入0.700mol(NH4HCO3)2的体系点R的组成Tab.1 Composition of system point R of saturated brine with 0.700mol(NH4HCO3)2 at 35 ℃
由表2可知,随着(NH4HCO3)2加入量增加,生成(NaHCO3)2理论量随之增加。(NH4HCO3)2加入量为 1.025mol/mol总干盐时,生成(NaHCO3)2理论量最多,钠的利用率最高。这是因为在图2(a)NaHCO-3NH4Cl结晶区内,随着(NH4HCO3)2加入量的增多,a点沿着共饱线(D3A4,A4B4,B4D4,D4E2,E2B3)从 D3点向 E2点移动,但不能继续向 E2B3移动(因为 a只能位于 NaHCO3结晶区内),所以当(NH4HCO3)2加入量为 1.025mol/mol总干盐时,a点与共饱点 E2重合,此时向上作垂线,在图2(b)求取的(NaHCO3)2量最多。实际反应过程中,(NaHCO3)2生成量也不可能随着(NH4HCO3)2加入量增加而无限制增多,当(NH4HCO3)2加入量超过一定值以后,会有一部分未反应的(NH4HCO3)2作为杂质影响(NaHCO3)2质量。因此可以判断当(NH4HCO3)2加入量为1.025mol/mol总干盐时,生成(NaHCO3)2理论量最多,钠的利用率接近 100%,可作为试验中 NH4HCO3加入量的参考依据。
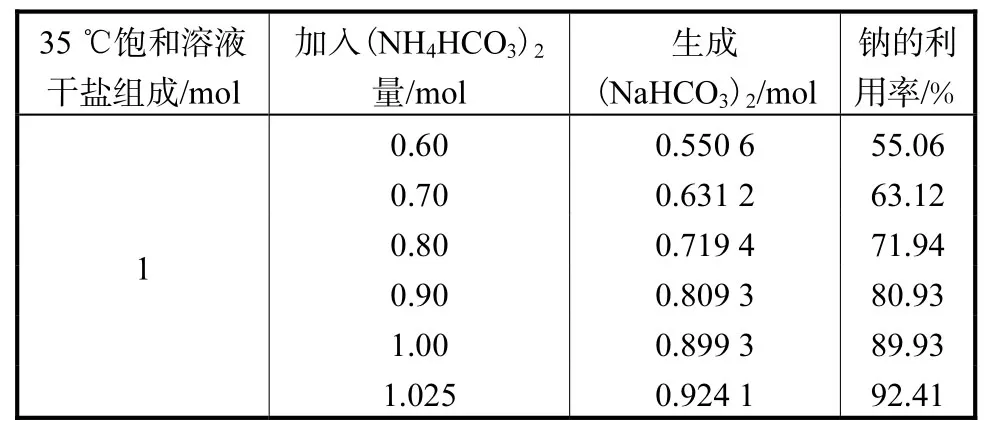
表2 在不同(NH4HCO3)2加入量下生成(NaHCO3)2理论量及相应钠的利用率Tab.2 Theoretical production of (NaHCO3)2 under different (NH4HCO3)2 additions and utilization rate of corresponding sodium
2 小试试验
2.1 试验方案
本试验以 Na+、NH4+//HCO3-、Cl-、SO42--H2O体系相图为原理,以氯化钠和硫酸钠混合物为原料,设计母液循环试验,制备纯碱和农铵,试验方案如图3所示。
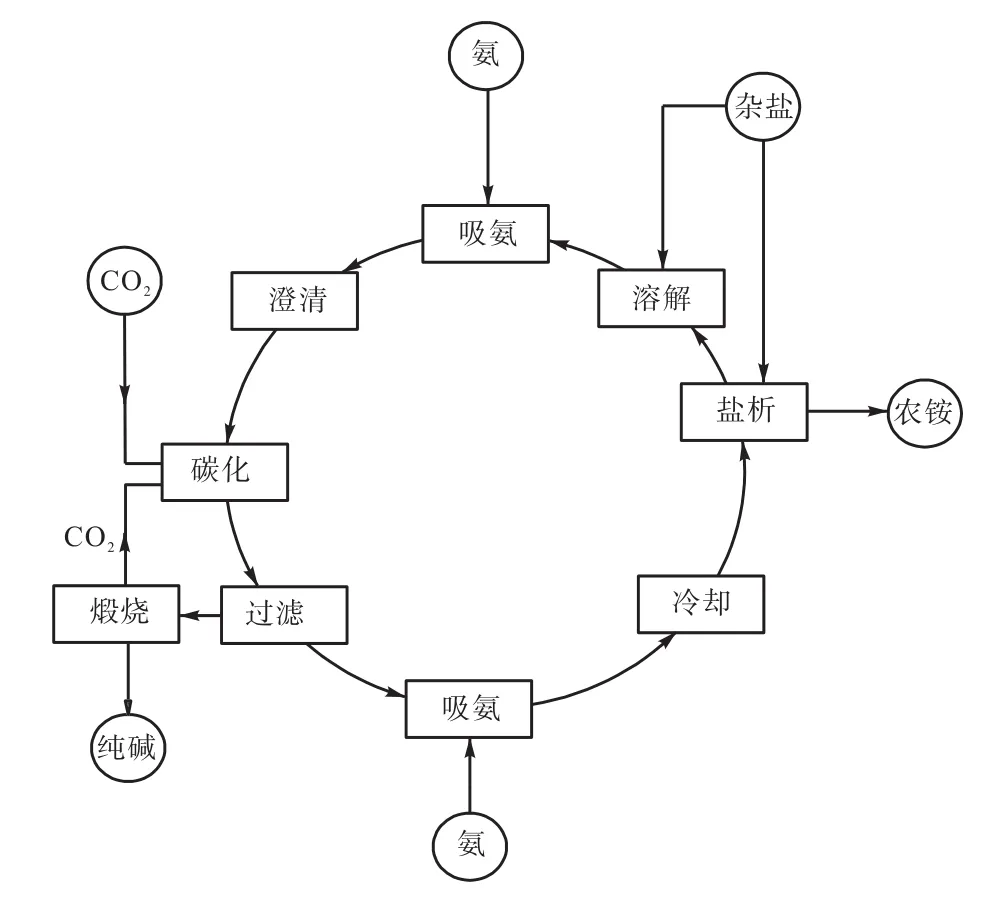
图3 小试试验方案Fig.3 lab-scale experimental scheme
2.2 试验设备及试剂
海水淡化浓盐水制碱工艺中使用到的试验设备如表3所示。

表3 海水淡化浓盐水制碱工艺试验使用的主要设备Tab.3 Main equipment used in soda ash production experiment of brine from seawater desalination
海水淡化浓盐水制碱工艺实验中使用的主要试验药品如表4所示。

表4 海水淡化制碱工艺试验使用的主要药品Tab.4 Main drugs used in soda ash production experiment of brine from seawater desalination
2.3 实验装置
本实验中使用的装置如图4所示。

图4 制碱装置Fig.4 soda ash experimental setup diagram
2.4 试验结果与讨论
2.4.1 反应时间对碳酸氢钠产率的影响
反应时间是决定碳酸氢钠产率的一个重要影响因素,在反应温度 35℃,n(NH4HCO3)/(TNa)=1.0,加入碳酸氢氨,在不同时间取样分别测定滤饼中NaHCO3含量,考察反应时间对碳酸氢钠产率的影响。试验结果如图5所示。

图5 反应时间对NaHCO3产率的影响Fig.5 Effect of reaction time on yield of NaHCO3
图5表明碳酸氢钠产率随反应时间的延长而增大,反应进行到 60min后碳酸氢钠产率变化趋缓,表明此时反应已经基本完成,故制碱反应时间为1~2h。
2.4.2 反应温度对碳酸氢钠的影响
按照 n(NH4HCO3)/(TNa)=1.0加入碳酸氢铵,设定反应时间为 90min,搅拌速度为 800rpm,考察不同反应温度对碳酸氢钠产率的影响。实验结果如图6所示。
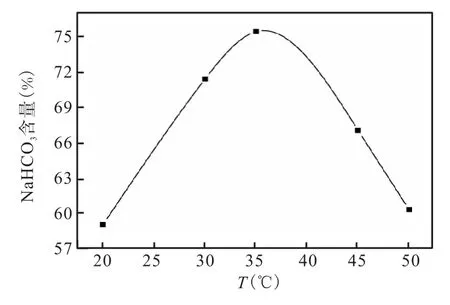
图6 反应温度对NaHCO3产率的影响Fig.6 Effect of reaction temperature on yield of NaHCO3
由图6可知,随着温度的升高,产品中碳酸氢钠的产量先升高后降低,36℃时产品中碳酸氢钠含量最高。这是因为温度高于 36℃时,加入的碳酸氢铵易分解,同时碳酸氢钠溶解度增大,使产物中碳酸氢钠量减少,所以本实验最佳温度为30~40℃。
2.4.3 洗涤水量对碳酸氢钠纯度的影响
由上述步骤制备的碳酸氢钠如果直接煅烧,母液中夹带的盐分会影响纯碱质量,造成纯碱中盐分含量偏高。因此,碳酸氢钠煅烧前需要进行洗涤,考察不同洗涤水量对碳酸氢钠纯度的影响。实验结果如表5所示。
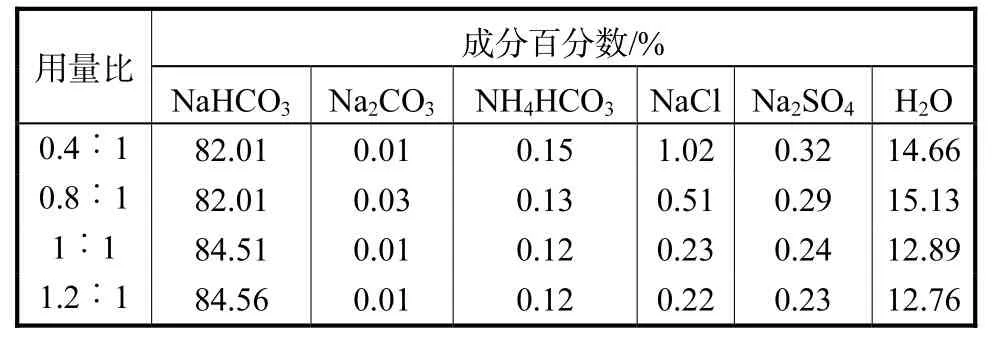
表5 洗涤水量对NaHCO3纯度的影响Tab.5 Effect of washing water on purity of NaHCO3
由表5可以看出,随着洗涤水量的增加,产品中碳酸氢钠含量增多,盐含量逐渐较少。使用洗涤水量与产品质量比 1∶1时得到的洗涤产品进行煅烧,得到的纯碱符合国标要求,因此洗涤水量与产品质量比为 1∶1。
2.4.4 吸氨量的确定
吸氨过程可以将母液 I中的 HCO3-反应转化为CO32-,防止盐析过程中碳酸氢盐的析出,保证氯化铵产品的纯度。但吸氨量过大会恶化生产条件,吸氨量过低重碳酸盐会和氯化铵共析。取不同吸氨时间的母液分别进行检测,考察氨气对母液 I成分的影响。实验结果表6所示。

表6 吸氨时间对母液I成分的影响Tab.6 Effect of ammonia absorption time on composition of mother liquid I
由表6可知,随着吸氨时间的延长,氨母液 I中固定氨含量基本不变,游离氨含量逐渐增加,到一定程度时游离氨含量增加缓慢,溶液中碳酸氢根含量降低至 0,当吸氨时间为 15min时,溶液中的碳酸氢根已全部转化为碳酸根,因此本实验中吸氨时间15min即可满足要求。
2.4.5 混盐加入量的确定
混盐加入量会影响盐析过程中产品的质量和产量。混盐加入量不足,影响产量。混盐加入量过大,易出不合格产品。本实验中分别取 300mL母液,加入不同质量的混盐,测定析出固体的质量及各物质含量。结果如表7所示。

表7 混盐加入量对析出产品的影响Tab.7 Effect of mixing salt content on precipitated products
由表7可以看出,当混盐加入量为30g时,不能析出固体,随着混盐加入量的增加,析出固体的质量逐渐增加,且Cl-和 Na+含量逐渐增加,析出产品中各离子含量同国标中农铵的标准比较,当混盐加入量为55g时,析出产品的质量符合标准,且此时产品析出量最大。
3 结论与展望
通过 Na+、NH4+// HCO3-、Cl-、SO42--H2O 体系相图分析,使用氯化钠和硫酸钠混盐可以制备出纯碱。
制碱实验中,海水淡化浓盐水制备纯碱的最佳反应时间为1~2h,反应温度为30~40℃,洗涤水量与产品质量比为 1∶1,可以制备出合格的纯碱产品;制氨实验中,最佳吸氨时间为 15min,混盐加入量为55g,析出产品的质量符合农铵标准。
采用该方案可以使用海水淡化浓盐水制备出合格的碳酸钠和氯化铵产品,变废为宝,同时可以避免海水淡化浓盐水的排放,减少环境污染。未来还需在小试实验基础上进一步研究海水淡化浓盐水制碱工业化方案,进行经济效益分析,为工业化生产提供依据。

