星点设计-效应面法优化大孔树脂纯化还原型萝卜硫苷工艺及体外抗氧化活性研究
张元元,王绍花,代孟孟,韩真真,朱立俏,盛华刚
山东中医药大学药学院,济南 250355
近年来,十字花科蔬菜因丰富的营养价值及药用价值备受国内外研究者关注,其富含硫代葡萄糖苷(glucosinolates,简称硫苷)、脂肪酸、生物碱、酚性物质、黄酮醇、皂苷等多种活性成分[1]。研究表明,常食用十字花科蔬菜可减少心血管疾病及癌症的发病率[2]。硫苷是十字花科蔬菜中重要的一类次生代谢产物[3],目前已有200多种硫苷被发现。其中从西兰花和西兰花籽中提取的萝卜硫苷(glucoraphanin,GRA),在内源芥子酶的作用下能降解产生的一种异硫氰酸酯类化合物——萝卜硫素(sulforaphane)[4],对多种癌症均有预防和治疗方面的潜力[5,6]。
萝卜苷(glucoraphenin,GRE)是萝卜硫苷脱去一分子氢的氧化产物,主要存在于萝卜根和种子中[1,7],它与还原型萝卜硫苷(4-甲硫基-3-丁烯基硫代葡萄糖苷,glucoraphasatin,GRH,结构见图1)是一组氧化还原对,二者差异只是侧链上硫的氧化程度不同,而不同的氧化状态对Ⅰ期致癌酶和Ⅱ期解毒酶起不同的调控作用[8]。研究发现,GRH及其降解产物还原型萝卜硫素(raphasatin,RAS)都是参与多环芳烃、杂环胺、霉菌毒素等化学致癌物解毒的大鼠肝脏Ⅱ期酶的强有力诱导剂[9,10],并且对过氧化氢和自由基化合物有直接的抗氧化能力[11],GRH可通过调节果蝇体内的葡萄糖含量来调节能量代谢,这些过程经常影响糖尿病等慢性病[12],因此GRH值得进一步研究。
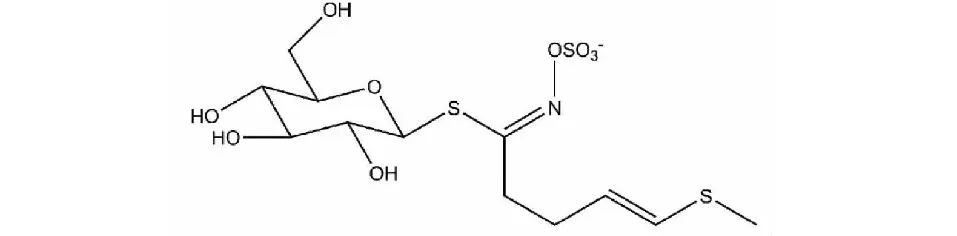
图1 GRH的化学结构 Fig.1 The chemical structure of GRH
GRH主要存在于萝卜根及芽中,占萝卜中硫苷总量的70%以上[7],Wang等[13]从萝卜芽苗中纯化得到的GRH纯度可达98%,但工艺复杂,成本较高,不适宜大批量制备。大孔树脂因吸附性好、解吸容易并且机械强度好的特点被广泛应用于天然产物有效成分的分离纯化[14]。考虑萝卜的产量和价格,本研究以青萝卜为原料,用8种不同型号的大孔树脂对萝卜提取液中的GRH进行吸附和解吸,以吸附率和解吸率为指标筛选出较佳型号的大孔树脂,采用单因素考察和星点设计-效应面法优选出大孔树脂纯化GRH的工艺参数,并通过GRH对自由基DPPH及ABTS+·的清除能力考察其抗氧化活性,为GRH的进一步开发和应用提供参考。
1 材料与方法
1.1 材料及试剂
青萝卜(市售,为十字花科植物萝卜RaphanussativusL.的栽培品种);还原型萝卜硫苷标准品(GRH,实验室自制,纯度>98%);大孔树脂 HPD100C,HPD-400,AB-8,HPD-500,DM130,NKA-9,HPD-700,HPD-722(沧州宝恩吸附材料科技有限公司);1,1-二苯基-2-三硝基苯肼自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH),2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2′-azinobis- (3-ethylbenzthiazoline-6-sulphonate) radicals,ABTS+·),维生素C(VC,上海源叶生物科技有限公司);乙腈(色谱纯,天津科密欧化学试剂有限公司);水为娃哈哈纯净水,其他试剂为分析纯。
1.2 仪器与设备
Agilent1260型高效液相色谱仪(美国安捷伦科技有限公司);色谱柱 InertSustain AQ-C18柱(4.6 mm×250 mm,5 μm);Multiskan MK3酶标仪(赛默飞世尔上海仪器有限公司);KQ5200型超声波清洗器(昆山市超声仪器有限公司);MS105DU十万分之一电子天平(瑞士Mettler-Toledo公司);HI98100微电脑酸度pH测定仪(深圳赛泽尔电子有限公司)。
1.3 实验方法
1.3.1 高效液相色谱法测定GRH含量
1.3.1.1 色谱条件
InertSustain AQ-C18柱(4.6 mm×250 mm,5 μm),流动相:乙腈(A)-0.1%磷酸水(B),梯度洗脱(0~15 min,14%~20% A,15~25 min,20%~100%A),流速1.0 mL/min,进样量20 μL,柱温27 ℃,检测波长为225 nm。
1.3.1.2 标准曲线的建立
精密称取GRH 标准品适量制成0.76 mg/mL的对照品溶液,精密吸取对照品溶液0.2、0.4、0.6、1.2、2.5 mL,置于5 mL量瓶中,加水稀释至刻度,摇匀,经0.22 μm微孔滤膜滤过后,按1.3.1.1项下色谱条件下操作,以GRH浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得回归方程为Y=22 954X-268.11(r=0.999 9),表明GRH在0.03~0.38 mg/mL范围内线性关系良好。
1.3.1.3 萝卜提取液的制备及GRE含量测定
青萝卜洗净后切片,置笼屉内于100 ℃沸水锅上隔水加热10 min,蒸透后取出;取蒸制后的青萝卜适量,加10倍量水煎煮2次,每次1 h,合并煎液,滤过,水提液浓缩至相对密度为1.05,加入乙醇至乙醇浓度为70%,静置24 h后过滤,滤液减压浓缩回收乙醇,即得萝卜提取液。取萝卜提取液适量,稀释,经0.22 μm的微孔滤膜滤过后,按照1.3.1.1项下的色谱条件,测定萝卜中GRH的含量。根据生药量计算,每g新鲜萝卜中GRH含量为0.20 mg。
1.3.2 树脂预处理
分别取8种类型(HPD-100C,HPD-400,AB-8,HPD-500,DM130,NKA-9,HPD-700,HPD-722)大孔树脂,用95%乙醇进行浸泡,至大孔树脂不再膨胀,将树脂转移到层析柱中,用蒸馏水将其反复清洗到无醇味,备用。
1.3.3 大孔树脂型号筛选
称取已处理好的8种大孔树脂各1 g,分别置于100 mL具塞锥形瓶内,精密量取10 mL萝卜提取液,室温条件下振荡24 h,充分吸附后滤过,测定滤液中GRH质量浓度;用10 mL蒸馏水洗涤滤过后的各型号树脂,置于100 mL具塞锥形瓶中,各加20 mL50%乙醇,室温条件下振荡24 h,充分解吸后滤过,测定滤液中GRH质量浓度,利用公式(1)~(4)计算各型号树脂的饱和吸附量、吸附率、洗脱率和纯化效率。
(1)

(2)

(3)

(4)
式中:Q为饱和吸附量/(mg/mL);C0为吸附前GRH质量浓度/(mg/mL);C1为吸附后滤液GRH质量浓度/(mg/mL);V0为加入的萝卜提取液体积/mL;M为树脂质量/g;C2为解吸后滤液中GRH质量浓度/(mg/mL);V2为洗脱液体积/mL。
1.3.4 动态吸附泄露曲线的绘制
取已经处理好的HPD-722型树脂,按径高比1∶8湿法装柱上样(Φ1.5×12 cm),萝卜提取液浓度为0.22 mg/mL,调上样液pH为5,控制上样液体积流量为3 BV/h上样。分段收集流出液,每10 mL收集1试管流出液,检测其中GRH的浓度,以试管号为横坐标,流出液中GRH的浓度为纵坐标,绘制大孔树脂动态吸附泄露曲线。
1.3.5 单因素考察上柱工艺
按照1.3.4所述方法装柱上样,以1.3.1.3制得的萝卜提取液为上样液。上样液pH分别调制为3、4、5、6、7,上样液质量浓度配制为0.11、0.22、0.44 mg/mL,上样液流速为1.5、3、6 BV/h,在此条件下,考察各单因素对吸附能力的影响。
1.3.6 星点设计-响应面法考察上柱工艺
采用统计学软件Design-Expert中响应面Central Composite模型,以上样液pH、流速和上样液浓度三个因素为自变量,以比吸附量为响应值,根据星点设计原理,采用三因素五水平响应面分析方法,优化GRH的上柱工艺。试验因素与水平见表1。

表1 星点设计-效应面法实验因素水平Table 1 Factors and levels in composite design-response surface methodology
1.3.7 单因素考察洗脱工艺
以优选出的最佳上柱工艺上样,以3 BV 的70%乙醇为洗脱液进行洗脱,洗脱速度为3 BV/h。洗脱液体积分数分别采用30%、50%、70%、90%,洗脱液体积分别为2、2.5、3 BV,以1.5、3、4.5 BV/h的体积流量分别进行洗脱,测定洗脱液中GRH含量,计算洗脱率,探讨洗脱液体积分数、洗脱液体积和洗脱液体积流量3个因素对洗脱能力的影响。
1.3.8 纯化前后GRH含量比较
按优化工艺纯化萝卜提取液,得到GRH纯化液,将萝卜提取液与纯化液冷冻干燥,分别得到萝卜提取物和GRH提取物,测定纯化前后GRH的含量。
1.3.9 体外抗氧化活性的测定
1.3.9.1 DPPH自由基清除能力测定
根据参考文献[15]中的试验方法,稍作改进。取不同浓度的萝卜提取物、GRH纯化物及GRH标准品测试液50 μL于96孔板中,加入0.2 mmol/L的DPPH溶液100 μL,以Vc作为阳性对照。混匀后室温暗处反应30 min,酶标仪517 nm处测定各孔的吸光度,按公式(5)计算DPPH的清除率。
(5)
式中:A0为反应体系中样品溶液用等体积的去离子水代替测定的吸光度值;A1为反应体系中样品溶液测定的吸光度值;A2为反应体系中 DPPH 溶液用等体积的去离子水代替测定的吸光度值。
1.3.9.2 ABTS+·自由基清除能力测定
根据参考文献[16]中的试验方法,稍作改进,制备ABTS工作液。取不同浓度的萝卜提取物、GRH纯化物及GRH标准品测试液50 μL于96孔板中,加入ABTS工作液150 μL,以VC作为阳性对照。混匀后室温暗处反应6 min,酶标仪734 nm处测定各孔的吸光度, 按公式(6)计算ABTS+·的清除率。

(6)
式中:A0为反应体系中样品溶液用等体积的去离子水代替测定的吸光度值;A1为反应体系中样品溶液测定的吸光度值;A2为反应体系中ABTS+·溶液用等体积的去离子水代替测定的吸光度值。
1.3.9.3 统计学分析
2 结果与分析
2.1 最佳树脂型号的筛选
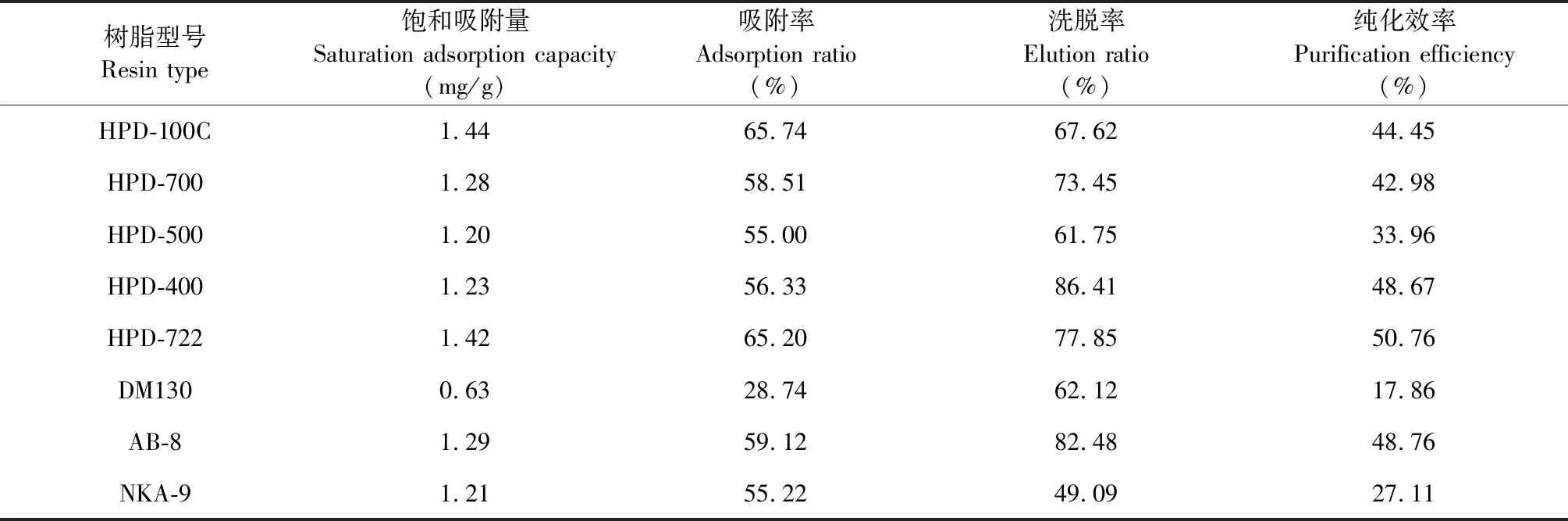
表2 不同型号大孔吸附树脂吸附率、洗脱率及纯化率考察Table 2 Adsorption,elution and purification rates of different types of macroporous adsorbent resins
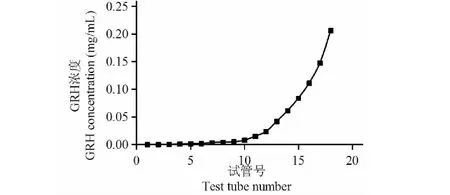
图2 大孔树脂动态吸附泄露曲线Fig.2 Dynamic adsorption leakage curve of macroporous resin
由表2可知,HPD-100C对GRH的吸附量最高,吸附率最好,其次是HPD-722,二者差异不大,从洗脱率来看,HPD-400和AB-8效果较好,其次是HPD-722,综合大孔树脂对GRH的纯化效果,选择HPD-722作为纯化GRH的最佳树脂。
2.2 HPD-722动态吸附泄露曲线
一般认为,当流出液浓度达到上样液浓度的1/10时为泄露点,即为上样终点。由图2可知,还原型萝卜苷在第12管到达泄漏点,此时上样液体积为120 mL,所以选择120 mL为最佳上样量。
2.3 单因素考察上柱工艺试验结果
2.3.1 上样液pH值对GRH比吸附量的影响
由图3可知,GRH在不同pH值下有不同的比吸附量,当pH为4时,比吸附量最大,为1.037 mg/mL,随pH值的增大,比吸附量有减小的趋势,故选择上样液pH为4。

图3 pH值对GRH比吸附量的影响Fig.3 Effect of pH on specific adsorption amount of GRH
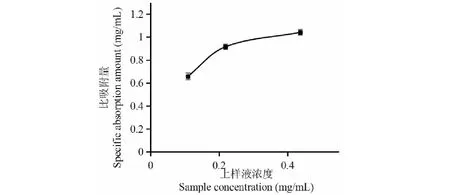
图4 上样液质量浓度对GRH比吸附量的影响Fig.4 Effect of sample concentration on specific adsorption amount of GRH
2.3.2 上样液质量浓度对GRH比吸附量的影响
由图4可知,当上样液质量浓度为0.44 mg/mL时,比吸附量最大,为1.041 mg/mL,故选择上样液质量浓度为0.44 mg/mL。

图5 上样液流速对GRH比吸附量的影响Fig.5 Effect of sample flow rate on specific adsorption amount of GRH
2.3.3 上样液流速对GRH比吸附量的影响
由图5可知,当上样液流速为1.5 BV/h时,比吸附量最大,为1.038 mg/mL,表明最佳上样液流速为1.5 BV/h,故采用流速为1.5 BV/h。
2.4 星点设计-响应面法试验结果与分析
2.4.1 星点试验设计与结果
综合单因素试验的结果,采用星点设计-效应面法设计20组试验组合,试验结果如表3所示。

表3 星点试验设计及结果Table 3 Central composite experiment design and results
2.4.2 二次回归模型拟合及方差分析
以 A、B、C 为自变量,以吸附量为因变量Y,利用Design Expert 8.0.6软件对表3中的试验数据进行二项式拟合,并对模型进行方差分析,结果二项式拟合为Y=1.11+0.034A-0.033B+0.086C+4.775E-003AB+2.750E-003AC-8.925E-003BC-0.025A2-0.031B2-0.068C2。方差分析结果见表4。
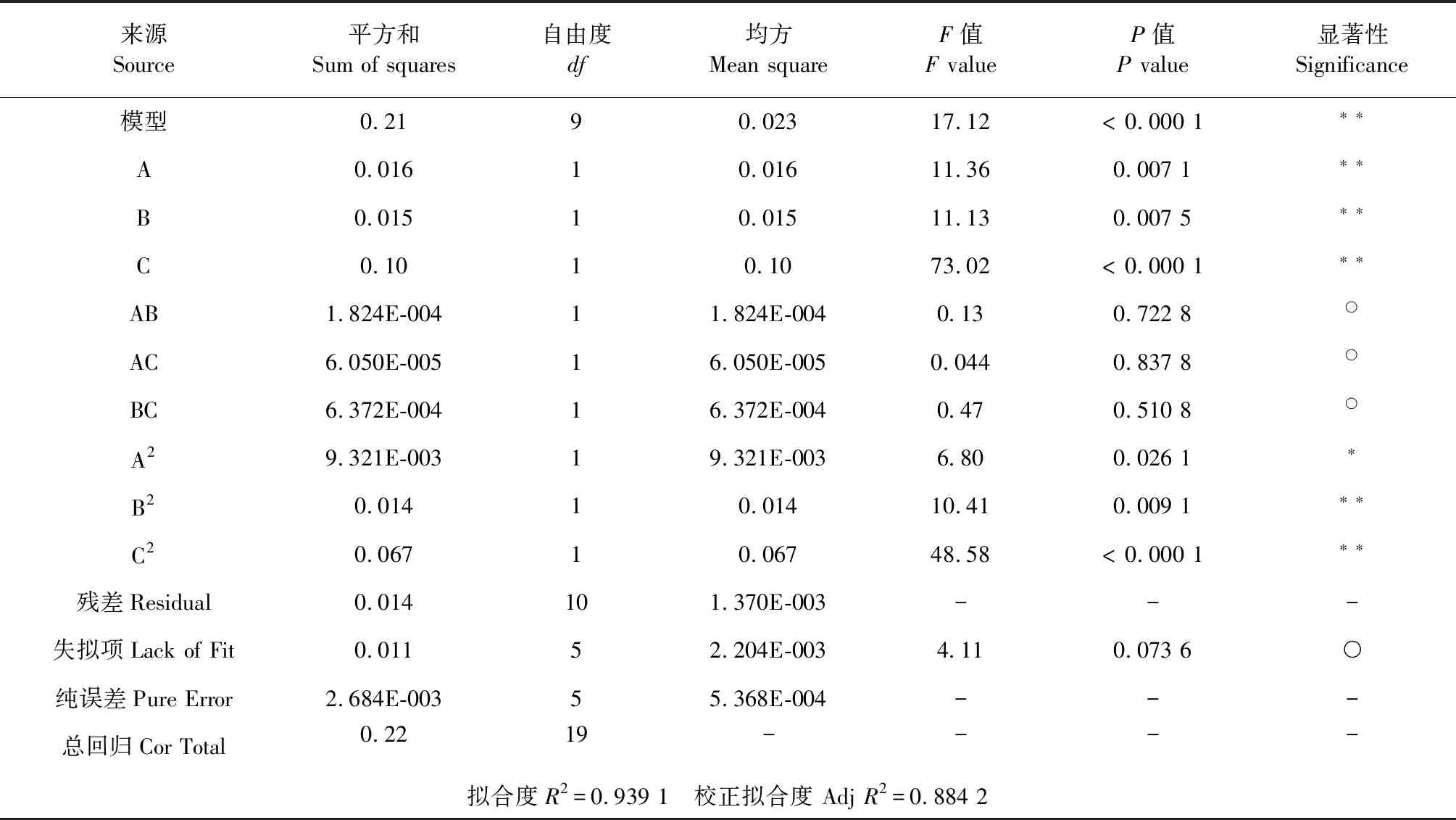
表4 方差分析表Table 4 Anova table
注:**表示差异极显著(P﹤0.01),*表示差异显著(P﹤0.05),○表示差异不显著(P>0.05)。
Note:**,*indicate extremely significant difference,significant difference,respectively,○respresents not significant.
从二次多项式拟合结果来看,模型P<0.000 1,表明该拟合模型具有显著性,拟合度R2=0.939 1,失拟项P>0.05,说明二次多项式方程模型对数据拟合度很高,误差小,模型可靠。一次项A(上样液pH)、B(流速)、C(上样液浓度)极显著,二次项A2显著,B2、C2极显著,交互项AB、AC、BC均不显著,由此可知,各影响因素与比吸附量之间并不是简单的线性关系,各因素影响的大小顺序为:C(上样液浓度)>A(上样液pH)>B(流速)。
交互作用对GRH比吸附量影响的结果如图6所示。响应面图中的响应面坡度越陡峭响应值越敏感,从图中可以看出上样液浓度与pH及流速的曲线均较陡峭,说明上样液浓度对GRH比吸附量的影响最为显著。

图6 各交互作用对GRH比吸附量的影响Fig.6 Effect of interaction of the factors on specific adsorption amount of GRH
2.4.3 上柱工艺预测与验证
优化后得出最佳上样条件:上样液pH 5.3,上样液体积流速2.5 BV/h,上样液浓度0.53 mg/mL,预测最大比吸附量为1.159 mg/mL。按此条件重复三次实验验证,GRH的比吸附量为1.131±0.013 mg/mL,与通过二次多项回归方程得到的预测值(1.159 mg/mL)相比,偏差为2.42%,表明该模型有很好的预测性,所选的上柱工艺有良好的重现性。

图7 洗脱液体积分数对GRH洗脱率的影响Fig.7 Effect of eluent concentration on elution ratios of GRH
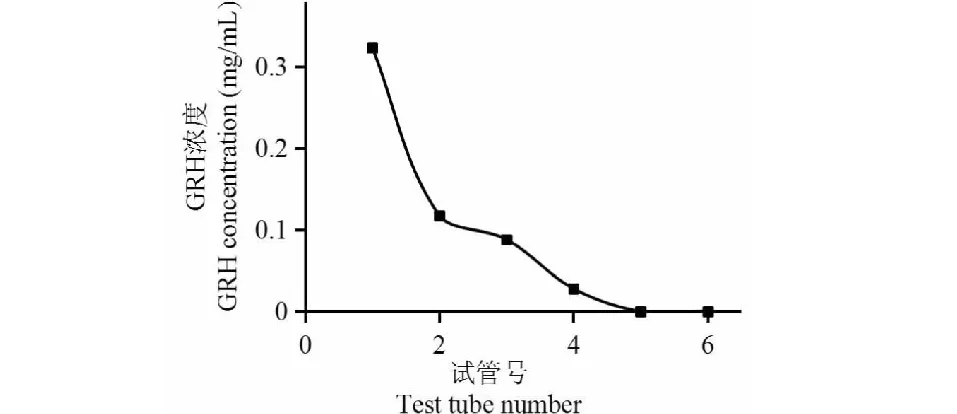
图8 大孔树脂动态洗脱曲线Fig.8 Dynamic elution curve of macroporous resin
2.5 单因素考察洗脱工艺试验结果
2.5.1 洗脱液体积分数对GRH洗脱率的影响
如图7所示,洗脱效果随乙醇体积分数的增大而提高,70%乙醇洗脱率为97.62%,90%乙醇洗脱率为98.44%,但与70%乙醇差别很小,考虑成本问题,采用70%乙醇作为洗脱溶剂。
2.5.2 HPD-722大孔树脂动态洗脱曲线
由图8可知,到第5管时GRH浓度为0,此时洗脱液体积为50 mL(2.5 BV),所以选择2.5 BV为最佳洗脱液体积。
2.5.3 洗脱液体积流量对GRH洗脱率的影响

图9 洗脱体积流量对GRH洗脱率的影响Fig.9 Effect of eluent flow rate on elution ratios of GRH
如图9所示,流速越慢,GRH的洗脱效果越好,以1.5BV/h的体积流量洗脱率最大,为97.59%,故采用1.5BV/h的体积流量进行洗脱。
2.6 纯化前后GRH纯度的测定

表5 GRH纯化前后比较Table 5 Comparison before and after purification of GRH
由表中5可知,GRH含量由纯化前的0.404%,提高至纯化后的17.903%,纯度提高44.35倍,表明采用该方法优化得到的GRH纯化参数准确可靠。
2.7 抗氧化能力测定结果
GRH纯化前后对DPPH、ABTS+·自由基的清除能力如表6所示,以半抑制浓度IC50值来评价抗氧化活性的大小,越小表示抗氧化剂清除自由基的能力越强[15]。由表6可知,自由基的清除率与提取物、纯化物及标准品浓度均呈良好的线性关系,提取物DPPH、ABTS+·自由基的IC50分别为358.468和75.788 mg/mL,纯化物的IC50值分别为5.326和1.674 mg/mL,GRH经纯化后清除DPPH自由基的能力相对提高了67.31倍,清除ABTS+·自由基的能力提高了45.27倍。统计学结果显示,纯化物对DPPH自由基和ABTS+·的清除能力与提取物相比具有极显著差异(P<0.01),并且从ABTS+·自由基清除效果来看,纯化物与阳性药Vc和标准品相比无显著性差异(P>0.05),抗氧化效果明显。
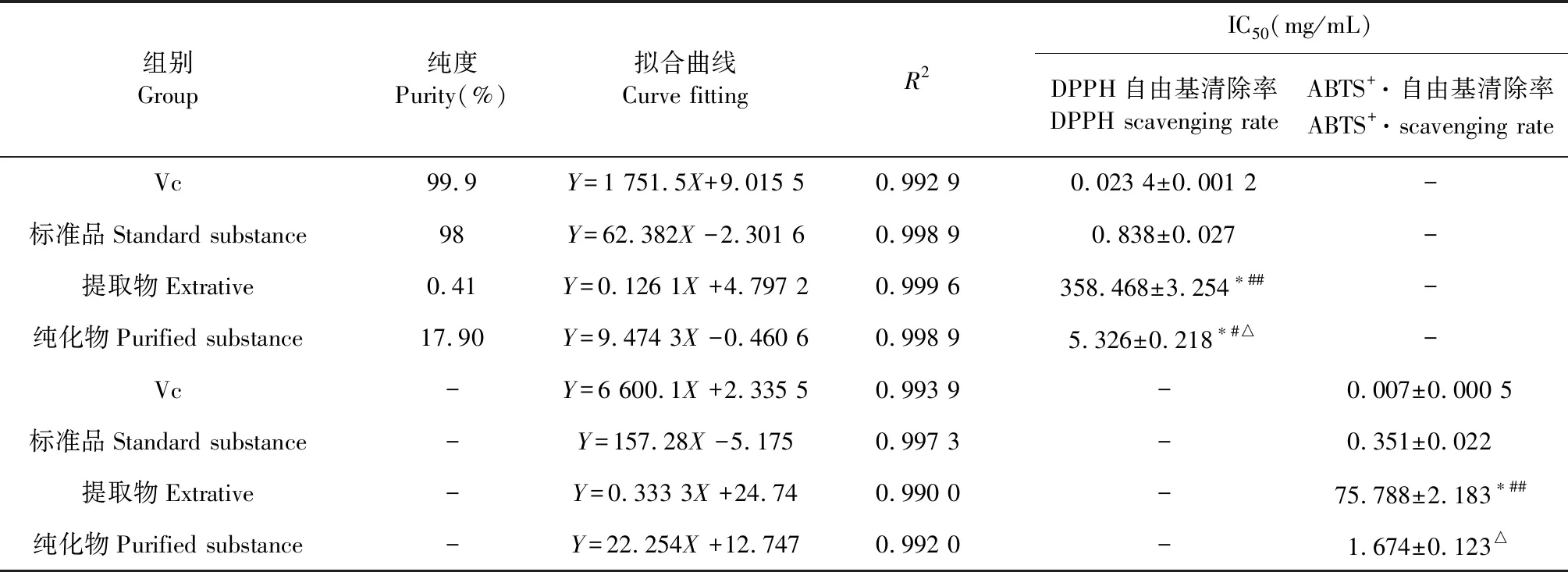
表6 纯化前后GRH对DPPH和ABTS+·自由基的清除能力Table 6 Scavenging ability of before and after purified GRH to DPPH and ABTS+·free radicals
注:与阳性药Vc比较,*P<0.01;与标准品比较,#P<0.05,##P<0.01;与提取物比较,△P<0.01。
Note:Compared with the positive drug Vc,*P<0.01;Compared with standard substance,#P<0.05,##P<0.01;Compared with extractive,△P<0.01.
3 结论
预试验中用萝卜水提液直接上样经过大孔树脂纯化,纯化后GRH纯度只能达到8.55%,而将水提液醇沉后GRH纯化效果明显提高,故采用醇沉后的萝卜提取液为上样药液。
本研究采用8种不同型号的大孔树脂对青萝卜中GRH进行纯化,从单因素考察和星点设计-效应面法试验结果来看,HPD-722型大孔树脂富集纯化GRH的效果最好。药物浓度是影响GRH比吸附量的主要因素,适宜的上样浓度有助于提高GRH的纯化效果;90%乙醇洗脱液虽然能提高GRH的洗脱率,但与70%乙醇相比提高的幅度不大,而过多的杂质直接影响GRH的纯度。本研究表明星点设计-效应面法用于优化大孔树脂纯化GRH工艺二次回归模型预测性好,纯化工艺参数准确可靠。最佳纯化工艺为:上样液pH5.3、上样流速 2.5 BV/h、上样药物浓度 0.53 mg/mL 、洗脱剂乙醇体积分数70%、洗脱液体积2.5 BV,洗脱流速1.5 BV/h,在此工艺条件下除去了萝卜提取物中的糖类、蛋白质等成分,GRH含量由4.041 mg/g增加到179.028 mg/g,提高了44.35倍。
体外抗氧化活性研究结果表明,GRH对DPPH自由基和ABTS+·自由基都有较好的清除效果,对比提取物、纯化物和纯品的IC50值,GRH的抗氧化活性明显,并且ABTS+·自由基的清除效果要优于DPPH自由基,这为进一步开发利用萝卜中的GRH提供了基础。此外HPD-722大孔树脂经过多次吸附-解吸,其纯化效果依然良好,说明大孔树脂纯化GRH方法简单可靠,成本低,有利于工业化生产。本研究可为从萝卜中大量提取GRH提供依据,更高纯度的GRH的纯化工艺还有待进一步研究。

