广东紫珠中的苯丙素类化合物及其抗菌活性
杨智颖,袁 欢,周 莹,林朝展,彭光天,吴爱芝*,祝晨蔯
1广州中医药大学中药学院;2广州中医药大学基础医学院,广州 510006
广东紫珠(CallicarpakwangtungensisChun.)为马鞭草科紫珠属(CallicarpaL.)落叶灌木,为该属代表性药用植物,主要分布在长江以南江西、广东、福建等地,在江西和湖南等地有广泛栽培[1]。目前广东紫珠已收录于2015版《中国药典》,药用部位为干燥的茎枝及叶,具有收敛止血、散瘀、清热解毒等功效,主要用于治疗偏头痛吐血跌肿痛和外伤出血。广东紫珠是“抗宫炎片”及“抗宫炎胶囊”的主要原料药,为民间临床妇科及各科出血症的常用药物。本课题组成员近几年来对紫珠属植物藤紫珠(C.peii)、枇杷叶紫珠(C.kochiana)、全缘叶紫珠(C.integerrima)、裸花紫珠(C.nudiflora)和长柄紫珠(C.longipes)的化学成分进行了较为系统地研究[2,3],发现苯丙素类成分在该属植物中含量尤为丰富,为该属植物中高极性部位的主要化学成分类型,目前文献报道的有30余种。现代药理研究表明,苯丙素类化合物具有抗氧化、抗炎、抑菌、止血等多种生物活性[4]。为了丰富广东紫珠中苯丙素类成分的化学结构类型并为其后续药理活性研究奠定丰富的物质基础,本文对广东紫珠甲醇提取物中的苯丙素类成分进行了分离鉴定研究,从中得到10个苯丙素类化合物分别鉴定为3-hydroxy-1-(4-hydroxy-3-methoxyphenyl)-2-[4-(3-hydroxy-1-(E)-propenyl)-2,6-dimethoxyphenoxy-propyl-β-D-glucopyranoside(1)、peiioside A(2)、syringalide A 3′-α-L-rhanmnopyranoside(3)、parvifloroside A(4)、 leucosceptoside B(5)、alyssonoside(6)、longissimoside B(7)、acteoside(8)、forsythoside B(9)和poliumoside(10)。其中,化合物1为首次从马鞭草科植物中分离得到,化合物4为首次从紫珠属中分离得到,化合物2、5、7均为首次从该植物中分离得到。这10个苯丙素类成分中化合物2~10结构类似,为苯丙烯酸类衍生物,而化合物1区别于其他9种化合物,其结构中含有未被苷化的苯丙烯醇结构单元,该结构在马鞭草科和紫珠属植物中的首次发现对从化学成分角度探讨广东紫珠在该科属中的植物化学分类具有指导意义。查阅文献发现有关广东紫珠抗菌活性研究鲜有报道,为了进一步挖掘广东紫珠在抗菌方面的药理活性,本课题组在系统分离广东紫珠中苯丙素类成分的基础上,选择其中含量较为丰富的化合物6、8、9和10进行抗菌活性研究,分别探讨这4个化合物对金黄色葡萄球菌、大肠杆菌和绿脓杆菌的抑制作用,以期为广东紫珠抗菌作用机制的深入研究和临床应用提供科学依据。
2 仪器与材料
DRX 400 型核磁共振仪(德国Bruker 公司);Triple TOF 5600质谱仪(美国AB Sciex公司);制备液相(北京慧德易科技有限责任公司);制备色谱柱(kromasil 100-5 C18柱,10 mm×250 mm,5 μm,瑞典);AB-8 型大孔树脂(天津南开大学化工厂);Diaion HP 20 型大孔树脂(日本三菱化学公司);Sephadex LH 20(GE Healthcare);YMC ODS-A-HG(北京慧德易科技有限责任公司);MCI gel CHP20/P1(日本三菱化学公司);金石蚕苷(成都普菲德生物科技有限公司,纯度>98%)、连翘酯苷 B和毛蕊花糖苷(从紫珠属植物藤紫珠中分离得到,纯度>98%)。金黄色葡萄球菌(Staphylococcusaureus),大肠杆菌(Escherichiacoli)和绿脓杆菌(Pseudomonasaeruginosa),均购于上海中科康泰生物有限公司。
实验所用广东紫珠栽培品于2016年购置于江西萍乡,经广州中医药大学中药鉴定学教研室彭光天讲师鉴定为马鞭草科紫珠属植物广东紫珠(C.kwangtungensis)的地上部分,自然晾干,剪切粉碎后粗粉备用。原植物凭证标本保存于广州中医药大学药用植物研究室。
2 提取与分离
将12 kg干燥广东紫珠枝和叶粉碎过40目筛,然后置于渗漉筒中用甲醇反复提取,提取液合并减压浓缩后得到浸膏1 kg。然后用适量蒸馏水溶解,再依次用石油醚、乙酸乙酯、正丁醇进行萃取,萃取液分别减压浓缩至干,得到石油醚部位85 g,乙酸乙酯部位108 g,正丁醇部位400 g,水部位260 g。
取正丁醇萃取物(390 g)经AB-8型大孔树脂柱层析,依次以0%、20%、40%、70%、100%甲醇梯度洗脱,TLC检测,合并相似流份,减压浓缩得到5个不同梯度甲醇洗脱组分Fr.1~Fr.5。Fr.2组分分别经MCI gel和Sephadex LH-20凝胶柱层析,以20%甲醇洗脱得到化合物2(160 mg)。Fr.3经Diaion HP-20型大孔树脂柱层析,分别以40%甲醇和60%甲醇洗脱得到Fr.3-1和Fr.3-2组分,Fr.3-1组分经Sephadex LH-20凝胶柱层析,以20%甲醇洗脱得到化合物3(57 mg)、化合物4(53 mg),化合物1(20 mg);Fr.3-2组分分别经Sephadex LH-20和RP-C18柱层析,以20%甲醇洗脱得到化合物6(359 mg)、化合物8(429 mg)、化合物9(1445 mg)、化合物10(516mg)。Fr.4经 Sephadex LH-20凝胶柱层析,以20%甲醇洗脱,后经高压制备液相,以乙腈:水(20∶80)洗脱,得到化合物5(25 mg) 和化合物7(50 mg)。
3 结构鉴定
化合物1浅黄色无定型粉末;10%的硫酸-乙醇显暗紫色,ESI-MS:m/z569[M+H]+;1H NMR (400 MHz,CD3OD)δ7.08(1H,d,J=2.0 Hz,H-2),6.92 (1H,dd,J=8.2,1.8 Hz,H-6),6.77 (2H,s,H-3′,5′),6.75 (1H,d,J=8.1 Hz,H-5),6.55 (1H,d,J=15.9 Hz,H-7′),6.33 (1H,dt,J=15.7,5.6 Hz,H-8′),5.14 (1H,d,J=6.6 Hz,H-7),4.59 (1H,d,J=7.6 Hz,H-1′′),4.29 (1H,dt,J=6.6,3.6 Hz,H-8),4.22 (2H,dd,J=5.6,1.5 Hz,H-9′),3.88 (6H,s,2′-OMe,6′-OMe),3.85 (3H,s,3-OMe),3.74 (1H,m,H-9a),3.60 (2H,dd,J=12.1,3.7 Hz,H-9b,6′′a),3.37(1H,m,H-5′′),3.32 (2H,m,H-2′′,4′′),3.20 (1H,m,H-6′′b),3.18 (1H,m,H-3′ );13C NMR (100 MHz,CD3OD)δ131.8 (C-1),112.6 (C-2),148.5 (C-3),147.2 (C-4),115.7 (C-5),121.3 (C-6),82.2 (C-7),87.0 (C-8),62.5 (C-9);136.0 (C-1′),154.5 (C-2′,6′),104.8 (C-3′,5′),135.0 (C-4′),131.2 (C-7′),130.0 (C-8′),63.6 (C-9′);105.2 (C-1′′),75.6 (C-2′′),78.0 (C-3′′),71.4 (C-4′′),77.8 (C-5′′),61.2 (C-6′′),56.7 (2′,6′-OMe),56.4 (3-OMe);上述数据与文献[5]基本一致,故鉴定化合物为3-hydroxy-1-(4-hydroxy-3-methoxyphenyl)-2-[4-(3-hydroxy-1-(E)-propenyl)-2,6-dimethoxyphenoxy]-propyl-β-D-glucopyranoside。
化合物2浅黄色无定型粉末;ESI-MS:m/z643[M+Na]+;1H NMR (400 MHz,CD3OD)δ7.58 (1H,d,J=15.6 Hz,H-7′),7.06 (1H,s,H-2),6.95 (1H,d,J=7.0 Hz,H-5),6.78 (1H,d,J=7.4 Hz,H-6),6.28 (1H,d,J=15.8 Hz,H-8′),1.06 (3H,s,Rha-CH3),4.60 (1H,d,J=7.7 Hz,H-1′′),5.16(1H,d,J=1.2 Hz,H-1′′′),1.06 (3H,d,J=5.6 Hz,H-6′′′),5.11 (1H,d,J=4.0 Hz,H-1′′′′);13C NMR (100 MHz,CD3OD)数据见表1。上述数据与文献[6]基本一致,故鉴定化合物为peiioside A。
化合物3浅黄色无定型粉末;10%的硫酸-乙醇显浅黄色,ESI-MS:m/z608[M+Li]+;1H NMR(400 MHz,CD3OD)δ7.60 (1H,d,J=15.7 Hz,H-7′), 7.07 (1H,d,J=2.0 Hz,H-6′),6.96 (2H,d,J=6.1 Hz,H-2,6),6.78 (2H,d,J=7.1 Hz,H-3,5), 6.70 (1H,d,J=8.0 Hz,H-2′),6.56 (1H,dd,J=8.0,2.0 Hz,H-3′), 6.29 (1H,d,J=14.8 Hz,H-8′),5.19 (1H,d,J=1.6 Hz,H-1′′′),4.63 (1H,d,J=6.8 Hz,H-1′′),1.15 (3H,d,J=6 Hz,H-6′′′);13C NMR (100 MHz,CD3OD ) 数据见表1。上述数据与文献[7]基本一致,故鉴定化合物为syringalide A 3′-α-L-rhanmnopyranoside。
化合物4浅黄色无定型粉末;10%的硫酸-乙醇显紫红色,ESI-MS:m/z623[M-H]-;1H NMR(400 MHz,CD3OD)δ7.55 (1H,d,J=15.6 Hz,H-7′),7.03 (1H,d,J=1.8 Hz,H-2′),6.88 (1H,dd,J=7.8,1.8 Hz,H-6′),6.77 (1H,d,J=1.8 Hz,H-2),6.69 (1H,d,J=7.8 Hz,H-5′),6.58 (1H,d,J=7.8Hz,H-5),6.52 (1H,dd,J=7.8,1.8 Hz,H-6),6.28 (1H,d,J=15.6 Hz,H-8′),5.18 (1H,brs,H-1′′′), 4.34 (1H,d,J=7.8 Hz,H-1′′), 3.92 (2H,m,H-8),2.76 (2H,m,H-7),1.25 (3H,d,J=5.1 Hz,H-6′′′);13C NMR (100 MHz,CD3OD) 数据见表1。 上述数据与文献[8]基本一致,故鉴定化合物为parvifloroside A。
化合物5浅黄色无定型粉末;10%的硫酸-乙醇显暗紫色,ESI-MS:m/z807[M+Na]+,783[M-H ]-;1H NMR (400 MHz,CD3OD)δ7.66 (1H,d,J=15.8 Hz,H-7′),7.20 (1H,brs,H-2′),7.08 (1H,d,J=8.2 Hz,H-6′),6.66 (1H,d,J=1.3 Hz,H-2),6.59 (1H,d,J=8.2 Hz,H-6),6.39 (1H,d,J=15.9 Hz,H-8′),5.19 (1H,brs,H-1′′′),4.95(1H,d,J=0.8 Hz,H-1′′′′),4.37 (1H,d,J=7.7 Hz,H-1′′),3.84 (3H,s,3′-OCH3),3.30 (3H,s,4-OCH3),2.86 (2H,t,J=6.7 Hz,H-7),1.09 (3H,d,J=6.0 Hz,H-6′′′);13C NMR (100 MHz,CD3OD) 数据见表1。上述数据与文献[9]基本一致,故将化合物鉴定为leucosceptoside B。

表1 化合物2~7的13C NMR 数据值(CD3OD)Table 1 13C NMR data of compounds 2-7 (CD3OD)
续表1(Continued Tab.1)
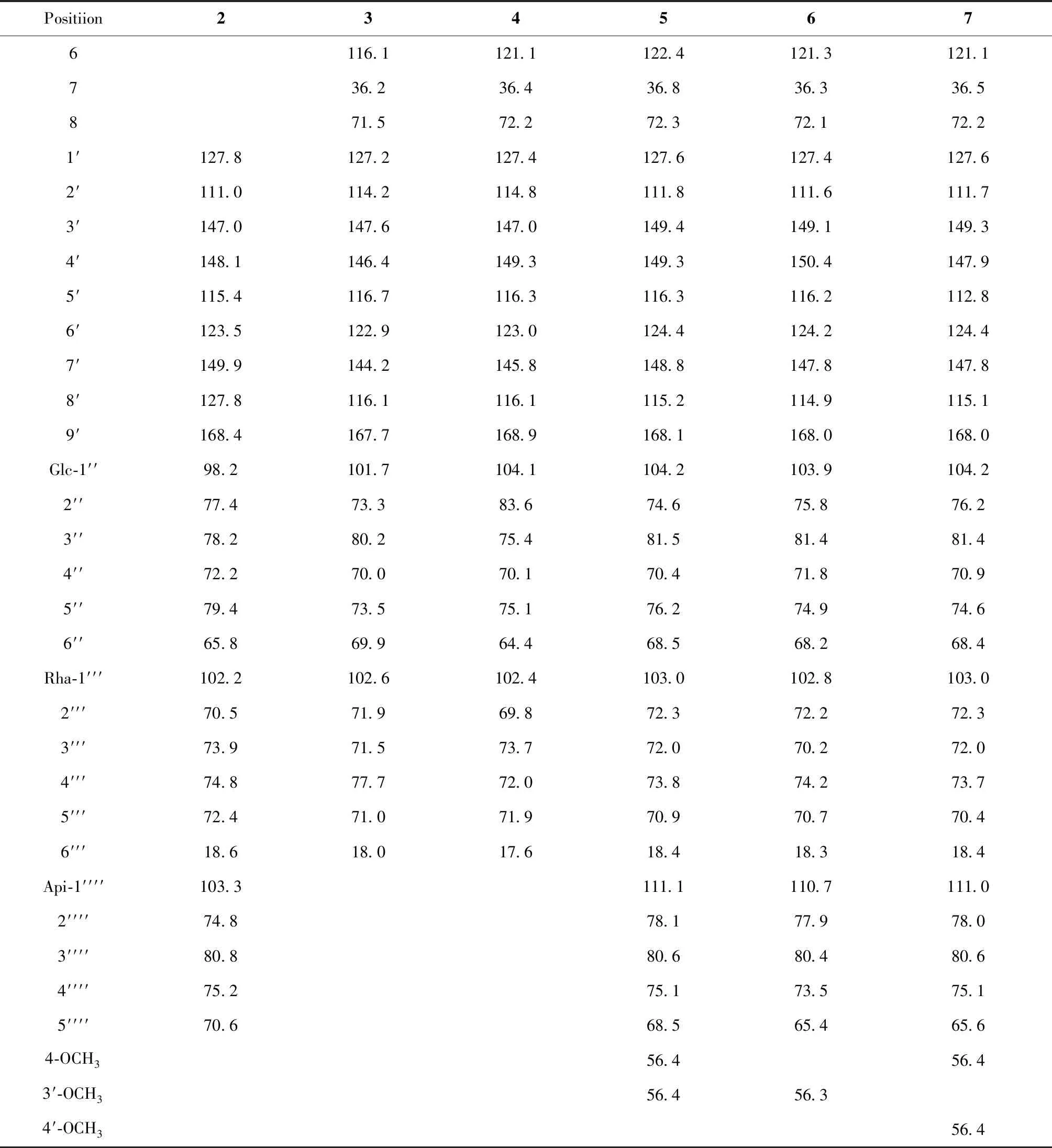
Positiion2345676116.1121.1122.4121.3121.1736.236.436.836.336.5871.572.272.372.172.21′127.8127.2127.4127.6127.4127.62′111.0114.2114.8111.8111.6111.73′147.0147.6147.0149.4149.1149.34′148.1146.4149.3149.3150.4147.95′115.4116.7116.3116.3116.2112.86′123.5122.9123.0124.4124.2124.47′149.9144.2145.8148.8147.8147.88′127.8116.1116.1115.2114.9115.19′168.4167.7168.9168.1168.0168.0Glc-1′′98.2101.7104.1104.2103.9104.22′′77.473.383.674.675.876.23′′78.280.275.481.581.481.44′′72.270.070.170.471.870.95′′79.473.575.176.274.974.66′′65.869.964.468.568.268.4Rha-1′′′102.2102.6102.4103.0102.8103.02′′′70.571.969.872.372.272.33′′′73.971.573.772.070.272.04′′′74.877.772.073.874.273.75′′′72.471.071.970.970.770.46′′′18.618.017.618.418.318.4Api-1′′′′103.3111.1110.7111.02′′′′74.878.177.978.03′′′′80.880.680.480.64′′′′75.275.173.575.15′′′′70.668.565.465.64-OCH356.456.43′-OCH356.456.34′-OCH356.4
化合物6浅黄色无定型粉末;10%的硫酸-乙醇显绿色,ESI-MS:m/z771[M+H]+;1H NMR (400 MHz,CD3OD)δ7.67 (1H,d,J=15.8 Hz,H-7′),7.19 (1H,s,H-2′),7.09 (1H,d,J=8.0 Hz,H-6′),6.83 (1H,d,J=7.7 Hz,H-6),6.71 (1H, s,H-2),6.58 (1H,d,J=7.8 Hz,H-5),6.71 (1H,d,J=7.8 Hz,H-5′), 6.39 (1H,d,J=15.8 Hz,H-8′), 5.20 (1H,s,H-1′′′), 4.93 (1H,d,J=4.0 Hz,H-1′′′′),4.37 (1H,d,J=7.6 Hz,H-1′′),3.70~4.04 (1H,m,H-8),2.79 (1H,t,H-7),1.10 (3H,d,J=2.6 Hz,H-6′′′);13C NMR (100 MHz,CD3OD) 数据见表1。上述数据与文献[10]基本一致,故鉴定化合物为alyssonoside。
化合物7浅黄色无定型粉末;10%的硫酸-乙醇显暗紫色,ESI-MS:m/z807[M+Na]+,783[M-H ]-;1H NMR (400 MHz,CD3OD)δ7.67 (1H,d,J=15.8 Hz,H-7′),7.22 (1H,d,J=1.9 Hz,H-2′),7.10 (1H,d,J=8.2 Hz,H-6′),6.84 (1H,d,J=8.2 Hz,H-5′),6.84 (1H,d,J=8.2 Hz,H-5),6.75 (1H,d,J=1.7 Hz,H-2),6.71 (1H,dd,J=8.1,1.8 Hz,H-6),6.38 (1H,d,J=15.9 Hz,H-8′),5.20 (1H,brs,H-1′′′′),4.38 (1H,d,J=7.7 Hz,H-1′′),3.90 (3H,s,4′-OCH3),3.83 (3H,s,4-OCH3),2.86 (2H,t,J=6.7 Hz,H-7),1.09 (3H,d,J=6.0 Hz,H-6′′′);13C NMR (100 MHz,CD3OD) 数据见表1。上述数据与文献[11]基本一致,故将化合物鉴定为longissimoside B。
化合物8、9、10均为浅黄色无定型粉末,ESI-MS:m/z623[M-H]-,m/z755[M-H]-,m/z793[M+Na]+,分别与对照品对照,依次确定化合物8为acteoside(毛蕊花糖苷),化合物9为forsythoside B(连翘酯苷B),化合物10为poliumoside(金石蚕苷)。
4 抑菌活性测试
选择广东紫珠中含量较为丰富的4种苯丙素类化合物6、8、9和10,分别用 DMSO溶解配制成20和10 mg/mL 的溶液,DMSO作为空白对照,左氧氟沙星(50 μg/mL)作为阳性对照,采用纸片扩散法[12],分别吸取各溶液10 μL置于经高压灭菌后的无菌滤纸片上,放于烘箱烘干。取生长于普通营养琼脂斜面上的三种试验菌,制成菌悬液,浓度稀释为1.0×106CFU/mL。取菌悬液各0.2 mL于培养基上,用涂布棒将菌液涂布均匀。用镊子将含药纸片贴于含有不同菌种的培养基平板上,置于37 ℃恒温培养箱中倒置培养24 h,观察抑菌圈大小,每个浓度重复三次。分别测试4种苯丙素类化合物对金黄色葡萄球菌、大肠杆菌和绿脓杆菌的抑制作用,结果见表 2。与空白组菌圈直径6 mm对比可知,这4种苯丙素类化合物在相应浓度下对所试菌类均具有不同程度的抑制作用,且抑菌效果呈量效关系。其中,化合物6的抑菌能力略优于其他3种化合物,推测该化合物中苯丙烯酸4位酚羟基的甲氧基化对抑菌活性具有增效作用。

表2 苯丙素类化合物的抑菌活性(mm)Table 2 Antibacterial activity of four phenylpropanoid compounds (mm)
注:数据用均数±SD标准差表示(n=3)。
Note:Data are expressed as mean±SD (n=3).
5 结果与讨论
从广东紫珠地上部分醇提物中分离并鉴定得到10个苯丙素类成分,其中化合物1为单糖苷,化合物3、4和8为二糖苷,化合物2、5、6、7、9和10为三糖苷。系统化学成分分离结果表明苯丙素类成分具有良好的水溶性,主要分布在广东紫珠中高级性部位。从化学结构分析,化合物1显著区别于化合物2~10,其结构中含有未被苷化的苯丙烯醇结构单元,该化合物为马鞭草科植物中首次发现,研究结果为从植物化学角度探讨苯丙素类成分在科、属、种的分布规律和生合成途径提供了重要的指导意义。在化学成分分离的基础上,选择广东紫珠中含量较高的苯丙素类化合物6、8、9和10进行抑菌活性测试,发现这4种化合物对金黄色葡萄球菌、大肠杆菌和绿脓杆菌均具有不同程度的抑制活性,且具有量效关系,其中化合物6的抑菌活性与其它3种化合物相比效果最佳。上述研究为广东紫珠在抗菌活性方面的进一步开发利用和临床应用提供了科学依据。

