羊口疮病毒ORF080基因的原核表达、纯化及鉴定
陈珍珍, 曾显成, 池雪林, 白丁平, 刘云辉, 胡可慧, 罗树红, 黄小红
(1.福建农林大学中西兽医结合与动物保健福建省高校重点实验室,福建 福州 350002;2.佛山科学技术学院口腔医学院,广东 佛山 528000)
羊口疮是由羊口疮病毒(orf virus, ORFV)引起绵羊和山羊等小反刍动物的一种急性、接触性传染病[1],被感染羊在口、唇、鼻、眼睑、乳房和肛门等处的皮肤和黏膜形成小泡、丘疹、脓疮、溃烂、增生性结节[2-3],症状持续3~4周[4],通常发病率高、死亡率低.但如果病毒同时混合感染了葡萄球菌、链球菌或棒状杆菌等细菌,死亡率则接近90%[5-6],且易反复感染,即使接种过疫苗也可再次感染.近年来随着我国养羊业的发展,该病在一些省市都有不同程度的流行[7-9].用于预防该病的疫苗主要是弱毒疫苗,接种麻烦,且存在安全性不好、毒力返强、免疫期短、不能区分野毒感染等缺点,疫苗接种并未得到普及.
ORFV属痘病毒科(Poxviridae)副痘病毒属(Parapoxvirus),是基因组全长约为138 kb的双股DNA病毒[10],G+C的含量高达64%[11],编码区分为中心保守区(ORF009~111)和两端变异区(ORF001~008、ORF112~134).中心保守区的大部分基因对于病毒复制、组装、释放及病毒形态的形成非常重要,而位于病毒末端区域的基因与病毒毒力、致病性有关[12].ORFVORF080基因全长900 bp,编码大小为33 ku的蛋白.序列比对显示,ORF080是痘苗病毒(VACV)A4L的同源蛋白,该蛋白在病毒感染的晚期合成,研究表明其是未成熟粒子形成有感染性的成熟病毒粒子所必须的蛋白[13-14].在ORFV基因组序列分析中发现,ORF080是基因组中部序列中变异较大的基因,进一步对这个基因进行选择压力分析显示,山羊来源的ORFV基因在比较位点100的位置上含有正选择位点[10],也是ORFV基因组编码的132个基因中唯一含有正选择位点的基因.现在公认正选择压力是蛋白质进化的一个重要驱动力,提示ORF080具有重要的功能.本试验原核表达、纯化ORFV ORF080蛋白,并对表达的蛋白进行反应性分析,旨在为进一步对ORF080蛋白结构、功能及基因工程疫苗的研究提供参考.
1 材料与方法
1.1 载体、菌株与试剂
pET-32a(+)表达载体、DH5a感受态细胞和Rossetta感受态细胞购于厦门泰京生物有限公司;EX Taq酶、T4DNA连接酶、限制性内切酶(EcoRⅠ、HindⅢ)和DNA分子质量标准购于宝生物工程(大连)有限公司;SDS-PAGE凝胶配制试剂盒购于碧云天生物技术公司;组氨酸标签蛋白琼脂糖纯化树脂购于上海翊圣生物科技有限公司;辣根过氧化物酶标记的羊抗小鼠IgG和兔抗山羊IgG购于武汉博士德生物技术有限公司;羊口疮特异性阳性羊血清由本实验室保存;其他试剂均为国产分析纯.
1.2 ORF080基因序列密码子的优化
根据NCBI中GenBank已发表的ORFV OV-GO株ORF080基因序列(登录号:KP010354),委托福州尚亚生物技术有限公司进行大肠杆菌密码子的优化并合成目的基因.
1.3 pET-32a(+)-ORF080表达载体的构建
将合成的ORFV080基因序列克隆至pET-32a(+)表达载体,用EcoRⅠ和HindⅢ酶切鉴定重组质粒.
1.4 重组质粒的转化
将pET-32a(+)-ORF080重组表达载体和pET-32a(+)空载体分别转化到大肠杆菌Rossetta感受态细胞中,涂板,挑取单个菌落接种到含氨苄青霉素(终浓度为100 μg·mL-1)的LB肉汤中扩大培养,取菌液进行PCR反应,用1.0%琼脂糖凝胶进行电泳检测.
1.5 重组表达菌的诱导表达及可溶性检测
将转化结果为阳性的菌液,按1∶100的比例稀释后接种到200 mL含氨苄青霉素的LB肉汤中,于210 r·min-1、37 ℃培养至D450 nm为0.6~0.8时,取30 mL做诱导前的对照,在剩下的菌液中加入终浓度为0.25 mmol·L-1的IPTG诱导表达蛋白,在210 r·min-1、16 ℃下诱导表达10 h,于12 000 r·min-1离心10 min,用PBS洗3次,再加入适量的PBS重悬沉淀.取出一定量诱导后的pET-32a(+)-ORF080菌体,在冰浴条件下超声裂解(超声4 s,停止4 s),直至裂解液变得澄清,于12 000 r·min-1、4 ℃离心10 min.将上清吸出,同时用等体积的PBS重悬沉淀.与此同时,将Rossetta感受态细胞接种在普通琼脂平板上,于37 ℃过夜培养,挑取单个菌落接种到LB肉汤中培养8 h,于12 000 r·min-1离心10 min,用PBS洗3次,取PBS重悬沉淀作为阴性对照.将上述样品进行SDS-PAGE检测.
1.6 重组蛋白的纯化
将上述得到的澄清蛋白液加入到镍柱填料中(重复5次),收集流穿液;用500 mL 30 mmol·L-1咪唑洗脱液(pH=8)洗脱杂蛋白,收集洗涤液,直至G250液不变色;用300 mmol·L-1咪唑分段洗脱目的蛋白,并收集洗脱液,用SDS-PAGE检测收集液.将纯化后的蛋白用PBS(pH=8)透析24 h,在第3、8和14小时更换透析液,透析后用聚乙二醇6 000浓缩蛋白,并进行SDS-PAGE检测.
1.7 重组蛋白的免疫印迹鉴定
将经过SDS-PAGE检测的蛋白条带转至硝酸纤维薄膜(NC膜)上,加入5%脱脂奶于4 ℃封闭过夜,用TBST洗3次,每次10 min.一抗分别为1∶5 000倍稀释的组氨酸标签蛋白的抗体和1∶400倍稀释的羊口疮特异性阳性羊血清,于37 ℃孵育1 h,用TBST洗3次.二抗为1∶10 000倍稀释的辣根过氧化物酶标记的羊抗小鼠IgG和兔抗山羊IgG抗体,于37 ℃孵育1 h,用TBST洗3次,用化学发光液显色,拍照.
2 结果与分析
2.1 pET-32a(+)-ORF080重组原核表达载体的鉴定
采用限制性内切酶(EcoRⅠ、HindⅢ)双酶切构建的表达载体经1.0%琼脂糖凝胶电泳,获得了约5 900 bp的载体质粒和915 bp的目的基因条带(图1),成功构建了pET-32a(+)-ORF080原核表达载体.
2.2 重组表达菌的鉴定
挑取转化到Rossetta感受态细胞中的pET-32a(+)-ORF080重组表达载体和pET-32a(+)空载体的菌液,PCR检测结果显示,pET-32a(+)-ORF080重组质粒和pET-32a(+)空载体分别在约1 594 bp和712 bp处出现特异性条带(图2),表明pET-32a(+)-ORF080重组质粒成功转化到Rossetta感受态细胞中.

M:DNA分子质量标准;1:pET-32a(+)-ORF080重组质粒;
2:pET-32a(+)-ORF080重组质粒双酶切产物.
图1 pET-32a(+)-ORF080重组质粒双酶切产物
Fig.1 Double enzyme digestion of the recombinant plasmid
pET-32a(+)-ORF080 byEcoRⅠ,HindⅢ
M:DNA分子质量标准;1~3:pET-32a(+)-ORF080
重组质粒;4:pET-32a(+)空载体.
图2 pET-32a-ORF080重组质粒的转化
Fig.2 Transformation of the recombinant plasmid
pET-32a(+)-ORF080
2.3 重组表达菌的诱导表达及ORF080蛋白的可溶性检测
采用SDS-PAGE检测未诱导的pET-32a(+)-ORF080、诱导的pET-32a(+)-ORF080重组菌,以及阴性对照pET-32a(+)空载体和Rossetta空载体等样品.结果(图3)显示,ORF080重组蛋白获得表达,相对分子质量约为57 ku,在超声裂解液的上清和沉淀中均存在,说明表达的pET-32a(+)-ORF080以可溶性和包涵体两种形式存在,重组蛋白的可溶性表达有利于后续的纯化.而未诱导的pET-32a(+)-ORF080无相应条带,诱导后的pET-32a(+)空载体未见重组蛋白的表达,只有组氨酸标签表达的蛋白(大小约26 ku).
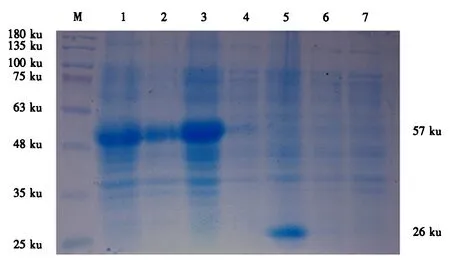
M:蛋白质分子质量标准;1:诱导的pET-32a(+)-ORF080菌液上清;2:诱导的pET-32a(+)-ORF080菌液沉淀;3:诱导的pET-32a(+)-ORF080菌液;4:未诱导的pET-32a(+)-ORF080菌液;5:诱导的pET-32a(+)菌液;6:未诱导的pET-32a(+)菌液;7:Rossetta菌液.图3 重组蛋白ORF080的表达及可溶性检测Fig.3 Expression and solubility analysis of the recombinant protein ORF080
2.4 ORF080蛋白的纯化
表达的ORF080可溶性蛋白用镍柱纯化,SDS-PAGE检测流穿液、洗涤液和洗脱液中的蛋白,结果(图4A)显示,在洗脱液中得到纯度较高的可溶性ORF080蛋白.纯化后的ORF080蛋白进一步经过透析及浓缩之后,可以得到纯度更高、浓度更大的蛋白(图4B),浓缩的纯蛋白有利于长期保存和后续研究.
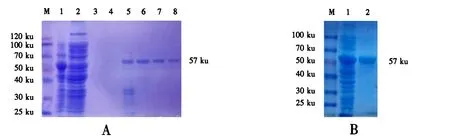
M:蛋白质分子质量标准;1:纯化前的裂解菌上清;
2:流穿液;3~4:洗涤液;5~8:洗脱液.
M:蛋白质分子质量标准;1:纯化前的
裂解菌上清;2:纯化后的蛋白.
图4 ORF080融合蛋白的纯化
Fig.4 Purification of ORF080 fusion protein
2.5 ORF080蛋白的免疫印迹鉴定
ORF080蛋白经SDS-PAGE电泳后转到NC膜上,与一抗(组氨酸标签蛋白的抗体和羊口疮特异性阳性羊血清)、二抗(羊抗小鼠IgG和兔抗山羊IgG)进行蛋白质免疫印迹鉴定.结果(图5)显示,在57 ku处均出现特异性的蛋白印迹条带,进一步证实成功表达pET-32a(+)-ORF080重组蛋白,且该蛋白能够与山羊羊口疮阳性血清反应,具有良好的反应性.

A:组氨酸标签蛋白(M:蛋白质分子质量标准;1~2:ORF080蛋白);B:羊口疮特异性阳性羊血清(M:蛋白质分子质量标准;1~2:ORF080蛋白).图5 ORF080重组蛋白的免疫印迹鉴定Fig.5 Identification of the recombinant protein of ORF080 by Western blot
3 讨论
目前对ORFV基因研究较多的是ORF011和ORF059基因,而对ORF080基因的研究较少,其编码蛋白的结构与功能尚不清楚,在病毒的致病过程中发挥的作用也不明确.序列比对显示,ORF080基因与痘苗病毒的A4L基因具有较高的同源性,而后者经研究证实其编码强免疫蛋白,且与病毒核心蛋白p4a/4a相互作用,参与病毒粒子的装配过程[15].ORF080蛋白是否也能发挥与A4L蛋白相同的功能还需深入研究,而对 ORF080结构和功能的进一步研究都需要高效表达纯化该蛋白.
本试验根据密码子的偏好性对ORFVORF080基因进行优化,构建到带有组氨酸标签蛋白和氨苄青霉素(Amp)抗性基因的pET-32a(+)表达载体中,将重组质粒转化到Rossetta感受态细胞中进行诱导表达.在表达过程中对诱导温度、时间和IPTG浓度等条件进行优化,最终确定最佳的诱导条件为:IPTG浓度0.25 mmol·L-1,于210 r·min-1、16 ℃诱导表达10 h.对诱导后的蛋白进行可溶性检测,发现ORF080蛋白存在可溶性和包涵体两种形式.陈慧芹等[16]用pET-28a(+)表达载体表达出ORFV119蛋白,也检测到可溶性和包涵体的两种蛋白.采用镍柱纯化蛋白时将流穿液、洗涤液和洗脱液逐一收集,并结合SDS-PAGE的方法收集目的蛋白,该方法特异性较高.Zhao et al[17]利用真核表达系统表达出ORF011和ORF059蛋白,真核表达系统可以对蛋白进行空间结构的修饰,使表达出的蛋白具有更好的生物活性.本试验检测到ORF080可溶性蛋白所占的比重较大,可以直接收集表达菌上清用于后续试验,不需要对包涵体蛋白进行变性和复性.原核表达的ORF080蛋白可以与山羊羊口疮阳性血清发生反应,表明其具有良好的反应性.本试验结果可为ORF080蛋白结构和功能的进一步研究提供参考.
4 结论
本试验成功构建了pET-32a(+)-ORF080原核表达质粒,并在大肠杆菌Rossetta感受态细胞中高效表达,ORF080蛋白同时以可溶性和包涵体的形式存在.蛋白质免疫印迹鉴定显示,表达的ORF080蛋白具有良好的反应性.

