7种药剂对番茄灰霉病菌的室内毒力测定及盆栽防效比较
张庆萍,毕采利,龚 静,赵存虎,王 辉
(1.内蒙古自治区农牧业科学院植物保护研究所,内蒙古呼和浩特 010031;2.内蒙古农业大学园艺与植物保护学院,内蒙古 呼和浩特 010019;3.丰镇市农业局 推广站,内蒙古 丰镇 012100)
随着保护地番茄栽培面积的不断扩大,番茄的各种病害也在逐年增加,已成为番茄生产中的一大障碍。其中由灰葡萄孢菌引起的番茄灰霉病为当前番茄生产上的重要病害,已在全国各地普遍发生,并造成严重减产减收。一般发病田块番茄灰霉病造成的产量损失为20%~40%,重田块达到60%以上[1]。番茄灰霉病是由半知菌亚门丝孢目灰葡萄孢菌侵染引起的一种发生较为普遍的世界性病害,番茄灰霉病病菌主要以菌丝体及分生孢子在病残体内或以菌核在土壤中越冬或越夏。在适合的条件下,由菌核萌发产生的分生孢子,通过雨水、气流、露水及农事操作等进行散播,从花器或伤口侵入,之后进行再侵染。发病的主要因素为低温高湿,病菌最适温度为18~23 ℃。当温度约20 ℃,相对湿度持续90% 以上时,病害严重,发病后传播速度快,严重影响绿色食品设施番茄的产量和品质,给农民造成巨大的经济损失[2-3]。
目前,在生产上防治灰霉病主要依靠化学杀菌剂,而化学杀菌剂特别是内吸性杀菌剂的长期使用,极易使灰葡萄孢菌产生抗药性,失去防治效果。因此,需要对常用化学杀菌剂进行室内毒力测定,不断筛选出新的替代杀菌剂,以满足农业生产的需要。生物杀菌剂的广泛应用,已成为病虫害防治的重要组成部分之一,越来越引人注目。因此,本研究通过室内毒力测定,筛选出新的可替代的化学和生物杀菌剂,为番茄灰霉病提供更多有效安全的药剂防治依据。
1 材料和方法
1.1 供试材料
菌株由内蒙古农业大学提供,番茄品种CM966。
1.2 供试药剂
5 种化学杀菌剂:50%啶酰菌胺水分散粒剂(巴斯夫欧洲公司)、500 g/L 异菌脲悬浮剂(江苏省苏州富美实植物保护有限公司)、50%乙霉多菌灵可湿性粉剂(江苏蓝丰生物化工股份有限公司)、50%腐霉利可湿性粉剂(日本住友化学株式会社)、40%嘧霉胺悬浮剂(陕西恒田化工有限公司);2 种生物杀菌剂:3×108CFU/g 哈茨木霉菌可湿性粉剂(美国拜沃股份有限公司)、3×109CFU/g 甲基营养型芽孢杆菌可湿性粉剂(华北制药集团爱诺有限公司)。
1.3 供试培养基
马铃薯葡萄糖琼脂培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL。
1.4 菌落直径法测定药剂对番茄灰霉病菌的抑菌效果
为了准确测定供试7 种药剂对灰霉病菌的室内毒力测定,保证药剂在稀释过程中分布均匀,以达到更好的悬浮效果,减少试验误差,将5 种供试化学杀菌剂先配成母液,之后稀释成5 个系列有效成分含量。将PDA 培养基灭菌并冷却至50 ℃左右,与配好的5 个系列有效浓度药剂按体积比9∶1 混合,制成5 个系列浓度、直径9 cm 的含药平板,以不加药剂的处理为对照,在每个培养基表面放入1 个直径5 mm 的供试病原真菌菌饼,置于20 ℃培养箱中培养,每处理重复3 次[4]。
将2 种生物杀菌剂分别做如下处理:(1)哈茨木霉菌生物杀菌剂制成悬浮液涂布于PDA 平板上进行培养,取恒温(25 ℃)培养7 d 的产孢哈茨木霉菌,用10 mL 无菌水将哈茨木霉菌孢子冲下后依次制成999,855,750,666,600 μg/mL 的孢子悬浮液。用移液枪吸取孢悬液加入已灭菌的培养基中(孢子液∶培养基=1∶9 体积比)制成含哈茨木霉菌PDA 平板,然后用打孔器打取灰霉病菌菌饼(直径5 mm)接入含哈茨木霉菌孢子的PDA 平板上,试验重复3 次。在25 ℃恒温培养箱中培养2 d,采用十字交叉法测量番茄灰霉病菌的菌落生长直径,取其平均值,计算菌丝生长相对抑制率;(2)甲基营养型芽孢杆菌生物杀菌剂制成悬浮液后涂布于LB 培养基上进行培养,培养3 d 后将其接种于装有50 mL LB 液体培养基的三角瓶中,30 ℃、220 r/min 振荡培养48 h。 收集发酵液,离心(10 000 r/min,4 ℃),将上清液用0.22 μm 滤膜过滤除菌即可得到无菌发酵液,在无菌条件下,用融化的PDA 培养基依次配制成含666,300,186,50,18 μg/mL 发酵液的平板培养基,以不加发酵液的培养基为对照,在每个培养基表面放入1 个直径5 mm 的供试病原真菌菌饼,每个处理3 次重复,28 ℃恒温培养3~4 d 后,十字交叉法测量菌落直径,计算菌丝生长相对抑制率。
将7 种供试药剂按如下有效成分含量进行室内毒力测定:(1)哈茨木霉菌:999,855,750,666,600 μg/mL;(2)甲基营养型芽孢杆菌:666,300,186,50,18 μg/mL;(3)啶酰菌胺:555,500,415,385,335 μg/mL;(4)异菌脲:1 110,1 000,905,835,770 μg/mL;(5)乙霉多菌灵:1 665,1 430,1 250,1 110,1 000 μg/mL;(6)腐霉利:715,665,625,590,555 μg/mL;(7) 嘧霉胺:832,768,716,668,624 μg/mL。培养3~5 d 后采用十字交叉法测定菌落直径并记录。根据以下公式计算7 种药剂对菌丝生长的相对抑菌率、抑菌率几率值、毒力回归方程以及EC50值。


1.5 盆栽试验
通过室内毒力测定,筛选出5 种化学杀菌剂及2 种生物菌剂最佳用药浓度,即啶酰菌胺、异菌脲、乙霉多菌灵、腐霉利、嘧霉胺的有效成分含量分别为555,1 110,1 665,715,832 μg/mL;2 种生物杀菌剂哈茨木霉菌、甲基营养型芽孢杆菌的有效浓度分别为999,666 μg/mL。7 种药剂分别以此有效成分含量进行盆栽试验,每盆种植2 株幼苗,重复3 盆。将培养好的培养皿中的灰霉病菌用打孔器打出相同面积的菌片,将菌片接种到番茄叶片上,前12 h 暗培养,湿度保持在95%以上,然后置于光照和黑暗各12 h的20 ℃,湿度在90%以上的条件下进行培养[5],生物杀菌剂在接菌之前进行喷施,其余药剂在番茄叶片发病初期进行喷施,每隔5 d 调查病叶数。
2 结果与分析
2.1 7 种药剂对番茄灰霉病的抑菌率及抑菌率几率值
由表1可知,哈茨木霉菌、啶酰菌胺、甲基营养型芽孢杆菌、异菌脲、乙霉多菌灵、腐霉利、嘧霉胺在处理有效浓度为18~1 665 μg/mL 时,5 种化学杀菌剂啶酰菌胺、异菌脲、乙霉多菌灵、腐霉利、嘧霉胺对灰霉病菌的相对抑菌率分别为73.03%~84.21%,67.76%~73.68%,82.24%~88.16%,20.39%~25.66%,70.39%~83.55%;其抑菌率几率值分别为:5.61~6.00,5.46~5.63,5.92~6.18,4.17~4.35,5.54~5.98。2 种生物杀菌剂对灰霉病菌的相对抑菌率分别为:76.84%~83.55%,30.26%~71.05%;其抑菌率几率值分别为:5.73~5.98,4.48~5.55(表1)。
2.2 7 种药剂对番茄灰霉病的EC50 值比较
药剂EC50值大小是衡量药剂毒力大小的重要指标,EC50值越小表明该药剂的毒力越强[6-8]。由表2可知,7 种药剂哈茨木霉菌、甲基营养型芽孢杆菌、啶酰菌胺、异菌脲、乙霉多菌灵、腐霉利、嘧霉胺的EC50值大小分别为139.77,140.02,155.96,280.54,139.64,1 815.92,452.90 μg/mL。因此,从EC50值的角度进行比较,在5 种化学杀菌剂中,杀菌毒力强弱依次为乙霉多菌灵>啶酰菌胺>异菌脲>嘧霉胺>腐霉利;2 种生物杀菌剂中,杀菌毒力强弱为哈茨木霉菌>甲基营养型芽孢杆菌。
2.3 调查盆栽叶片发病率
待番茄植株生长5 d 后开始调查并记录番茄叶片发病数,每隔5 d 调查1 次,共调查3 次。第1 次调查2 种生物杀菌剂哈茨木霉菌、甲基营养型芽孢杆菌的叶片发病率分别为5.37%,5.32%;5 种化学杀菌剂啶酰菌胺、异菌脲、腐霉利、嘧霉胺、乙霉多菌灵的叶片发病率分别为4.19%,7.47%,10.24%,9.45%,4.21%;第2 次调查2 种生物杀菌剂哈茨木霉菌、甲基营养型芽孢杆菌的叶片发病率分别为7.43%,7.98%;5 种化学杀菌剂啶酰菌胺、异菌脲、腐霉利、嘧霉胺、乙霉多菌灵叶片发病率分别为5.34%,10.37%,20.14%,19.40%,6.13%;第3 次调查2 种生物杀菌剂哈茨木霉菌、甲基营养型芽孢杆菌的叶片发病率分别为7.82%,8.33%;5 种化学杀菌剂啶酰菌胺、异菌脲、腐霉利、嘧霉胺、乙霉多菌灵发病率分别为5.70%,12.40%,25.17%,20.30%,6.87%。由图1可知,用菌饼方式接菌时,2 种生物杀菌剂对番茄灰霉病的抑制强弱的趋势为哈茨木霉菌>甲基营养型芽孢杆菌;5 种化学杀菌剂对番茄灰霉病的抑制强弱的趋势为啶酰菌胺>乙霉多菌灵>异菌脲>嘧霉胺>腐霉利。
3 讨论与结论
就化学杀菌剂而言,啶酰菌胺、乙霉多菌灵、异菌脲在试验中表现出了较稳定且较强的毒力,可在生产中推广使用。尤其是啶酰菌胺与乙霉多菌灵,对灰霉病病菌菌丝生长的抑制作用明显高于其他药剂,并且啶酰菌胺兼具保护和治疗作用,两种药剂均适合在灰霉病发生前或发生初期施用,可广泛地用于生产实际中。鉴于杀菌剂连续施用容易使病原菌产生抗药性,如腐霉利、嘧霉胺为近年常用农药,在生产上也发现已经有了一定的抗性,因此,在实际应用中应该尽可能选择作用机制不同的多种药剂交替使用,避免连续施用,同时应开发新型复配菌剂,来延缓病原菌抗药性的产生[9-13],例如供试药剂乙霉多菌灵,结合有效的生物菌剂的使用,使番茄灰霉病得到有效控制。关于生物制剂和化学杀菌剂联用对葡萄灰霉病的防效是否具有协同效应,以及复配制剂对植物病害是否具有抑制作用等还需进一步试验验证。

表1 7 种药剂对番茄灰霉病的抑菌率及抑菌率几率值
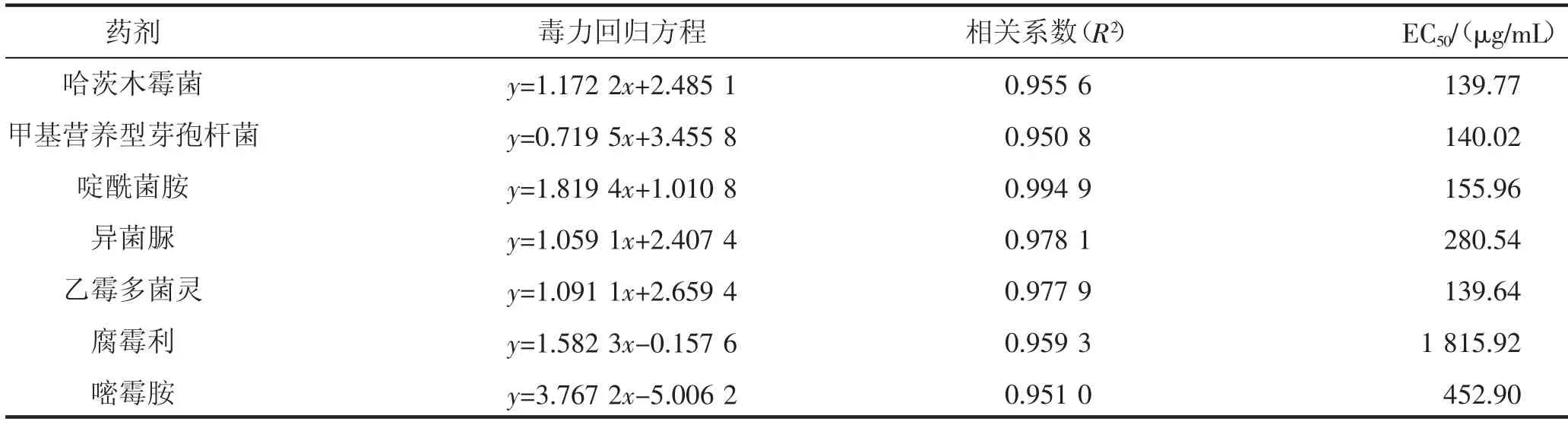
表2 7 种药剂对番茄灰霉病菌的毒力回归方程及EC50 值

图1 盆栽叶片发病率3 次调查结果的比较
就生物杀菌剂而言,通过室内毒力测定,哈茨木霉菌对番茄灰霉病菌的抑菌效果好于甲基营养型芽孢杆菌,在盆栽防效试验过程中,2 种生物杀菌剂都表现较好的抑菌效果。哈茨木霉菌对番茄灰霉病菌的抑菌效果优于甲基营养型芽孢杆菌。但生物杀菌剂一定要在即将发病前使用,适用于保护地防治番茄灰霉病。生物杀菌剂的开发利用对于保护地番茄灰霉病的有效健康防治具有重要意义[14-16]。
5 种化学杀菌剂中,乙霉多菌灵与啶酰菌胺对灰霉病菌抑菌效果最好,EC50值分别为139.64,155.96 μg/mL 时番茄灰霉病菌对其表现敏感;2 种生物杀菌剂中,3×108CFU/g 哈茨木霉菌对灰霉病菌抑菌效果较好,EC50值为139.77 μg/mL 时番茄灰霉病菌对其表现敏感。本研究选用室内毒力测定法与盆栽防效试验方法相结合并相互比较的方法同时研究了7 种供试药剂对番茄灰霉病的抑制作用。盆栽防效试验比较接近生产实际,其结果对实际应用更有指导意义。

