GMA诱导16HBE细胞恶性转化过程中LINC00472的表达及其意义
谢广云,郭浩然,王全凯 ,马顺鹏,宋佳阳,乌瀚宝栎尔,许建宁,*
(1.中国疾病预防控制中心职业卫生与中毒控制所,北京 100050;2.江阴市疾病预防控制中心,江苏 无锡 214434;3.中国疾病预防控制中心化学污染与健康安全重点实验室,北京 100050)
长链非编码RNA(long non-coding RNA,LncRNA)LINC00472位于人类染色体6q13基因间区,又叫做P53相关LncRNA(P53 related LncRNA,P53RRA)。研究发现,LINC00472的表达水平与乳腺癌、上皮性卵巢癌的发生发展密切相关,其中LINC00472高表达乳腺癌患者的治疗效果和生存时间都要优于低表达的患者[1-2]。而LINC00472在细胞恶性转化过程中的表达变化情况及作用机制未见报道。
甲基丙烯酸环氧丙酯(glycidyl methacrylate,GMA),又称甲基丙烯酸缩水甘油酯,主要用于高分子材料(树脂、涂料、胶黏剂、活性稀释剂等)的加工与合成,具有良好的防紫外线、耐水和耐热等特性[3-4]。本课题组研究发现,GMA具有致癌危险性,可诱发BALB/C 3T3细胞、SHE细胞、KMB-13细胞、16HBE细胞等不同类型的细胞发生恶性转化[5]。
本研究采用LncRNA芯片分析技术,筛选出在GMA诱导的人支气管上皮细胞恶性转化的前、中、后期差异表达的LncRNA——LINC00472,通过生物信息学手段寻找其可能作用的靶基因,实时荧光定量PCR(qPCR)验证LINC00472及其靶基因的表达水平,探讨其在细胞恶性转化过程的表达特点及意义。
1 材料与方法
1.1 试剂和仪器
甲基丙烯酸缩水甘油酯(纯度≥98.5%),购于美国陶氏化学公司;二甲基亚砜(DMSO),购于Sigma公司;胰蛋白酶、EDTANa2,均购于美国Amresco公司;MEM培养基粉,购于美国Hyclone公司;标准胎牛血清(FBS),购于天津灏洋生物制品公司;青链霉素混合液(100×),购于北京索莱宝科技有限公司;Trizol试剂,购于上海碧云天生物技术有限公司,2X PCR master mix,购于美国Arraystar公司。
CO2培养箱,购于美国Thermo公司;台式高速低温离心机,购于Heraeussepatech公司;紫外可见分光光度计(UV-2800H),购于美国UNICO公司;7900HT Fast Real-Time PCR仪,购于美国Biosystems公司;凝胶成像系统,购于上海天能科技有限公司;ND-1000分光光度计,购于美国NanoDrop公司;ViiA 7实时定量PCR反应体系,购于美国Applied Biosystems公司;Arraystar Human LncRNA Microarray V4.0芯片技术服务和引物设计的技术支持由上海康成生物公司提供。
1.2 细胞培养与转化
人支气管上皮细胞(16HBE)为SV40 largeT抗原永生化的人支气管上皮细胞系,由美国加利福尼亚大学传出。使用含10%标准胎牛血清、青链霉素混合液(100倍稀释)的MEM培养液,于37℃、CO2体积分数为5%的恒温培养箱中培养。取对数生长期的细胞,每瓶接种约5×105个,培养24 h后使用8 μg/mL的GMA进行染毒处理(DMSO作为溶剂对照)。每次染毒时间为72 h,间隔24 h后进行再次染毒,共处理3次,此时记为第1代,继续传代培养至第30代,观察并记录细胞的生长及形态学变化。采用刀豆蛋白A(ConA)凝集实验和锚着依赖性(软琼脂)实验在细胞转化的前、中、后期鉴定细胞生物学特征。
1.3 LncRNA芯片分析
分别收集培养至第10、20、30代的GMA染毒组和DMSO对照组细胞,采用TRIzol提取总RNA,并使用RNase-Free DNase I和RNAclean Kit离心柱型纯化试剂盒对其进行纯化,去除可能存在的DNA污染。通过ND-1000分光光度计测得的不同波长下的吸光度值评估总RNA的纯度,琼脂糖凝胶电泳检测RNA的完整性。使用Agilent Quick Amp Labeling Kit标记逆转录生成的cDNA,在Agilent SureHyb杂交仪中将其与LncRNA芯片进行杂交,并使用NanoDrop检测荧光标记效率,以保证后续芯片结果的可靠性。
通过Arraystar RNA Flash Labeling Kit对样品进行标记后,使用Agilent SureHyb进行杂交实验,芯片洗涤后,Agilent DNA Microarray Scanner扫描信号值。经过芯片标准化处理,得到LncRNA的表达变化情况。以LncRNA相对表达量的差异倍数>2为筛选标准,筛选第10、20、30代均出现差异变化的基因,通过做qPCR验证其在细胞中的表达情况,并查阅文献及DIANA TOOL、NCBI BLAST等生物信息学分析手段预测LINC00472作用的靶基因和可能存在的生物学功能。
1.4 qPCR检测LINC00472和miR-24-3P的表达水平
用逆转录试剂盒将提取纯化后的总RNA样品逆转录为cDNA,以cDNA为模板进行定量PCR反应。反应体系包括:上下游引物各0.5 μL、2×Master Mix 5 μL、cDNA模板2 μL及RNase-free水2 μL;反应条件为:95℃预变性10 min;95℃变性10 s,60℃退火60 s,95℃延伸15 s,共40个循环。分别以管家基因β-actin和U6为内参,以同代溶剂对照组细胞表达水平的均值为基准,采用2-ΔΔCT计算的相对表达水平。管家基因及目的基因的引物序列见表1。
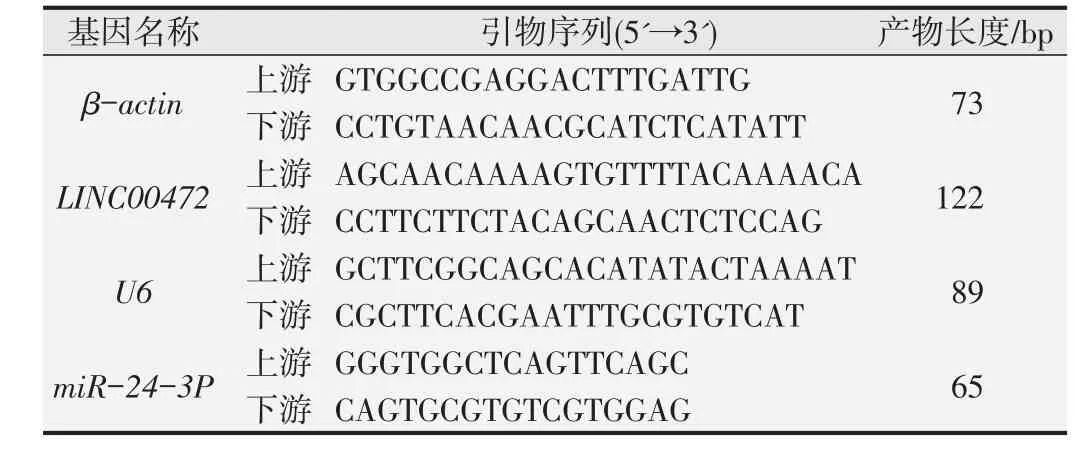
表1 qPCR基因引物序列
1.5 统计学方法
采用SPSS20.0软件进行统计分析,GMA染毒组和DMSO对照组间的基因表达水平的差异比较采用单因素方差分析,组间两两比较选用SNK检验,以α=0.05为检验水准。
2 结果
2.1 LINC00472在16HBE细胞恶性转化过程中表达情况的芯片分析结果
随着GMA诱导16HBE细胞恶性转化的完成,与同期对照组相比,GMA组ConA凝集的速度明显加快,并在第30代软琼脂试验中形成集落。按照设定的筛选标准,共有72个差异LncRNA符合要求,其中LINC00472在GMA诱导16HBE细胞恶性转化各个时期表达情况的芯片分析结果见图1。与同代DMSO对照组相比,LINC00472表达水平在细胞转化的前期、中期和后期分别下调2.30倍、下调3.57倍和上调2.32倍。在16HBE细胞恶性转化过程中,3个时期DMSO对照组中LINC00472的相对表达水平(校正信号值)逐渐下调,而GMA染毒组前期和中期先逐渐下调,而在后期表现为上调。
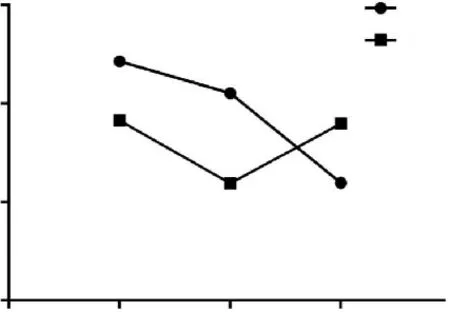
图1 GMA处理组和DMSO对照组16HBE细胞LINC00472的变化情况
2.2 LINC00472在16HBE细胞恶性转化过程中表达情况的qPCR检测结果
qPCR验证的结果显示,与同代龄DMSO对照组相比,第10、20和30代GMA染毒组细胞的LINC00472相对表达水平分别为1.07±0.07、0.364±0.04、2.34±0.44(图2)。其中第20、30代染毒组的相对表达水平变化方向与芯片结果一致,且与对照组相比,两组之间的差异具有统计学意义(P<0.05)。此外,3个时期的GMA染毒组之间LINC00472的相对表达水平也存在统计学差异(P<0.05)。
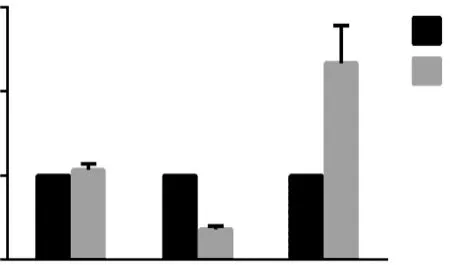
图2 LINC00472的qPCR验证结果
2.3 LINC00472在16HBE细胞恶性转化过程中的靶基因预测及靶基因的qPCR验证结果
为进一步研究LINC00472的生物学功能,通过查阅有关文献及生物信息学数据库信息[6],得到miR-24-3p很可能是LINC00472的一个作用靶基因,LINC00472和miR-24-3p的结合位点见图3。miR-24-3p的qPCR检测结果显示,与同代龄DMSO对照组相比,GMA染毒组细胞的miR-24-3p在第10、20、30代时的相对表达水平分别为1.35±0.03、0.82±0.05、1.43±0.16,两组的相对表达水平具有统计学差异,但其差异倍数均未超过2倍。
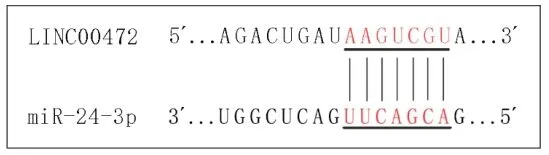
图3 LINC00472和miR-24-3p的结合位点
3 讨论
LncRNA是一类长度超过200个核苷酸的不具有蛋白质编码功能的RNA分子。起初lncRNAs被认为在人类生理过程中不发挥作用。但近年来研究表明,LncRNA虽然不直接参与基因编码和蛋白质合成,但在染色体沉默、染色质修饰、转录激活和转录干扰发挥着非常重要的功能[7]。越来越多的研究发现,LncRNA与人类癌症的发生发展密切相关[8],但在化学物质的诱导细胞恶性转化的机制研究中鲜有报道。
Luo等[9]研究发现,LncRNA MALAT1在PM2.5诱导人支气管上皮HBE和BEAS-2B细胞致瘤性转化中高表达,随着细胞恶性转化的完成,其相对表达水平的改变呈上升趋势,进一步研究发现LncRNA MALAT1通过与miR-204相互作用,在细胞恶性转化过程中发挥“致癌基因”作用。在本研究中,我们通过对GMA诱导16HBE细胞恶性转化的第10、20和30代的高通量芯片结果进行筛选分析,发现LINC00472的表达水平由转化初期的逐步下调到转化后期的上调,这一动态改变提示LINC00472可能在细胞恶性转化过程中发挥作用。
LINC00472作为16号染色体基因间区发现的长链非编码RNA,Zou等[10-11]研究发现,LINC00472与非小细胞肺癌、肺腺癌患者中低表达,其中在非小细胞肺癌中通过激活P53信号通路,进而抑制非小细胞肺癌细胞的增殖、侵袭和迁移能力,表明LINC00472在肺癌中发挥抑癌基因的作用。此外,LINC00472被发现在人类结肠直肠癌中也发挥重要作用[12]。本研究通过LncRNA芯片和qPCR技术检测了LINC00472在GMA诱导的16HBE细胞恶性转化过程的表达改变。结果表明,第10代对照组和GMA染毒组相对表达水平的差异无统计学意义,第20、30代的验证结果与芯片分析结果一致,相对表达水平呈现由低到高的变化趋势。我们推测LINC00472在GMA诱导的16HBE细胞恶性转化早期其作用被抑制,随着转化的完成开始发挥抑癌基因的作用。
越来越多的研究表明,微RNA(microRNA,miRNA)可以直接调节靶基因的表达,从而影响人类肿瘤的发生、发展和转移。而LncRNA可以作为miRNA的内源性竞争RNA和海绵体,间接参与调控miRNA的下游靶基因[13]。Chen等[14]在肝癌的研究中发现,肝癌和正常组织的LncRNA表达水平存在差异,LINC00472在癌组织中表达显著下调,且表达水平低的患者预后水平较差,进一步研究发现LINC00472的表达水平与miR-93-5P呈负相关,miR-93-5P能够特异结合LINC00472,靶向调节LINC00472使其表达减少,进而抑制肝癌细胞的增殖、侵袭和迁移能力。本研究中通过查阅有关文献和生物信息学分析,发现LINC00472和miR-24-3p之间存在碱基结合位点,预测在GMA诱导细胞恶性转化过程中,miR-24-3p可能与LINC00472共同发挥作用。然而miR-24-3p的qPCR验证结果显示,与同期DMSO对照组相比,第10、20和30代GMA染毒组细胞相对表达水平的差异倍数均未超过2倍,变化趋势与LINC00472一致,而miRNA普遍作为内源性竞争RNA分子结合LncRNA共同发挥作用[15]。因此,LINC00472和miR-24-3p在此过程中是否存在相互作用以及其作用机制有待进一步研究。
综上所述,在GMA诱导16HBE细胞恶性转化过程中,芯片分析和实时定量PCR的结果表明,LINC00472在转化中期低表达,转化后期高表达,推测LINC00472可能在GMA诱导16HBE细胞恶性转化后期发挥作用,但是否通过结合miR-24-3p参与调控这一过程,还有待进一步研究。

