旁斑蛋白组成成分1的结构与生物学功能研究进展
徐贤荣,杨 军*
(杭州师范大学医学院预防医学系,浙江 杭州 310036)
旁斑蛋白组成成分1(paraspeckles protein component 1,PSPC1/PSP1)是一种新近发现的细胞核内核旁斑点(paraspeckle)结构蛋白,属于果蝇行为/人类剪接蛋白家族(drosophila behavior/human splicing,DBHS)。PSPC1与DBHS蛋白家族其他两个成员,含八聚体结合蛋白的非POU结构域(non-POU-domain-containing octamer binding protein,NONO)和富含脯氨酸/谷氨酰胺的剪接因子(splicing factor proline/glutamine rich,SFPQ/PSF),以及长链非编码RNA NEAT 1共同构成了旁斑结构。DBHS家族蛋白几乎参与细胞基因调控的每一步,包括转录调控、RNA加工和转运、DNA修复等过程。尽管DBHS蛋白作为一个整体已经被证明具有重要的生物学功能,但有关PSPC1的相关研究仍处于起步阶段,其具体生物学功能依然有许多不明确的地方。本文就PSPC1的结构与生物学功能研究进展进行综述。
1 PSPC1的发现
2002年,Fox等应用蛋白组学技术对细胞核蛋白进行分析,发现了271种蛋白,其中80种蛋白由未知功能的基因所编码[1]。其中,有一种蛋白在染色质间隙的核旁斑点中聚集,被命名为PSPC1。他们发现,应用放线菌素D(actinomycin D)抑制RNA转录的情况下,PSPC1在细胞核内聚集,这引起了他们的兴趣,从而对其进行了进一步的研究。在放线菌素D处理细胞后,荧光素标记的PSPC1蛋白信号在核质中逐渐消失,而在核仁帽状结构中开始出现。由于核旁斑点本身没有出现位置变化,作者认为PSPC1蛋白是从核旁斑点中逸出后在核内单独聚集,可能参与细胞核内重要的生物学功能[2]。PSPC1的发现及其在细胞基因调控中的表现引起了人们的关注,从而开展了与之有关的相关研究。
2 PSPC1的结构
PSPC1由532个氨基酸组成,相对分子质量约为5.82×104,含有两个异构体,分别称之为PSPC1-α和PSPC1-β。PSPC1在哺乳动物中高度保守,人类与小鼠的同源性高达95%[1]。和所有的DBHS家族蛋白一样,PSPC1具有一段300个氨基酸左右长度的高度保守序列,包含两个串联的N-末端RNA识别区域(RNA recognition motifs,RRMs),一个含52个氨基酸的非腺苷酸/旁斑区域(nonA/paraspeckle domain,NOPS)和一个约100个氨基酸的C-末端卷曲螺旋(图1)。RRMs是高等脊椎动物中最为丰富的RNA结合域(在人类中占基因总量的0.5%~1%),典型的RRM包含约90个氨基酸序列,两个RRM之间由7个弹性氨基酸序列所串联[3]。其中RRM1结构较为固定,由4个芳香族氨基酸残基构成,形成β1α1β2β3α2β4拓扑结构,为重要的RNA结合区域;RRM2中则4个保守的氨基酸残基分别被苏氨酸,赖氨酸和异亮氨酸所取代,在3环和5环上形成额外的β折叠;其中的一个具有高度保守序列,代表一个双链DNA/RNA识别区域,提示其结合RNA的能力较差或者结合的形式较为特殊。RRMs上的这些残基对于DBHS蛋白相互作用,并参与形成旁斑的过程发挥关键的作用。NOPS区域自RRM2末端延伸出来,连接卷曲螺旋结构,参与PSPC1与其他DBHS蛋白之间二聚体的形成,其表面的碱性氨基酸残基也可与核酸相结合。C末端的卷曲螺旋为高度有序序列,能够形成二聚体或寡聚体,在形成二聚体时,呈现右旋反并联结构。

图1 PSPC1二级结构示意图
3 PSPC1生物活性形式
PSPC1最初作为旁斑结构的组分,是旁斑的标志之一。在形成旁斑过程中,以一种长链非编码RNA——NEAT1作为骨架,招募PSPC1和其他DBHS蛋白(NONO和PSF/SFPQ)结合于其上。在旁斑结构中,PSPC1、NONO和PSF/SFPQ能够结合到特定mRNA腺苷(A)-I(肌酐)反向重复发卡样序列上,将这些RNA滞留在细胞核内,并在旁斑结构中接受编辑。
PSPC1以二聚体或与其他DBHS蛋白形成异二聚体形式发挥作用,其中异二聚体的稳定性大于二聚体(图2)。PSPC1与NONO或PSF/SFPQ均能够形成异二聚体结构,在小鼠睾丸支持细胞中已经观察到3种蛋白之间形成的异二聚体[4]。二聚体的形成,不仅对于PSPC1结构完整性至关重要,还决定其生物学功能的发挥。Passon等在2011年首次观察到了PSPC1-NONO异二聚体结晶[5],并在后续的研究中对其结构和组成进行了详细的阐述[6]。PSPC1-NONO异二聚体以右旋反向螺旋结构形式存在,4个RNA识别结构区域每两个分别在两侧形成一个20埃的通道样结构。形成二聚体的过程中,70%的缩合结构位于C末端,形成假性的对称结构。相反,在N末端两个RMM1区域出现了断裂,呈现相互叠加。两个分子中,25%亲水性的结构在形成二聚体的过程中分解,每个单倍体43%的残基直接参与二聚体相互作用界面的形成。蛋白相互作用面延伸至整个蛋白上,4个部分均参与其中。由于在相互作用过程中,两者发生分解和重构,在体内无法独立稳定存在,可能为特异性异二聚体[7]。此外,界面间隙表明这种结构仅仅是过渡性的蛋白质-蛋白质相互作用形式[7],说明这种二聚体存在相互交换的动态过程。这种交换在无脊椎动物DBHS蛋白的进化过程中持续存在,通过组成不同的二聚体或异二聚体从而不断增加DBHS蛋白的功能。
Huang等人在新近的研究中明确了PSPC1-SFPQ异二聚体的晶体结构[8]。与以前发现的DBHS蛋白相互作用结构类似,由于两者序列之间高度的相似性(74%相同,93%类似),PSPC1-SFPQ异二聚体呈现一个假性对称结构。RRM2、NOPS和卷曲螺旋组成了相互作用的主要部分。由于天然的高度疏水性,三者形成相互作用面在两个蛋白之间形成右旋的卷曲螺旋结构。进一步分析发现,两种蛋白超过40%的残基参与相互作用面的形成,主要通过疏水键维持这种结构。PSPC1-SFPQ异二聚体的结合力是SFPQ二聚体的10倍,是NONO-SFPQ二聚体的6倍。
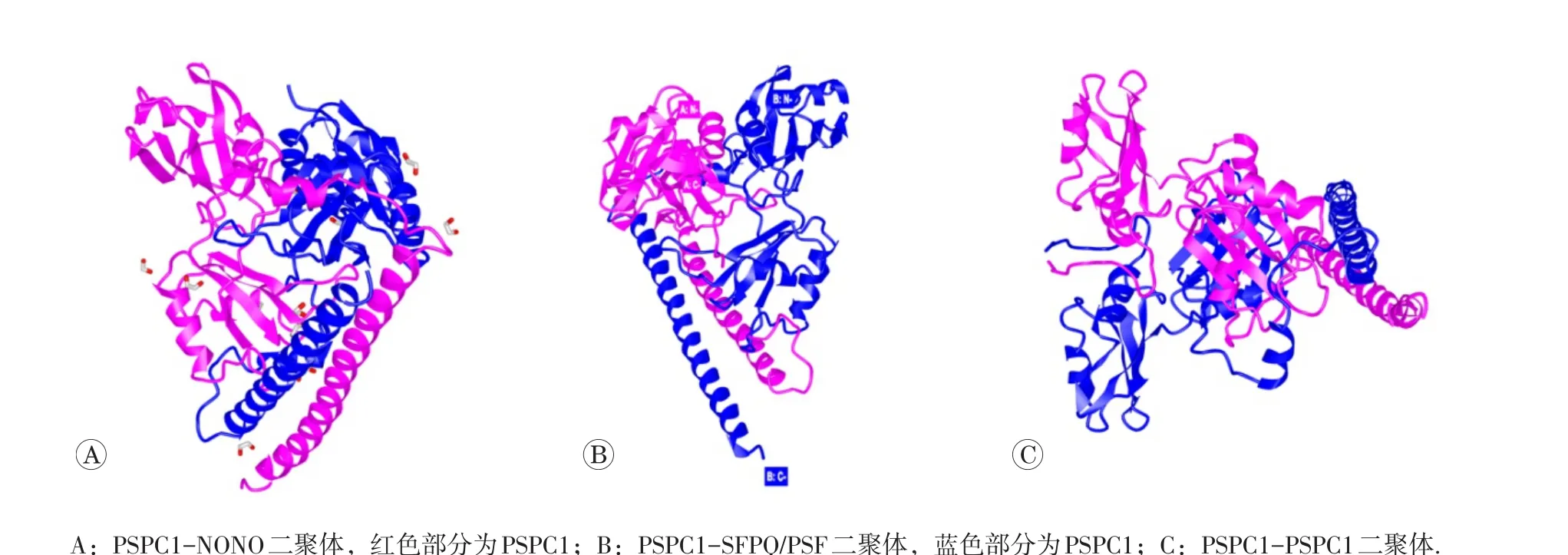
图2 PSPC1的3种二聚体形式和结构[9]
4 PSPC1的生物学功能
最初,PSPC1很大程度上作为旁斑的特异性标志物被人们所认识,但又不是旁斑形成的必要条件,其具体作用并不清楚。后续的研究陆续证明,PSPC1可能在其他方面发挥重要作用,包括DNA损伤修复,细胞分化和周期调控,癌症的发生与发展,神经退行性疾病等。
4.1 参与细胞DNA损伤修复
DBHS蛋白能够参与DNA双链断裂(double-stranded break,DSB)修复,其类型包括同源定向修复或非同源末端连接(nonhomologous end joining,NHEJ)。研究发现,PSF/SFPQ在多种细胞中均具有促进同源DNA配对,互补寡核苷酸侵入超螺旋DNA,D-环形成和加强拓扑异构酶活性的作用。SFPQ/NONO复合物能够结合Ku蛋白和底物DNA[10],并直接与RAD51[11],TopBP1[12],和Matrin3[13]相互作用,将蛋白质募集到DNA损伤位点[14],大大加快同源和非同源修复速度。当NONO缺乏的情况下,细胞内PSPC1蛋白出现表达上调,并与PSF/SFPQ形成稳定的复合物,替代NONO的功能,参与细胞DNA修复过程。在NONO缺陷的背景下,敲除PSPC1将会导致细胞出现高度的放射敏感性和DNA损伤修复延迟,表明PSPC1参与DNA损伤修复过程[15]。
Wu等对PSPC1在DNA损伤修复中的作用进行了进一步的研究。结果发现,应用顺铂诱导HeLa细胞DNA损伤后,细胞中PSPC1出现表达上调,说明PSPC1可能参与DNA损伤过程[16]。采用siRNA技术下调细胞PSPC1表达后,细胞生长显著受到抑制,自发凋亡增加,DNA损伤加重。但进一步研究发现,PSPC1并不与DNA损伤修复相关的蛋白,包括γH2AX、53BP1或Rad51共定位,表明其可能不直接参与DNA损伤修复过程[17]。分析其分子机制发现,当细胞PSPC1表达下调时,细胞逃脱了G1/S相检验点,更多的细胞进入G2/M相,导致DNA损伤修复障碍,引起更多细胞出现凋亡[17]。在甲磺酸甲酯诱导的细胞DNA损伤中同样发现,敲除PSPC1将使得更多细胞逃脱G1/S检验点,进入G2/M相,导致细胞出现有丝分裂灾难,加重细胞凋亡;高表达PSPC1则能够使更多细胞停滞在G1/S相[18]。以上结果表明,PSPC1更可能是参与G1/S检验点调控的一个重要分子,在DNA损伤的情况下被诱导高表达,进而激活G1/S检验点,使得细胞周期停滞,细胞得以对DNA损伤进行修复;而当其被抑制时,G1/S检验点无法被激活,损伤的DNA无法得到修复并进入到G2/M期,最终导致死亡[18]。其课题组还通过蛋白质组学和免疫共沉淀的方法分析了PSPC1调控细胞周期的机制,发现PSPC1能够与调控细胞周期的重要蛋白质——ATP互作蛋白(ATR-interacting protein,ATRIP)之间发生相互作用,提示PSPC1可能通过该机制发挥其生物学功能(待发表)。
4.2 其他功能
4.2.1 调控DNA甲基化修饰Guallar等研究发现,PSPC1能够与DNA甲基化修饰作用密切相关的蛋白——10-11易位蛋白2(Ten-eleven translocation protein 2,TET2)相互结合,将其招募到染色体上。PSPC1和TET2通过组蛋白脱乙酰基酶的转录抑制和通过5-羟甲基胞嘧啶修饰的RNA的转录后去稳定化,促进内源性逆转录病毒关的基因调控过程[19]。
4.2.2 补偿NONO功能DBHS蛋白家族中的NONO蛋白是多种生命活动中的关键分子,调控细胞周期节律、DNA损伤修复以及神经细胞功能完整。在缺失NONO蛋白的情况下,其功能在一定程度上由PSPC1进行补偿。Li等人研究发现,在DNA修复过程中,敲除NONO之后,PSPC1表达出现上调,并与SFPQ形成功能性异二聚体,补偿NONO的功能,从而完成DNA的修复过程[15]。Ha等人发现,在DNA损伤过程中,当NONO数量不足的情况下,PSF能够诱导PSPC1共定位到DNA损伤部位,促进DNA修复过程,而在NONO数量充足的情况下不直接参与DNA修复[14]。
Yamamoto等人也发现,在前列腺癌细胞系——LNCaP-SF中,沉默NONO表达后,PSPC1表达出现显著上调[20]。然而,PSPC1对于NONO的一些特殊功能可能没有补偿作用,如在小鼠中敲除NONO导致的行为异常,以及人体中NONO基因缺陷导致的智力障碍[21]。
4.2.3 参与癌症形成研究发现,在卵巢癌组织中,PSPC1表达下调[22]。Silva等研究发现,一种多腺苷酸化长期应激诱导的长链非编码RNA——LSINCT5在乳腺癌和卵巢癌细胞中出现过度表达。下调其在细胞中的表达后,细胞增殖出现抑制,其中PSPC1基因也出现了显著的下调[23]。在乳腺癌细胞中研究发现,采用二甲双胍处理细胞后,细胞内PSPC1表达水平与细胞对二甲双胍反应性密切相关,提示PSPC1参与癌细胞代谢过程中[24]。对结肠癌细胞核蛋白进行分析发现,与正常细胞相比,PSPC1蛋白表达量显著提高[25]。在结肠癌患者中,其癌组织PSPC1蛋白表达丰度与临床结局密切相关。
Yeh等人在多种类型的癌症中开展调查,研究PSPC1参与癌症发展的机制[26]。他们发现,PSPC1在多种癌症中出现上调,包括晚期的肺癌,乳腺癌和肝癌,并且导致临床结局不良。进一步研究发现,PSPC1能够增加癌细胞的侵袭和转移能力,可与磷酸化状态的Smad2/3分子相互作用,调控细胞核内Smad2/3信号通路,增加癌细胞中转化生长因子β1(transforming growth factor-β1,TGF-β1)分泌。此外,研究还显示PSPC1能够改变Smad2/3蛋白对不同基因的结合优先度,调控促癌和抑癌基因的表达,并在其中发挥主导性作用。这些研究结果提示癌细胞中存在PSPC1-Smad2/3-TGF-β1作用轴,PSPC1可能作为抗癌治疗的一个新靶点。
4.2.4 神经退行性疾病Yu等人以3xTg-AD小鼠为研究对象,在饮水中添加低剂量铜干预,并对其行为和脑部海马线粒体和核蛋白进行分析。结果表明,小鼠大脑海马部位氧化应激和DNA损伤水平显著增加,突触相关蛋白表达降低,同时PSPC1表达出现显著下降,提示其可能参与重金属诱导AD的发病过程[27]。Shi等人同样研究发现,在携带有3种人类变异基因,可产生β淀粉样变的Tg小鼠中(3xTg-AD小鼠),其大部分皮质神经元中均缺乏PSPC1,而在普通的Tg小鼠和对照小鼠的皮质中则没有发现这种现象。Western blot的结果也显示,在3xTg-AD小鼠海马部位的细胞核内,PSPC1的表也出现显著下降。这些结果表明,PSPC1可能在AD发病过程淀粉样变所致神经元损伤中发挥一定作用[28]。
4.2.5 调控脂肪细胞功能Wang等研究发现,PSPC1可能参与调控脂肪细胞的形成和功能调控。在体外研究中,PSPC1结合到许多脂肪细胞RNA 3'非编码区,包括RNA编码转录调控因子-早期B细胞因子1(early B cell factor 1,EBF1)。从脂肪细胞中纯化旁斑结构复合体后发现,PSPC1与RNA转运因子-DEAD盒RNA解旋酶3(DEAD-box RNA helicase 3,DDX3X)存在密切联系,并呈现分化依赖的模式。尤其需要注意的是,PSPC1在分化过程中从细胞核中逸出到细胞质的过程中伴随着脂肪形成相关RNA转运增加。缺乏PSPC1的小鼠脂肪中出现脂质储存和脂肪组织总量下降,并因为补偿性的能量消耗增加而对膳食诱导的肥胖和胰岛素抵抗具有耐受能力。这些发现表明PSPC1依赖的RNA成熟在脂肪生成和功能的转录后调控中发挥一定的作用[29]。
4.2.6 保护生殖细胞此外,在邻苯二甲酸二(2-乙基己)酯诱导的睾丸支持细胞损伤过程中发现,PSPC1和NONO均出现了上调;在抑制NONO和PSPC1表达时,细胞出现氧化应激水平增强,凋亡增加[30]。进一步探讨其机制发现,PSPC1和NONO能够协同结合到乙醛脱氢酶1 DNA促进子CCGGAGTC区域,转录激活乙醛脱氢酶1,从而延缓邻苯二甲酸二(2-乙基己)酯所引起的细胞损伤。
5 小结
近年来的研究表明,PSPC1不仅仅是旁斑蛋白的结构性组分,同时可能是具有核心功能作用的生物大分子。然而,其发挥作用的机制及其在细胞整体的生物学网络中的地位还有待明确。例如,其在多种疾病发生发展中的作用,是通过多种不同的机制还是以同一种作用机制的不同表现形式发挥效应,还不得而知。深入研究PSPC1的生物学功能及其作用机制,将有助于进一步理解细胞生物学过程,为疾病防治提供有益的信息。

