蛋白激酶D2在血管紧张素Ⅱ诱导的病理性心肌肥大中的作用*
魏 薇,刘秋子,李琛琛,应开承,李 静,李长林△
(1.济宁医学院公共卫生学院,山东济宁 272067;2.济宁医学院精准医学研究院,山东济宁 272067;3.南开大学医学院药理学系,天津 300071)
病理性心肌肥大(PCH)心肌应对某些刺激时所表现出的一种适应性反应,主要表现为细胞增大。病理性心肌肥大是许多心血管疾病如高血压、冠心病发展过程中的重要病理改变,其最终往往会导致心力衰竭、心律不齐,甚至猝死[1-2]。
病理性心肌肥大的发生是一个复杂的病变过程,目前关于其机制仍不是很清楚。以往研究表明,多种蛋白激酶在PCH的形成过程中扮演重要角色。目前已经发现多种蛋白激酶参与PCH形成过程。研究较为广泛的有蛋白激酶C(PKC)[3]、蛋白酶激D(PKD)[4-5]、钙调蛋白激酶Ⅱ(CAMKⅡ)[6]、丝裂素活化蛋白激酶(MAPK)[7]。
PKD是一个色氨酸/苏氨酸蛋白激酶家族,有3个成员,即PKD1、PKD2和PKD3[8]。以往研究表明PKD1和PKD3在PCH的形成中发挥重要作用[4-5]。虽然关于PKD1和PKD3在参与病理性心肌肥大形成的研究比较多,但是关于PKD2是否参与心肌肥大调控缺少研究。本实验旨在探讨PKD2与PCH发生之间的关系,揭示PKD2在PCH形成中的作用,为干预和逆转心肌肥大,预防和治疗相关的心血管疾病提供了理论基础。
1 材料与方法
1.1 材料 血管紧张素Ⅱ(AngⅡ)、Trizol、α-actin和β-actin抗体购自美国Sigma公司。Anti-PKD2抗体购于美国Bioworld公司。LipofectamineTM2000购于美国Invitrogene公司。HRP-标记的山羊抗小鼠IgG 和山羊抗兔IgG购于武汉三鹰公司。Trizol、AlexaFluor-488(激发波长488 nm,最大发射波长519 nm,绿色)和碘化丙啶(PI,激发波长488 nm,最大发射波长630 nm,红色)购于英国Abcam公司。SD成年大鼠和新生大鼠(乳鼠),购自军事医学科学院动物实验中心。
1.2 方法
1.2.1 心肌细胞分离 新生大鼠和成年大鼠心肌细胞分离参照本实验室建立的分离方法[5]。
1.2.2 Real-time PCR分析 用Trizol裂解心肌细胞提取RNA,使用反转录酶反转形成cDNA进行RT-PCR和Real-time PCR分析。RT-PCR引物为:PKD2:正向5′-ATC ACC GCC AAT GT CAC CTA CT-3′,反向5′-GTT TCT CCA TCA CCA CGA ATA CC-3′;18S rRNA:正向5′-ACC GCA GCT AGG AAT AAT GGA-3′,反向5′-GCC TCA GTT CCG AAA ACC A-3′;18s rRNA作为内参基因。Real-time引物为心房利尿因子(ANF):正向5′-GGG GGT AGG ATT GAC AGG AT-3′,反向5′-CTC CAG GAG GGT ATT CAC CA-3′;β-肌凝蛋白重链(β-MHC),正向5′-CCT CGC AAT ATC AAG GGA AA-3′,反向5′-TAC AGG TGC ATC AGC TCC AG-3′[9]。
1.2.3 siRNA 干扰 针对PKD2基因设计两个siRNA干扰位点,将两个位点的siRNA序列混合后用LipofectamineTM2000转染新生大鼠细胞。siRNA PKD2的两个位点序列为:5′-CCU UCC UUA UAC AUA GCU ATT-3′,5′-CGG GCU GAA UUA CCA CAA ATT -3′;对照siRNA (NC siRNA) 序列:5′-UUC UCC GAA CGU GUC ACG UTT-3′。
1.2.4 Western blot分析 细胞蛋白用RIPA裂解液裂解,取等量的蛋白进行SDS-PAGE电泳。转膜后与一抗4 ℃孵育过夜。应用过氧化物酶(HRP)标记的二抗显色。
1.2.5 免疫荧光 细胞用4%的多聚甲醛固定5 min,0.5% triton×100穿透后血清封闭30 min,一抗孵育2 h,绿色荧光标记的二抗孵育1 h,进行共聚焦荧光显微镜分析(德国Leica公司)。应用LSM 800 Zeiss共聚焦荧光显微镜照相。
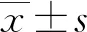
2 结 果
2.1 AngⅡ促进心肌细胞PKD2基因和蛋白表达 Western blot结果表明,AngⅡ(100 nmol/L)处理新生大鼠心肌细胞48 h显著增加PKD2表达。与之相似,AngⅡ(100 nmol/L)处理成年大鼠心肌细胞24 h显著上调PKD2蛋白表达。Real-time PCR显示,PKD2的mRNA水平在AngⅡ诱导的PCH中也显著上调。共聚焦荧光显微镜分析与Western blot和Real-time PCR结果一致,AngⅡ处理显著增加PKD2蛋白在新生和成年大鼠心肌细胞中表达。见图1。

A:Western blot分析;B:Real-time PCR分析;C:免疫荧光分析
图1 PKD2在AngⅡ诱导的PCH中表达上调

A:降低PKD2抑制AngⅡ诱导ANF表达上调;B:降低PKD2抑制AngⅡ诱导β-MHC表达上调;C:PKD2的干扰效率
图2降低PKD2抑制AngⅡ诱导的心肌肥大基因表达上调

A:α-actin荧光染色(×20);B:细胞表面积分析;C:PKD2基因表达
图3心肌细胞表面积分析
2.2 沉默PKD2可以抑制AngⅡ诱导的心肌肥大基因上调 经AngⅡ处理ANF基因表达显著上调[(4.21±0.87)倍]。通过siRNA降低PKD2表达显著抑制了AngⅡ诱导的ANF表达上调。与之相似,AngⅡ处理显著上调β-MHC表达[(2.23±0.20)倍],降低PKD2表达显著抑制了AngⅡ诱导的β-MHC表达上调。见图2。
2.3 降低PKD2表达阻断AngⅡ诱导的心肌细胞表面积增大 AngⅡ处理显著增大心肌细胞细胞面积,通过siRNA降低PKD2表达显著抑制AngⅡ诱导心肌细胞增大。Real-time PCR结果显示siRNA显著降低PKD2表达。见图3。
3 讨 论
PCH发生机制非常复杂,目前普遍认为肾素-血管紧张素-醛固酮系统(RAAS)过度激活在PCH发生过程中起关键调控作用[10-13]。RAAS是一类由多种肽类激素和相应酶组成的体液调节因子的总称。当受到病理刺激时,在肾素、血管紧张素转化酶(ACE)、氨基肽酶A(APA)和氨基肽酶N(APN)等多个酶共同作用下,血管紧张素源转变为AngⅠ、AngⅡ、AngⅢ和AngⅣ[14]。其中AngⅡ是介导RAAS参与PCH发生的重要效应因子。AngⅡ可以与细胞表面受体相结合,活化细胞内PCH相关的基因表达,最终导致PCH[12]。因此研究参与AngⅡ诱发PCH过程的关键基因,是发掘治疗PCH新靶点的重要途径。本研究发现,在PKD2在AngⅡ诱导的PCH中表达显著上调,降低PKD2 表达可以有效抑制AngⅡ诱导的PCH标志基因ANF和β-MHC表达上调和心肌细胞表面增大。这表明,PKD2 在AngⅡ诱导的PCH过程中发挥重要作用,抑制其表达可以降低AngⅡ诱导的PCH。通过小分子抑制剂或基因干预方法抑制PKD2活性有可能会成为一种治疗PCH的潜在新策略。
PKD广泛参与细胞增殖、分化等多个生物学过程。PKD 有3个亚型:PKD1、PKD2和PKD3[8]。PKD1和PKD3参与PCH的发生。BOSSUYT等[15]研究发现,过表达PKD1可以使HDAC5超磷酸化,促使后者迁出细胞核进入细胞质,从而促进心肌肥大病程相关蛋白表达,导致PCH。TAN等[16]报道AngⅡ可以促进PKD1表达,介导PCH发生。以往研究表明,PKD3通过激活钙调神经磷酶(CaN),CaN促进活化T细胞核因子(NFAT4)去磷酸化,去磷酸化NFAT4进入细胞核增强PCH相关基因的表达,最终诱导PCH[5]。本研究发现,PKD2参与调控AngⅡ诱导的PCH发生。这表明PKD基因3个亚型PKD1、PKD2和PKD3均在PCD的发生过程起重要调控作用。MEREDITH等[17]研究发现PKD1选择性抑制剂对防止实验动物PCH的发生效果不理想。出现这一结果的原因可能会很多,但最可能的一个原因就是单一抑制PKD1亚型时,其他两个亚型PKD2或PKD3仍然在PCD形成过程中发挥作用,诱导PCD发生。因此,探索能够同时抑制PKD1、PKD2和PKD3的小分子化合物或基因干预方式可能是基于PKD靶点治疗PCH的新思路。
综上所述,PKD2在AngⅡ诱导的PCH中发挥重要作用,抑制PKD2表达能显著降低AngⅡ诱导的PCH。

