多糖受体与巨噬细胞吞噬作用关系研究进展
赵 丽,金周雨,*,荆 波,宋 慧,2,*
(1.吉林农业大学生命科学学院,吉林 长春 130118;2.吉林农业大学 教育部食药用菌工程研究中心,吉林 长春 130118)
多糖是由10 个以上单糖之间脱水形成的糖苷键连接而成的链状聚合物,是生物体中重要的大分子物质之一。多糖糖链结构复杂多变,不同的糖苷键、单糖组成和分支化程度等,使其具有抗病毒、抗肿瘤、免疫应答、降血脂等多种生物活性[1-2],现已作为药物、保健食品和食品添加剂得到开发利用,成为食品科学、生命科学、医药科学等领域研究的热点。
巨噬细胞属于免疫细胞,其吞噬与清除能力是启动机体免疫的重要途径之一,巨噬细胞表面具有多种受体,能参与介导细胞吞噬作用。一些研究发现多糖可通过巨噬细胞表面受体激活巨噬细胞释放免疫因子,且多糖可促进细胞吞噬作用,但关于多糖增强巨噬细胞吞噬活性与巨噬细胞表面多糖受体之间的关系及其作用机制研究较少。
1 巨噬细胞吞噬作用
巨噬细胞吞噬作用起始于对目标颗粒的识别,并将目标颗粒摄入质膜形成吞噬体。而后吞噬体与溶酶体融合形成吞噬溶酶体,目标颗粒被溶酶体内的多种水解酶消化分解后被吸收在细胞质内[3]。巨噬细胞的吞噬作用是先天免疫中最基本的防御机制,其机制复杂独特,与胞吞物质特点密切相关。
巨噬细胞激活后,游走和吞噬是巨噬细胞运动的主要特征,其伪足的伸出与肌动蛋白的形成有关。研究表明,细胞在吞噬过程中其骨架结构发生改变,作为细胞骨架蛋白的肌动蛋白发生重排,F-肌动蛋白在膜下聚集形成伪足;如果用抑制肌动蛋白聚合的药物(如细胞松弛素)处理后,则不能形成伪足[4-5]。Orsi等[6]研究发现,甲壳毒素可通过改变J774巨噬细胞中F-肌动蛋白排布来影响细胞骨架的完整性,从而抑制巨噬细胞的吞噬活性。
巨噬细胞的吞噬作用是识别、摄入与清除的复杂过程,由于胞吞物的专一性,巨噬细胞表面存在多种受体可介导其吞噬作用。例如,巨噬细胞对衰老红细胞的识别引发的吞噬作用。衰老红细胞表面因唾液酸的缺乏而暴露出半乳糖分子,而巨噬细胞表面有一类受体可对半乳糖分子进行识别从而促进其对衰老红细胞的吞噬作用[7]。有研究表明,细胞表面有些受体与配体结合后会引起吞噬相关的信号传导,但并不引起针对其配体的吞噬体的产生[8]。Bi Decheng等[9]发现海藻盐多糖可增强巨噬细胞的吞噬活性,增加Toll样受体4(Toll-like receptors 4,TLR4)的表达并激活蛋白激酶B(protein kinase B,Akt)/核因子-κB(nuclear factor-κB,NF-κB)和丝裂原活蛋白激酶(mitogen-activated protein kinase,MAPK)p38信号通路。加入TLR4、NF-κB和p38 MAPK抑制剂或敲低TLR4基因后,藻酸盐促进的吞噬作用下降,其实验结果与上述观点一致。
2 多糖及其受体与巨噬细胞关系概述
2.1 多糖与巨噬细胞吞噬作用
有研究表明多糖免疫调节活性之一是促进巨噬细胞吞噬作用[10]。Yang Jiali等[11]从香蕉中提取的α-(1→6)-D-葡聚糖可通过提高T细胞增殖功能、巨噬细胞的吞噬功能、分化簇(cluster of differentiation,CD)3+T细胞水平等来改善免疫状态。Tang Chao等[12]从紫甘薯中分离的水溶性多糖、稀碱溶性多糖和浓碱溶性多糖均可增强巨噬细胞吞噬活性。秋葵豆荚粗多糖可显著增加腹膜内巨噬细胞对金黄色葡萄球菌的吞噬活性[13]。山芝麻多糖可显著促进巨噬细胞的增殖能力,刺激巨噬细胞的吞噬能力,以及诱导NO和免疫调节细胞因子的产生[14]。综上所述,许多天然多糖均能促进巨噬细胞吞噬活性。这些研究多以巨噬细胞对中性红的胞饮作用作为证明依据,但在机体免疫中,细菌、病毒等引起的巨噬细胞吞噬作用与巨噬细胞表面多种受体有关,具有特异性。因此,中性红实验并不能很好地证明吞噬作用的受体介导机制。
2.2 巨噬细胞表面多糖受体
巨噬细胞表面存在多种受体,其介导巨噬细胞发挥免疫功能。而在这些受体中有一部分可以识别多糖并与之结合,被称为多糖受体。Sun Hongxiang等[15]研究发现,猕猴桃根毛多糖可显著增强巨噬细胞的胞饮和吞噬活性,诱导NO、肿瘤坏死因子(tumor necrosis factor,TNF-α)、白细胞介素-10(interleukin-10,IL-10)、IL-1β的产生,上调TLR2、TLR9、髓样分化因子(myeloid differentiation factor88,MyD88)、β干扰素TIR结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon-β,TRIF)和NF-κB的mRNA表达水平,促进人NF-κB抑制蛋白α(IκB-α)在RA264.7细胞中降解和NF-κB活化。竹荪多糖可结合巨噬细胞表面TLR4激活和NF-κB信号传导途径诱导巨噬细胞的活化,上调诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、IL-1β、IL-6和TNF-α的mRNA的表达,促进NO、L-1β、IL-6和TNF-α的产生[16]。多糖激活巨噬细胞首先与细胞表面多糖受体结合,激活胞内信号转导途径,介导炎性因子如TNF-α、IL-1β、IL-6等释放,进而增强免疫调节能力。现已发现的多糖受体主要包括TLRs、甘露糖受体(mannose receptor,MR)、Dectin-1、清道夫受体(scavenger receptor,SR)、补体受体3(complement receptor 3,CR3)等。
多糖、多糖受体及细胞吞噬作用三者间的关系归纳见表1。

表 1 巨噬细胞表面吞噬相关受体及其配体和相关机制Table 1 Macrophage surface phagocytosis-associated receptors and their ligands as well as corresponding signaling pathways
3 多糖受体与巨噬细胞吞噬的关系
巨噬细胞表面受体是激活巨噬细胞启动免疫应答机制的关键之一。研究表明,多糖对巨噬细胞的活化是通过细胞表面的多糖受体实现的,多糖受体多为模式识别受体(pattern recognition receptors,PRRs)。PRRs可识别病原体表面的一些自身表达或与其产物所共有的、高度保守的病原相关分子模式(pathogen-associated molecular pattern,PAMP),如细菌表面的脂多糖、肽聚糖或病毒的核酸、蛋白质等,介导巨噬细胞对病原微生物的吞噬清除;也可识别细胞或组织受损后释放的损伤相关分子模式(damage-associated molecular patterns,DAMPs),进而介导巨噬细胞对凋亡细胞或受损组织碎片的吞噬清除[24]。目前对多糖受体与吞噬的关系的研究还较少。
3.1 TLRs与吞噬作用
TLRs是在果蝇中发现的第一个具有分子识别模式的I型跨膜蛋白,由可参与识别微生物病原相关分子模式的胞膜外区、能募集TIR信号分子的胞浆区和跨膜区3 个部分组成。由于TLRs胞浆区I与L-1R家族胞浆区高度同源,因此该区又被称为Toll IL-1受体结构域[25]。TLRs可监控识别不同的病原分子,在机体抵抗病毒感染中起到重要作用,目前已经发现的人类TLRs家族成员有11 个,其中TLR2和TLR4与巨噬细胞吞噬作用关系最为密切。
Lee等[26]研究表明蛹虫草发酵液多糖可与巨噬细胞表面TLR4和TLR2结合,激活MAPK及NF-kB信号通路进而促进NO、ROS、TNF-α的产生,并增强巨噬细胞吞噬作用。王梁华等[27]研究表明LPS激活细胞后,产生的TNF相关的凋亡诱导配体(TNF related apoptosis inducing ligand,TRAIL)与TNF-α可以增强细胞本身的吞噬能力,而使用TLR2多抗则可抑制其吞噬作用。TLR2参与对金黄色葡萄球菌的识别,当通过siRNA敲低TLR2后可减弱RAW264.7中JNK磷酸化,并且降低金黄色葡萄球菌感染时的吞噬作用和细胞自噬[28]。Zhang Pei等[29]研究发现壳聚糖寡糖(chitosan oligosaccharide,COS)能显著增强RAW264.7细胞对中性红的吞噬作用,并且TLR4可识别COS增强巨噬细胞对FITC标记COS的胞饮作用。综上所述,表明TLRs可直接识别胞吞物质介导巨噬细胞吞噬,也可与其配体结合激活吞噬相关信号传导途径促进吞噬作用。
3.2 MR与吞噬作用
MR属于C型凝集素超家族成员,是一种钙依赖性I型跨膜糖蛋白,从N端到C端依次为富含半胱氨酸(cysteinrich domain,CR)结构域,II型纤连蛋白(fibronectin,FNII)结构域,8 个碳水化合物识别域(carbohydrate recognition domain,CRD),跨膜结构域和细胞质尾[19]。MR可识别含有甘露糖和岩藻糖残基的多种糖分子,介导免疫细胞的内吞作用来维持内环境的稳定,维系先天免疫与后天免疫,组成机体的一种免疫防御系统。有研究表明,黑灵芝多糖可作为巨噬细胞表面MR的配体增强MR的表达,抑制LPS诱导的炎症反应,增强巨噬细胞吞噬活性,介导机体免疫反应[30-31]。Garcia-Aguilar等[32]通过实验发现,MR参与分枝杆菌诱导的凋亡细胞的吞噬作用,当凋亡细胞和巨噬细胞接触时,MR与暴露于凋亡细胞上的相应配体结合进而引起吞噬作用。Beharka等[33]研究表明,表面活性蛋白A(surfactant protein A,SP-A)可通过上调MR的表达增加肺泡巨噬细胞(alveolar macrophages,AMs)的吞噬作用,且SP-A可增强MR介导的对涂有荚膜脂多糖微球的吞噬作用,而该作用又可被MR另一配体甘露糖抑制。现阶段,关于多糖、MR与巨噬细胞的研究多集中于多糖通过MR激活巨噬细胞免疫或由MR介导的巨噬细胞的吞噬活性等方面。而关于多糖在由MR介导的巨噬细胞吞噬活性方面影响的研究鲜见报道。但通过上述报道,可以大胆假设多糖能否通过上调MR的表达促进巨噬细胞对病原体的清除。
3.3 SR与吞噬作用
SR是另一类重要的模式识别受体,根据其结构的多样性被分为8 个不同的类别,而后又发现HVACR1、P2X嘌呤受体以及CD163 3 类不同的SR,尚未正式划入SRs,但都与吞噬相关,各类SR结构特点如表2[34]所示。SR可识别LDL、LPS和LTA等,参与介导病原体、丧失唾液酸的衰老红细胞和某些凋亡细胞的识别和清除[35]。在脂质代谢、动脉粥样化形成、先天免疫和宿主防御病原体等方面发挥重要作用[36]。
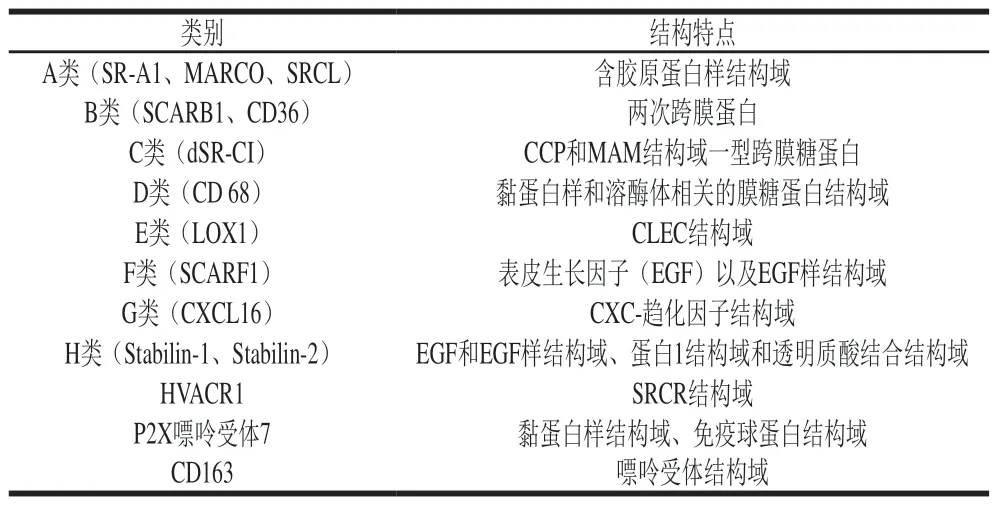
表 2 各类SR结构特点[34]Table 2 Structural characteristics of various scavenger receptors[34]
在关于SR的研究中报道,如果由SR-A和CD36介导的氧化低密度脂蛋白(oxidize LDL,oxLDL)过度内化则会导致泡沫细胞的形成。而β-葡聚糖和杏鲍菇多糖可降低巨噬细胞表面SR-A和CD36的表达,抑制巨噬细胞对oxLDL的摄取[37-38]。但在关于由SR介导巨噬细胞吞噬病原体的研究中,Seixas等[39]发现,B型SR CD36是介导巨噬细胞吞噬伯氏疟原虫和大肠杆菌的受体,而细胞中Rab14的表达可以破坏其吞噬机制,Rab14沉默后可以降低CD36的内化速率,增强巨噬细胞表面CD36的表达,促进其对伯氏疟原虫和大肠杆菌的吞噬作用。虽然有关多糖、SR和巨噬细胞吞噬作用三者之间的研究鲜见报道,但可以通过上述文献推断多糖对由SR介导的吞噬作用的影响有利有弊,其应用的利弊有待于进一步研究发现。SR虽然可直接识别配体并将其摄入细胞,但SR并不含细胞内活化信号序列,其信号传导机制可以与其他蛋白如TLRs相互作用进行[40]。高迁移率族蛋白1(high mobility group protein B1,HMGB1)是代表性的损伤相关分子模式(damage-associated molecular pattern,DAMP),在细胞损伤或坏死后释放到细胞外空间。HMGB1可以通过TLRs介导胞内信号传导激活巨噬细胞,然而,HMGB1不与高亲和力的TLRs结合,HMGB1的C末端酸性结构域可被A类SR识别并结合介导巨噬细胞对其的内化,HMGB1进入细胞内可与由SR介导内化的TLRs共定位,进而激活胞内信号传导途径,释放炎性因子调节免疫。且这种共定位也需要SR介导,其机制尚不明确[41]。由此可表明,SR虽不能直接参与细胞内信号活化,但也是体内宿主防御机制中介导吞噬与免疫应答的重要受体。
3.4 CR3与吞噬作用
CR3是白细胞整合素β2家族中的一员,主要表达于巨噬细胞、中性粒细胞和自然杀伤细胞中,在细胞免疫中介导细胞黏附和调理吞噬。CR3是由CD11b/CD18两种跨膜蛋白组成的二聚体整合素,其CD11b亚基中有一个可以结合不同配体的共同结合位点,其配体为补体和β-葡聚糖[42]。由CR3介导的病原体清除作用,CR3与病原体的结合需要以补体的裂解产物C3b或C4b为中间桥梁。研究表明,CR3可以与经iC3b调理的金黄色葡萄球菌结合,促进单核细胞衍生的巨噬细胞及树突细胞对其进行吞噬[23]。CR3可结合并识别β-葡聚糖,激活FAK信号通路,促进ROS、TNF-α和IL-1β的产生介导猪中性粒细胞对β-葡聚糖的吞噬作用[43]。由此表明CR3也可与其配体结合,产生对应的信号级联反应激活巨噬细胞,然后巨噬细胞通过吞噬作用直接杀死病原体,并呈递抗原引发免疫反应,诱导细胞中的iNOS释放NO,并且分泌炎性因子[44]。据报道,CR3的存在显著降低了FcγR介导的吞噬作用中所需结合免疫球蛋白G(immunoglobulin G,igG)的量,且使用CR3抗体抑制后可显著降低FcγR介导的吞噬作用,由此表明FcγR和CR3之间存在相互作用[45]。综上所述,CR3可能与其他受体或蛋白协同作用,但其机制尚不明确,有待于进一步研究。
3.5 Dectin-1与吞噬作用
Dectin-1属于膜相关C型凝集素家族中的一种II型跨膜结构受体,主要表达于单核巨噬细胞、中性粒细胞、树突状细胞等细胞中。其结构由C型凝集素样受体碳水化合物识别域(C-type lectin domain,CTLD)、短杆连接的跨膜结构域和具有免疫受体功能酪氨酸激酶活化基序(immunoreceptor tyrosine-based activation motif,ITAM)3 个部分构成,可识别外源性病原菌上的LPS与T细胞表达的内源性配体[46]。β-葡聚糖为其主要配体,据报道,真菌细胞壁β-葡聚糖与Dectin-1结合后可促进细胞骨架重排,形成吞噬小体,释放大量的ROS、细胞因子和趋化因子[47],由此可推断Dectin-1作为免疫相关的重要受体可参与介导巨噬细胞吞噬作用。
据报道,Dectin-1可与其他模式识别受体协同作用启动免疫反应[48],β-葡聚糖与Dectin-1结合诱导病原体内化,并与TLR-2一起诱导细胞因子的产生。Dectin-1还通过激活T细胞(nuclear factor of activated T cells,NFAT)通路的核因子增加促炎性细胞因子的产生,从而增强TLR2反应[49]。Deng Chao等[16]研究表明TLR4和Dectin-1均可作为竹荪多糖受体,激活MAPK/NF-κB信号,促进IL-1β和TNF-α的分泌,促进细胞吞噬作用。有研究表明,Dectin-1和TLR9均参与介导巨噬细胞对烟曲霉和白色念珠菌的先天免疫应答反应,但二者作用不同且分工明确[50]。TLR9定位于细胞内,可识别非甲基化的胞嘧啶-磷酸-鸟嘌呤基序(CpG DNA),从而调节炎性细胞因子对真菌病原体的反应。Dectin-1与含有β-1,3葡聚糖的真菌病原体结合后,Dectin-1的细胞质ITAM基序被Src家族激酶磷酸化,使脾酪氨酸激酶(spleentyrosine tyrosine kinase,Syk)活化。触发吞噬体的酸化,并使TLR9向含有β-1,3葡聚糖的吞噬体中募集[50]。这种募集的最终目的尚不明确,但这可能为协调先天抗真菌防御提供新思路。且有研究表明,Dectin-1与β-葡聚糖结合后可促使肌动蛋白发生改变,巨噬细胞进行吞噬,激活胞内信号传导机制引起炎症反应,但如果阻断细胞吞噬作用,仍允许细胞表面持续的受体信号传导[51]。由此可见,Dectin-1介导的抗菌免疫反应机制复杂,有待于进一步研究。
4 结 语
巨噬细胞作为一种免疫细胞,对病原微生物及受损组织的吞噬消除是通过细胞表面受体来实现。这些受体可直接识别病原分子或损伤相关分子,触发诱导吞噬作用的信号级联反应,也可与其配体结合,通过信号传导途径促进细胞吞噬作用或胞饮作用。多糖作为免疫调节剂,可激活巨噬细胞促进其吞噬作用,然而近年来对细胞表面的多糖受体报道多为激活相关信号通路、促进免疫因子的释放,而其在细胞吞噬中扮演的角色以及其相关机制都有待深入研究。有关巨噬细胞表面多糖受体与多糖促进其吞噬活性之间相互作用的研究将是理解多糖调节免疫的关键性环节,并可为临床治疗提供可靠的依据。

