超高压结合胰蛋白酶消减虾原肌球蛋白致敏性及其抗原线性表位残留
胡志和,王丽娟,薛 璐,刘 平,贾 莹,鲁丁强
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
食物过敏反应是人体对食物中抗原产生的超敏反应,特别在发达国家和地区食物过敏的患病率越来越高[1],严重影响患者及其家庭的生活质量,尤其对儿童的影响甚至比慢性儿童疾病更为严重[2]。虾类虽然味道鲜美,却是引起食物过敏的一类重要过敏原[3]。在食物过敏人群中,约有20%的过敏患者对虾过敏,在儿童过敏患者中发病率高达60%[4]。研究发现,虾类的过敏原蛋白主要包括原肌球蛋白(tropomyosin,TM)、精氨酸激酶、肌球蛋白轻链以及肌浆钙结合蛋白,致敏率分别为80%、51%、57%和45%[5]。虾类过敏原的研究主要集中在TM。自Shanti等[6]确定印度对虾以及Daul等[7]确定褐对虾(Penaeus aztecus)的主要过敏原是TM以来,研究者先后研究了刀额新对虾[8]、龙虾[9]、磷虾[10-11]、凡纳滨对虾[12]、中国对虾[13]、虾蛄[11]及其他虾蟹等甲壳类[14]水产品的TM,这些甲壳类水产品TM的一级结构、空间结构、分子质量及抗原性质(构象表位和线性表位)等具有高度一致性。
近年来,研究的重点转移到如何消减其致敏性方面。致敏性消减主要采用物理法、化学法和生物法,由于原料和产品的要求不同,所采用的方法也不同。在物理法中,主要有加热、辐照、超声波、超高压及热与超高压结合等方法。Yu Huilin等[15]采用煮沸加热、超声波与煮沸加热、高压蒸汽加热等方法处理TM,发现高压蒸汽加热能够较好地促进过敏原的消减;Li Zhenxing等[16]采用辐照方法处理虾的提取蛋白,发现当辐照剂量大于10 kGy时,虾过敏原蛋白的致敏性才有显著下降;Zhang Ziye等[17]采用高强度超声波处理白虾(Exopalaemon modestus)的TM,能够使半胱氨酸(Cys)、蛋氨酸(Met)和赖氨酸(Lys)发生氧化,TM发生降解,导致α-螺旋含量降低,β-折叠、β-转角及无规卷曲含量增加,进而促进TM的有效水解和致敏性的降低;胡志和等[18]采用超高压处理凡纳滨对虾的TM,发现适当的高压处理能够消减TM的致敏性,且致敏性与TM的三级结构的变化密切相关;Long Fangyu等[19]采用超高压结合热加工的方法处理凡纳滨对虾的TM,在55 ℃、500 MPa下处理10 min,TM与免疫球蛋白E(immune globulin E,IgE)的结合能力降低了73.59%。化学法消减TM致敏性常采用的方法有酸水解法、美拉德反应和小分子络合反应等。Fu Linglin等[20]将核糖、低聚半乳糖和低聚壳聚糖分别与TM进行美拉德反应,其反应产物的致敏性降低了60%,且α-螺旋向β-折叠转化;Lü Liangtao等[21]采用2,2’-偶氮二(2-脒基丙烷)二盐酸盐(2,2’-azobis(2-amidinopropane)dihydrochloride,AAPH)与虾的TM作用,发现AAPH能够通过TM的聚集诱发其结构变化,进而降低TM的致敏性;另外,其还将4-羟基-2-壬烯醛(4-hydroxy-2-nonenal,HNE)与虾的TM进行作用,当HNE浓度大于0.5 mmol/L时,TM与IgE的结合能力显著下降[22]。Ahmed等[23]将酪氨酸酶与咖啡酸共同作用于虾的TM,发现咖啡酸能够促进酪氨酸酶与TM的交联,改变TM的空间结构,降低其致敏性。生物法消减TM致敏性,主要采用的方法有酶法、微生物法、酶与高压结合法。吴海明等[24-25]采用胰蛋白酶、菠萝蛋白酶和木瓜蛋白酶分别水解虾TM粗提物和虾肉,发现这3 种酶对虾蛋白的致敏性均有较好的消减作用;谢丹丹[26-27]和贾莹[28]等采用酶与超高压结合处理虾TM粗提物、虾肉和虾仁,发现高压下酶水解TM与常压下酶水解TM相比,前者对TM致敏性消减效果更好;李鸿雁等[29]采用乳酸菌发酵虾肉有效降低了TM的致敏性。
虽然有学者采用不同手段处理TM消减其致敏性,对TM的线性表位进行了预测[30-31],但鲜有从线性表位残留的角度分析酶水解效果与致敏性残留的关系。本研究采用超高压结合胰蛋白酶法处理凡纳滨对虾的TM,通过比较常压下酶水解与超高压下酶水解产物的致敏性差异及线性表位的残留,分析水解产物致敏性消减的效果,为超高压结合酶消减过敏原致敏性提供理论支撑。
1 材料与方法
1.1 材料与试剂
凡纳滨对虾的TM(纯度为97.65%) 天津商业大学食品专业实验室制备;胰蛋白酶、苯胺基萘磺酸(8-anilino-1-naphthalene-sulfonate,ANS)、兔抗南美白对虾TM-IgG抗体、辣根过氧化物酶标记的羊抗兔IgG抗体 美国Sigma公司;其他实验试剂(均为分析纯)天津市凯通化学试剂有限公司。
1.2 仪器与设备
Nicolet5700傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司;F-4600荧光分光光度计 日本日立高新技术公司;HPP.L2-1000/1型超高压设备超高压实验机 天津华泰森淼生物工程技术有限公司;DC-2030节能型智能恒温槽 宁波新芝生物科技股份有限公司;SpectraMax190光吸收酶标仪 美国美谷分子仪器有限公司;FDU-810型冷冻干燥机 日本东京理化公司;Triple TOF 5600质谱仪 美国SCIEX公司。
1.3 方法
1.3.1 超高压处理胰蛋白酶最适条件的确定
用磷酸盐缓冲溶液(pH 8.0)将胰蛋白酶配制成0.1 mg/mL酶液,取5 mL酶液真空密封于聚乙烯密封袋,采用不同压力处理30 min,确定使酶活力最高的压力;在所确定压力下保压不同时间(0、10、20、30、40、50 min),确定适宜的保压时间。采用福林-酚法测定胰蛋白酶活力[32]。
1.3.2 常压下胰蛋白酶水解TM最适条件的确定
用磷酸盐缓冲溶液(pH 8.0)将TM配制成质量分数为3%的溶液,在40 ℃、不同酶添加量(以TM溶液质量计)(0(对照)、500、1 000、1 500、2 000、2 500、3 000、3 500 U/g)下,水解30 min,水解物经冷冻干燥后,采用间接酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法[18]检测水解产物的致敏性,以OD492nm表征致敏性,致敏性消减率按照下式计算,以确定适宜消减TM致敏性的酶解条件。
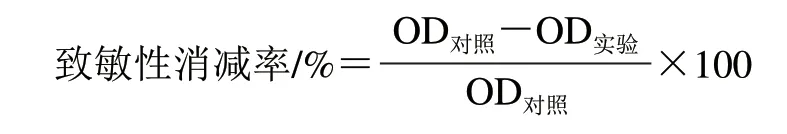
1.3.3 超高压处理TM及相关指标的测定
1.3.3.1 超高压处理TM
将TM用超纯水溶解,配制成质量浓度为2 mg/mL的溶液,真空密封包装。选取不同的压力(0.1(对照组)、100~900 MPa),在40 ℃下处理30 min,取出后冷冻干燥,对其进行指标测定。
1.3.3.2 TM傅里叶变换红外光谱扫描
称取2 mg经冷冻干燥的TM与100 mg KBr充分混合研磨,压片后,采用傅里叶变换红外光谱仪在400~4 000 cm-1范围内进行扫描。采用EZ OMNIC软件分析TM二级结构。
1.3.3.3 TM荧光光谱扫描
将冷冻干燥的TM用磷酸盐缓冲液(pH 8.0)配制成0.1 mg/mL的溶液,取4 mL TM溶液,加入20 μL的ANS外源荧光探针溶液(5.0 mmol/L)。常温下避光反应1 h后,激发波长280 nm,在320~380 nm范围内进行荧光光谱扫描。
1.3.3.4 TM的致敏性
根据文献[18]的方法检测超高压处理后TM的致敏性。
1.3.4 超高压结合酶水解TM及相关指标的测定
1.3.4.1 常压下酶水解超高压处理的TM
将不同超高压条件下(0.1、100~900 MPa)处理的TM用pH 8.0的磷酸盐缓冲液溶解成质量分数为3%的溶液,在1.3.2节所确定的最佳水解条件下进行水解,采用间接ELISA法检测水解产物的致敏性。
1.3.4.2 超高压结合胰蛋白酶水解TM
采用1.3.1节所确定的有利于提高酶活力的条件,结合1.3.2节所确定的水解条件,对TM在超高压下进行水解,并检测其致敏性变化。具体方法为,将TM用pH 8.0的磷酸盐缓冲液配制质量分数为3%的溶液,加胰蛋白酶3 000 U/g,在200 MPa、温度40 ℃下水解时间30 min,检测其致敏性变化。
1.3.5 常压下水解产物与超高压下酶法水解产物线性抗原表位残留测定
此部分委托深圳华大基因公司进行检测。将TM在常压下和超高压(200 MPa)下水解(40 ℃、加酶量3 000 U/g、30 min)的产物,采用Triple TOF 5600质谱仪进行片段的氨基酸序列检测,所用主要软件为Maxquant v1.5.2.8。标准生物信息分析使用数据库:CBI(add_target_Litopenaeus_vannamei_nr.fasta,709 sequences)(https://www.ncbi.nlm.nih.gov/protein/?term=Litopenaeus+vannamei);搜索鉴定采用Maxquant软件,在分析过程中,用于非特异性搜索的肽段长度最小为8 个氨基酸残基,最大为40 个氨基酸残基。
1.4 数据统计与分析
实验数据采用SPSS 16.0统计软件进行分析,结果采用平均值±标准差表示;应用配对t检验分析各组之间差异的显著性,P<0.05表明有显著性差异。图表制作利用Origin 8.6和Excel 2007软件进行。
2 结果与分析
2.1 超高压处理对胰蛋白酶活力的影响

图 1 超高压处理对胰蛋白酶活力的影响Fig. 1 Effect of ultra-high pressure treatment on trypsin activity
由图1A可知,在实验条件压力范围内,处理胰蛋白酶30 min,其活力随压力的增加呈先增加后降低的趋势。当压力在0.1~200 MPa范围内,随压力升高,胰蛋白酶活力上升,在200 MPa时胰蛋白酶的活力达到最大值,为223 U/mg,比对照0.1 MPa组提高39.38%;当压力在200~800 MPa范围内,随压力升高胰蛋白酶活力下降,800 MPa时,胰蛋白酶的活力为137 U/mg,比对照组降低14.38%;但在压力小于400 MPa的范围内,胰蛋白酶的活力均高于对照组。
在200 MPa处理0~50 min,胰蛋白酶活力变化如图1B所示。在保压时间0~30 min范围内,胰蛋白酶活力上升,当保压时间为30 min时,胰蛋白酶活力达到最大值;在保压时间40~50 min内,胰蛋白酶活力开始下降,当保压时间为50 min时,胰蛋白酶活力为152 U/mg,比对照组降低5%;但在保压时间小于40 min的范围内,胰蛋白酶的活力均高于对照组。
综上,在实验条件范围内,能够较好提高胰蛋白酶活力的条件为:温度40 ℃、压力200 MPa、保压时间30 min。该结果与贾莹[28]和刘平[33]等的实验结果基本一致。酶活力在超高压下随压力的增加和处理时间的延长呈现的变化与其二级结构中α-螺旋和β-转角的峰面积之比、酪氨酸及色氨酸等疏水氨基酸残基暴露程度有关[34]。超高压改变胰蛋白酶酶活性中心的非共价键,使活性中心部分暴露,从而使酶空间结构发生改变,进而改变酶活力[33,35]。
2.2 常压条件水解对TM产物致敏性的影响

图 2 常压条件下酶添加量对TM产物致敏性消减率的影响Fig. 2 Effect of trypsin-to-TM ratio on allergenicity reduction of TM
在胰蛋白酶水解TM过程中,酶与底物比例不同,其水解效率不同,且水解产物片段的大小也存在差异,导致水解产物的致敏性不同[26]。由图2可知,随着酶添加量(0~3 500 U/g)的增加,水解产物的致敏性(OD492nm)逐渐降低,致敏性消减率逐渐提高。在酶的添加量不小于3 000 U/g时,TM水解产物的致敏性消减率为89%。
2.3 超高压处理对南美白对虾TM结构及其免疫原性关系的影响
2.3.1 超高压处理引发TM的二级结构变化

图 3 不同压力处理后TM的傅里叶变换红外光谱图Fig. 3 Fourier transform infrared spectra of TM treated at different pressures
图3为经不同压力处理后的TM傅里叶变换红外光谱图;经OMNIC软件分析,TM二级结构的相对含量变化见图4,TM的二级结构以α-螺旋为主,该结果与Lyon等[36]采用自优化预测法预测的TM二级结构含量基本一致,但与圆二色光谱法检测的二级结构含量[18]存在差异。
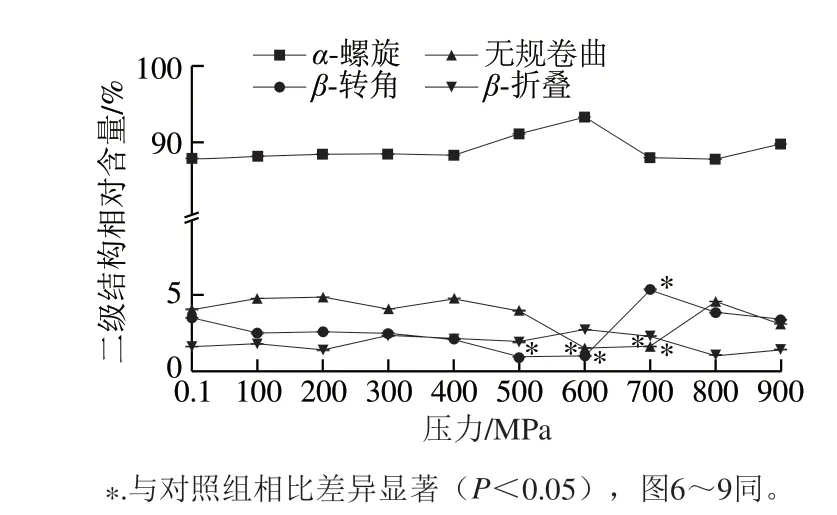
图 4 不同压力处理TM二级结构变化Fig. 4 Changes in secondary structures of TM treaded at different pressures
由图4可知,在100~600 MPa范围内,随处理压力升高,TM的α-螺旋相对含量增大,600 MPa时达到最大(94.8%),随后降低,但变化不大。在100~600 MPa范围内,随压力增大,β-转角相对含量呈现下降的趋势;500、600 MPa处理组与对照组相比差异显著(P<0.05);当压力大于600 MPa后,其相对含量出现上升。对于无规卷曲,100~900 MPa范围内,随压力的增大,其相对含量变化无规律性,但600~700 MPa范围内与对照组(0.1 MPa)相比差异显著(P<0.05)。随压力的增大,β-折叠相对含量变化无规律性。该检测结果与圆二色光谱法检测的结果[19]存在差异性,可能与检测方法不同有关。
2.3.2 荧光光谱检测超高压处理后TM的氨基酸微环境(三级结构)变化
由图5、表1可知,在40 ℃不同压力(0.1、100~900 MPa)下处理30 min,TM的最大发射波长的红移和蓝移变化不明显;荧光强度呈一定规律性变化。在100~600 MPa范围内,荧光强度随着压力增加逐渐减小,当压力达到600 MPa时,荧光强度最低;700~900 MPa范围内,荧光强度随压力增加而升高。荧光强度的变化主要是在不同压力条件下疏水性氨基酸的暴露或掩蔽程度不同造成的。由此可见,随处理压力的变化,TM氨基酸微环境(三级结构)发生变化,导致空间构象的变化。
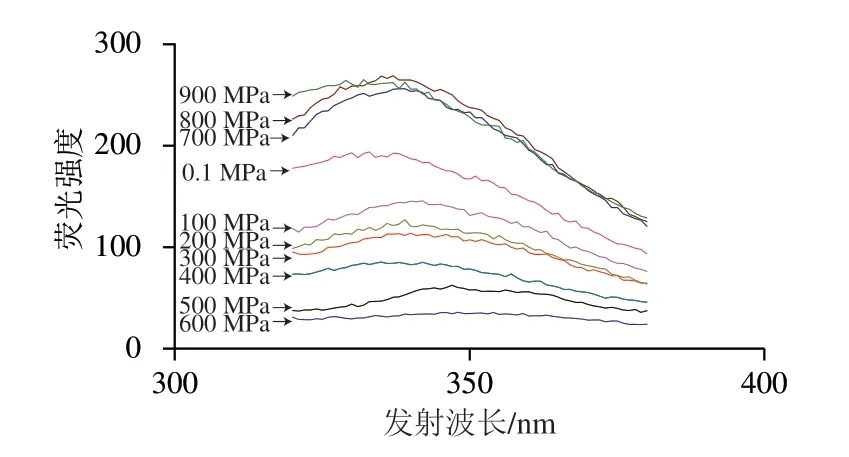
图 5 不同压力处理后的TM荧光光谱图Fig. 5 Fluorescence spectra of TM treated at different pressures
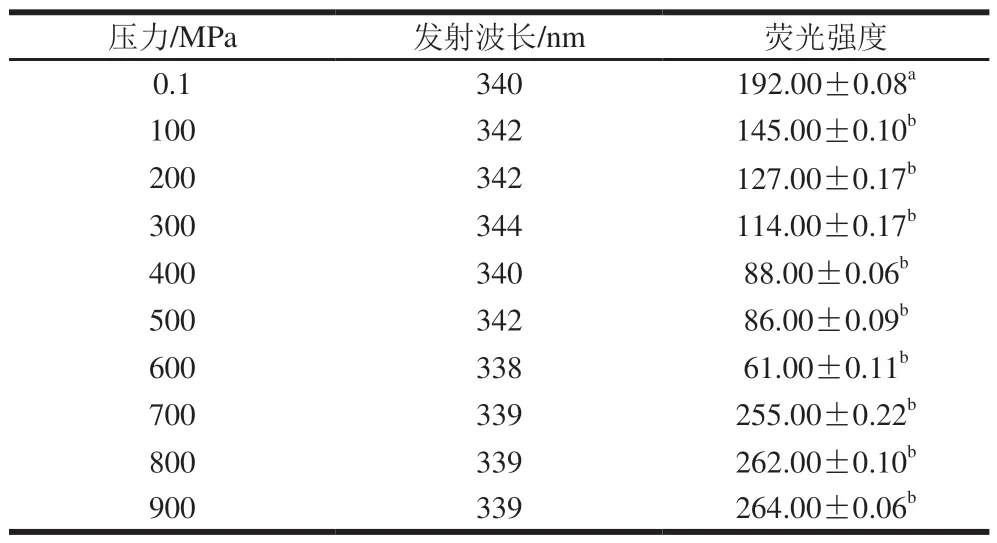
表 1 不同压力下处理TM的发射波长和荧光强度Table 1 Changes in emission wavelength and fluorescence intensity of TM treated at different pressures
2.3.3 不同压力处理引发TM的致敏性变化
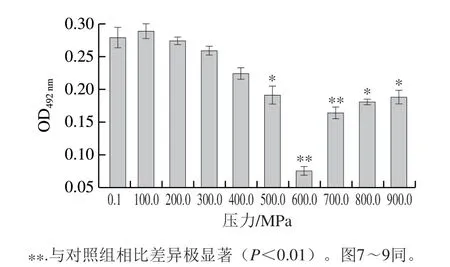
图 6 不同压力下处理对TM致敏性的影响Fig. 6 Effect of high hydrostatic pressure on allergenicity of TM
如图6所示,在100~600 MPa范围内,随着压力的增加,致敏性不断降低,600 MPa时致敏性降至最低(OD492nm=0.075)。600~900 MPa范围内,随着压力增大,OD492nm逐渐增加,但在900 MPa时,其致敏性仍然小于对照组。所以超高压处理对TM的免疫原性有一定的消减作用。这是因为TM在经过超高压处理后,蛋白质内的非共价键发生变化,引起其空间结构发生了改变,从而导致生物活性变化,体现为致敏性的变化,由于处理温度、时间和压力的不同,其结果也存在差异[18]。Long Fangyu等[19]发现经55 ℃、500 MPa处理10 min的虾TM与沸水加热组相比,其与IgE的结合能力降低了73.59%;虽然与本实验条件不同,但结果均能说明超高压能有效降低TM的致敏性。
2.3.4 TM结构变化与致敏性的关系
TM在100~600 MPa超高压处理条件下,β-转角相对含量的变化趋势与TM致敏性变化趋势有一定的相关性(图7);压力超过500 MPa后,β-转角相对含量与对照组相比差异显著(P<0.05)。

图 7 压力引发TM二级结构(β-转角相对含量)变化与致敏性的关系Fig. 7 Relationship between changes in secondary structure (β-turn relative content) of TM caused by high pressure processing and its allergenicity
超高压处理后TM的荧光强度变化趋势与其致敏性变化具有很好的相关性(图8),特别是在0.1~600 MPa范围内,变化趋势一致;但当压力大于600 MPa,其致敏性低于对照组,而荧光强度却高于对照组,这可能是由于超高压处理TM的致敏性变化是由二级和三级变化共同引起,是一个综合现象,具体原因还需要进一步研究。

图 8 不同压力处理TM荧光强度变化与致敏性的关系Fig. 8 Relationship between fluorescence intensity of TM caused by high pressure processing and its allergenicity
2.4 超高压结合酶法对南美白对虾TM致敏性消减效果的影响
2.4.1 先超高压再胰蛋白酶水解消减TM致敏性
先经不同压力处理,再经胰蛋白酶水解(酶添加量3 000 U/g、40 ℃水解30 min)后,TM致敏性和致敏性消减率的结果如图9所示,经超高压处理后,氨基酸微环境(三级结构)的变化会导致水解位点的暴露或掩蔽,从而导致水解产物出现差异,进而使得水解产物致敏性的不同。在100~600 MPa范围内,随着压力的增大,水解产物的致敏性逐渐降低,致敏性的消减率逐渐增强,在600~900 MPa范围内,随压力增加,水解产物的致敏性逐渐增大,致敏性消减率逐渐降低。

图 9 先超高压处理再胰蛋白酶水解对TM 致敏性消减率的影响Fig. 9 Effect of high pressure treatment followed by trypsin hydrolysis on allergenicity reduction of TM
与对照组(0.1 MPa处理组)相比,压力在100~200 MPa范围内,水解产物致敏性相对增加,且100 MPa处理组与对照组差异显著(P<0.05);压力在300~600 MPa范围内,水解产物的致敏性小于对照组,且500~600 MPa下处理后水解产物的致敏性显著低于对照组;当压力在700~900 MPa范围内,水解产物的致敏性又有所升高,但与对照组相比无显著差异(P>0.05)。从结果可知,在500~600 MPa范围内处理TM,再用胰蛋白酶水解,可以显著降低水解产物致敏性(600 MPa处理后的水解物致敏性消减率为96%),其原因可能是由于在此压力范围内处理后再用酶水解,更有利于TM线性表位的消除。
2.4.2 超高压下胰蛋白酶水解TM
在有利于提高酶活力的超高压条件(温度40 ℃、压力200 MPa、保压时间30 min)下水解TM(TM质量分数3%、酶添加量3 000 U/g、压力200 MPa、温度40 ℃、水解时间30 min),检测其致敏性变化。结果显示,在该条件下TM水解产物的OD492nm为0.006±0.001,致敏性消减率为98%,较常压下TM水解产物的致敏性消减率(89%)(图2)提高了9%。
针对该差异的原因,对常压下的水解产物和超高压下的水解产物用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分析(图10),从泳道4和5的比较可以发现,在超高压下酶水解TM效果更好,水解更加彻底。但由于TM水解后线性表位的分子质量较小,在SDS-PAGE中无法体现,因此在两种条件下的水解产物能够引发致敏性的线性表位残留情况还需要进一步分析。

图 10 超高压下虾蛋白水解物SDS-PAGE图Fig. 10 SDS-PAGE analysis of TM hydrolysates under high pressure
2.5 常压下酶水解产物与超高压下酶水解产物线性抗原表位残留

表 2 常压下TM水解物中的肽段种类Table 2 Peptides in trypsin hydrolysates under the normal pressure
为了进一步研究TM在常压下水解产物和超高压下水解产物在致敏性方面的差异,将2.3.2节中水解获得的产物采用质谱仪进行片段检测。如表2所示,常压下TM水解产物中共有11 类233 个片段,片段长度分布见图11;超高压下TM水解产物中共有11 类90 个片段(表3),片段长度分布见图12。
从线性抗原表位消除效果分析,目前公开发表的资料显示,国内学者预测虾的TM线性抗原表位有10 个[31],国外学者预测的TM线性抗原表位有9 个[32]。常压下TM水解产物片段种类(11 类、233 个片段)(表2)中,与国内学者预测的线性抗原表位相比,残留4 个线性抗原表位(表2中波浪线片段),线性抗原表位消减率为60.0%,在233 个水解片段中,含有线性抗原表位的片段共12 个(表2中括号外数值);与国外学者预测线性抗原表位相比,残留线性抗原表位3 个(表2中下划线片段),消减率为66.7%,在233 个水解片段中,含有线性抗原表位的水解片段7 个(表2中括号内数值);参考国内和国外学者预测的线性抗原表位,其线性抗原表位的消减率为60.0%~66.7%。

图 11 常压下TM水解物中的肽段长度分布Fig. 11 Peptide length distribution in TM hydrolysate under normal pressure
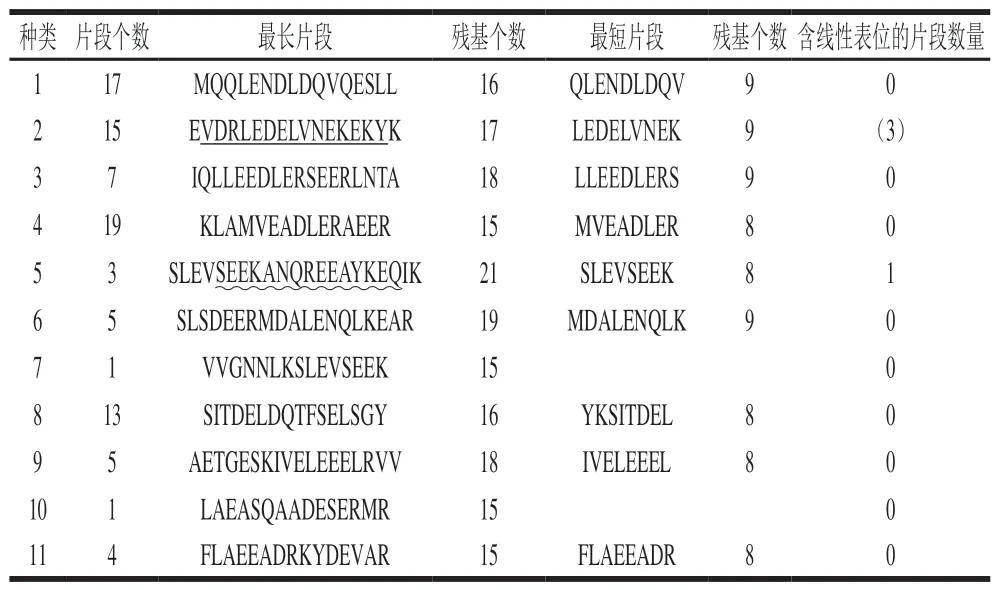
表 3 超高压下TM水解产物的肽段种类Table 3 Peptides in TM hydrolysate under high pressure
超高压下TM水解产物片段种类(11 类、90 个片段)(表3),与国内学者预测线性抗原表位相比,残留1 个线性抗原表位(表3中波浪线片段),线性抗原表位消减率为90.0%,在90 个水解片段中,含有线性抗原表位的水解片段只有1 个;与国外学者预测的线性抗原表位相比,残留1 个线性抗原表位(表3中下划线片段),表位消减率为88.9%,在90 个水解片段中,含有线性抗原表位的水解片段只有3 个(表3中括号内数值);参考国内和国外学者预测的线性抗原表位,其线性抗原表位消减率为88.9%~90.0%。因此,从线性抗原表位消减效果分析,超高压下水解TM,更有利于其线性抗原表位的消除。
比较TM水解产物片段的氨基酸残基数量,在常压下TM水解产物的233 个片段中,含8~16 个氨基酸残基的片段数量占76.8%,大于16 个氨基酸残基的片段数量占23.2%(图11);在超高压下TM水解产物的90 个片段中,含8~16 个氨基酸残基的片段数量占93.3%,大于16 个氨基酸残基的片段数量占6.7%(图12)。因此,TM在超高压下水解,产物的片段小,水解较彻底,更有利于线性抗原表位的消除。
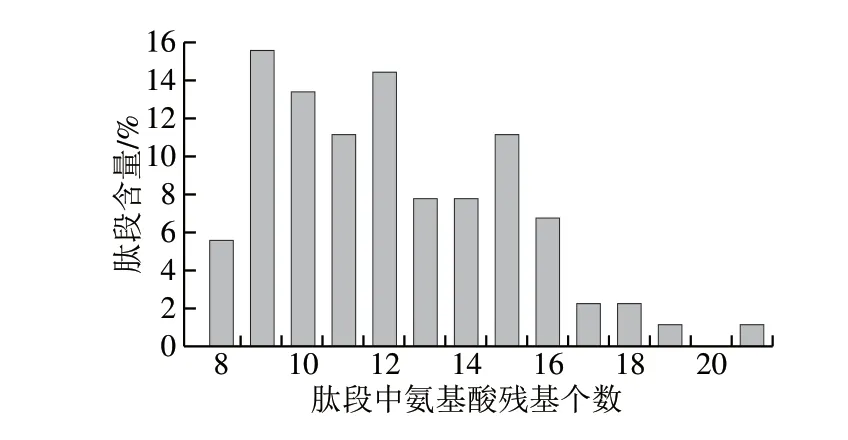
图 12 超高压下TM水解物中的肽段长度分布Fig. 12 Peptide length distribution in TM hydrolysate under high hydrostatic pressure
3 结 论
TM是虾的主要过敏原,采用常压下酶水解或超高压处理,其致敏性消减效果相对较差。采用超高压与酶水解相结合的方法,即超高压下酶水解TM,在较低压力、适宜温度和酶与底物比下进行处理,不仅可以提高酶活力,提高水解效率,而且水解彻底,更有利于线性表位的消除,进而提高致敏性的消减效率。

