关节镜下微创跟骨成形术治疗Haglund 综合征的临床疗效
张程,边劲松,曹希武,史博,郑国涛,谢晨学
(沧州市人民医院 骨一科,河北 沧州 061000)
Haglund 畸形由瑞典外科医生PATRICK 于1928年首次报道[1],常见于20 ~40 岁的女性,单发也可双侧同时发病。Haglund 畸形是指跟骨后上方的异常骨性突出,常引起跟骨后疼痛性滑囊炎,Haglund 畸形引起相应症状即可称为Haglund 病或Haglund 综合征,是造成后踝疼痛的原因之一。多数患者经保守治疗后症状可缓解,而对保守治疗无效的患者需要考虑手术治疗。传统手术方式为切开手术,但并发症较多,临床满意度为50%~76%。近年来,随着内镜技术的快速发展,越来越多的学者采用关节镜手术治疗Haglund 综合征,取得了满意的临床效果[2]。笔者对15 例Haglund 综合征患者行关节镜微创跟骨成形术治疗,取得良好的效果。现报道如下:
1 资料与方法
1.1 一般资料
回顾性分析2015年6月-2017年7月本科采用关节镜微创跟骨成形术治疗的确诊为Haglund 综合征的患者 15 例。其中,男 5 例,女 10 例,年龄 20 ~ 47 岁,平均35.6 岁,左侧7 例,右侧8 例。所有病例资料来源于本院病案信息科,所有患者术前行患侧踝关节X线、CT 和磁共振成像(magnetic resonance imaging,MRI)检查。术后随访时间12 ~24 个月,平均17 个月。纳入标准:①足运动时后踝疼痛,休息后缓解,后足压痛,背伸时加重;②符合Haglund 综合征影像学诊断标准[a:跟骨外倾角Fowler-Phillip ≥75°;b:斜平行线(parallel pitch line,PPL)阳性(图1A);c:CT 及MRI 显示,跟骨后上突均有异常隆起和跟腱下滑囊积液(图1B);符合c 的同时至少合并a、b 中的一条];③经6 个月保守治疗无效的患者。排除标准:跟腱钙化或变性的患者;合并其他严重疾病不能耐受手术的患者。本研究经沧州市人民医院伦理管理委员会批准通过,研究对象均签署知情同意书。
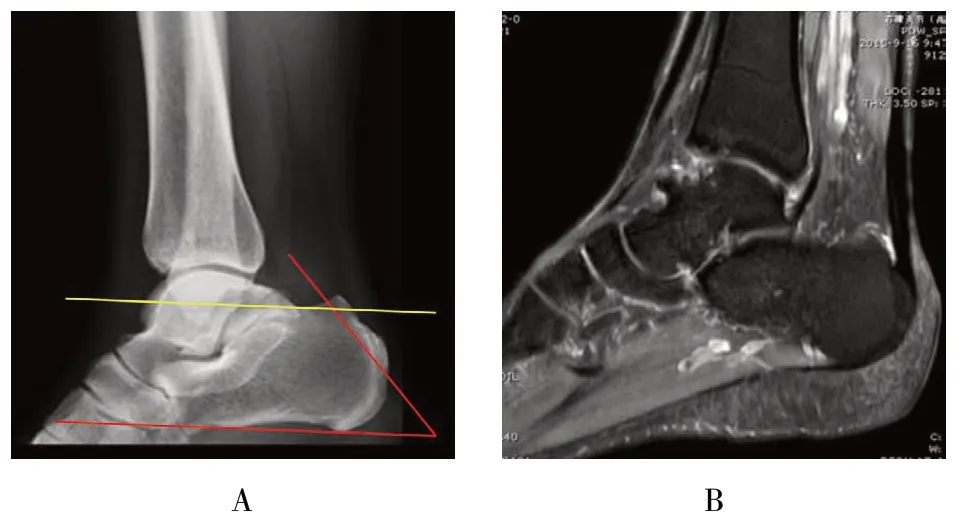
图1 Haglund 综合征的术前影像表现Fig.1 Preoperative imaging of Haglund syndrome
1.2 手术方法
麻醉成功后,患者俯卧手术床上,患侧大腿根部捆绑止血带(60 kPa),双足置于手术床板之外,术前用记号笔做好手术标记,常规消毒铺巾。首先,以穿刺针定位跟骨后方Haglund 畸形,沿预先标记好的跟腱旁入路进入,使用直径4.0 mm 的内镜,建立外侧通道后,垂直切开皮肤,用直钳分离周围软组织。内侧通道在已建立的后外侧通道中用内镜直视下建立。先用针头确认方向,切开5.0 mm 皮肤后,用蚊式钳钝性剥离周围软组织直至后踝,取出蚊式钳,内侧入路与外侧入路交替使用3.5 mm 的动力刨刀和等离子刀清理跟腱前方滑囊,注意保护跟腱。清理完成后,暴露跟骨后方异常凸起(Haglund 畸形),背伸踝关节可见跟骨后上突与跟腱发生撞击,用磨钻将骨凸逐渐磨平,刨刀吸出游离组织及骨碎屑,等离子电刀彻底止血。在“C”型臂X 线透视下确认跟骨后方Haglund 畸形消失,从一侧通道向斜前方置入引流管一条,闭合创口。见图2。

图2 关节镜下Haglund 畸形切除术Fig.2 Arthroscopic surgery of Haglund deformity
1.3 术后处理
术后弹力绷带加压包扎1 周,麻醉减退后即可进行足趾运动和股四头肌收缩锻炼,引流管于术后24 h去除,去除引流管后可拄拐下地,但患肢不负重,复查术后X 线片和三维CT。术后2 周拆除缝线后即可部分负重行走,术后6 周完全负重行走,术后3 个月恢复日常生活和开始运动。
1.4 评价方法
所有患者术前X 线测量跟骨外倾角Fowler-Phillip 和绘制斜平行线PPL,并进行评估。随访时,复查术后3 和12 个月X 线片和术后3 个月MRI,并评估术前、术后3 和12 个月的美国足踝外科协会(American Orthopaedic Foot and Ankle Society,AOFAS)后踝关节评分[3]和视觉模拟评分(visual analogue scale,VAS)[4]。
1.5 统计学方法
采用SPSS 22.0 统计软件进行统计学处理,计量资料以均数±标准差(x±s)表示,术前和术后数据比较使用配对t 检验,P <0.05 为差异有统计学意义。
2 结果
所有患者均手术顺利,无神经损伤、创口感染、创口不愈合等并发症发生,15 例患者均获得随访,无1 例失访,随访时间12 ~24 个月,平均17 个月。术前术后三维CT 重建图片见图3。术后12 个月随访时均恢复至正常运动水平,踝关节背伸、跖屈不受影响。术前X 线测量Fowler-Phillip 角,15 例患者中12例小于75°,仅3 例超过75°,所有患者的跟骨后上凸均高出PPL,术后所有患者PPL 变为阴性,见图4。AOFAS 后踝关节评分术前(68.1±2.7)分,术后3 个月(79.5±3.6)分,术后12 个月达到(92.7±4.1)分,术后较术前评分明显提高,术后12 个月和术后3 个月比较,差异有统计学意义(P<0.05);而VAS 评分术前(6.1±0.7)分,术后3 个月(3.5±1.3)分,术后12 个月降至(1.9±0.8)分,术后较术前评分明显降低,术后12 个月和术后3 个月比较,差异有统计学意义(P<0.05)。见附表。
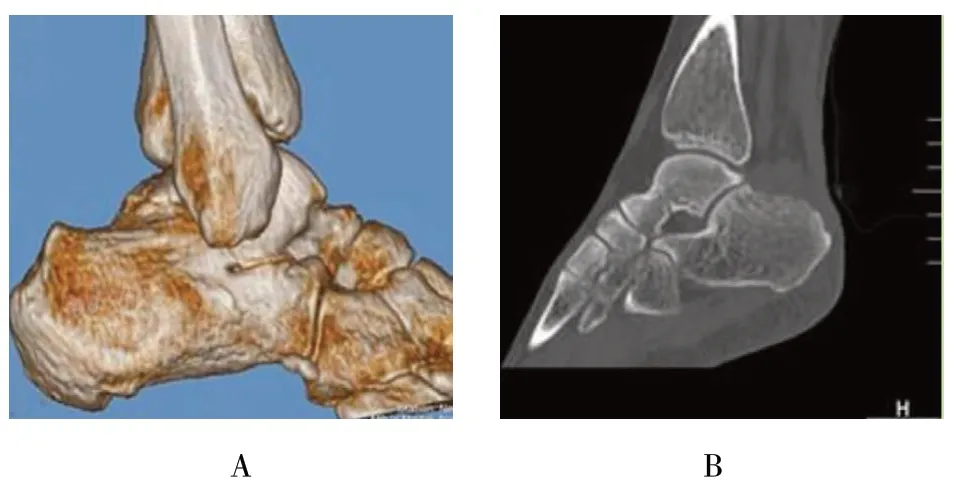
图3 Haglund 综合征的术前和术后三维CT 重建比较Fig.3 Preoperative and postoperative 3D CT of Haglund syndrome
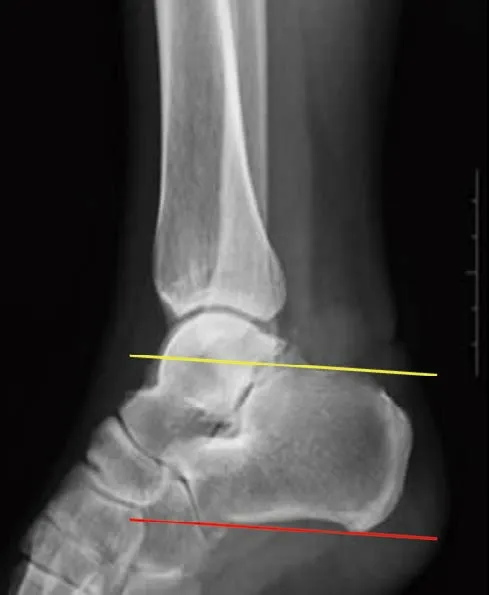
图4 Haglund 综合征的术后X 线表现Fig.4 Postoperative X-ray of Haglund syndrome
附表 术前、术后3 和12 个月AOFAS 后踝关节评分和VAS 评分比较 (分,±s)Attached table Comparison of AOFAS hindfoot score and VAS score before, 3 months after and 12 months after operation (score,±s)
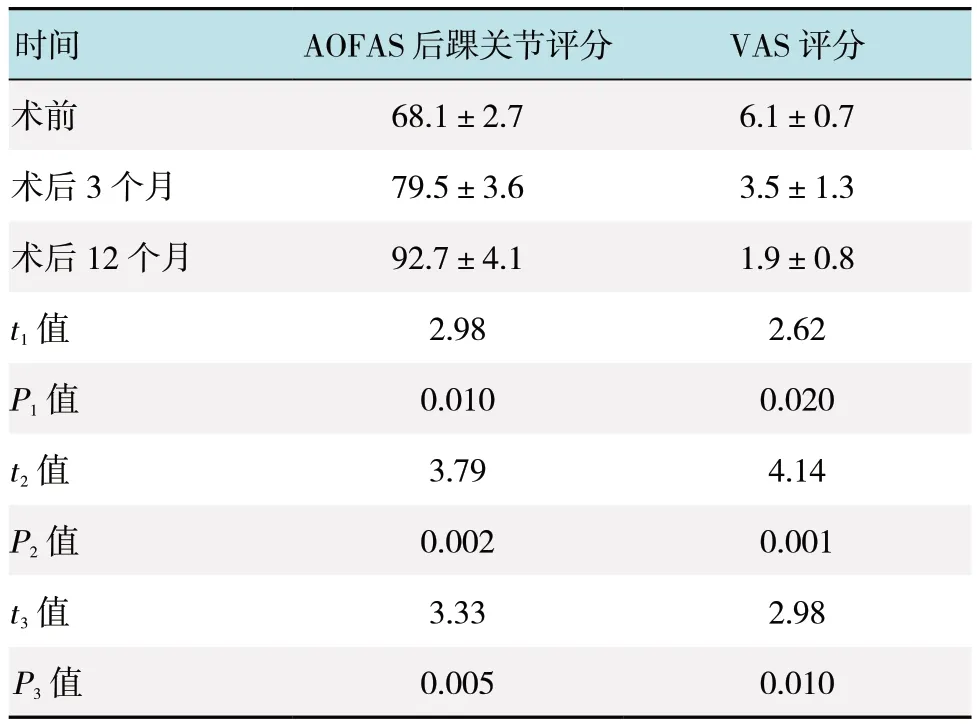
附表 术前、术后3 和12 个月AOFAS 后踝关节评分和VAS 评分比较 (分,±s)Attached table Comparison of AOFAS hindfoot score and VAS score before, 3 months after and 12 months after operation (score,±s)
注:t1 值和P1 值是术后3 个月与术前比较统计值;t2 值和P2值是术后12 个月与术前比较统计值;t3 值和P3 值是术后3 个月与术后12 个月比较统计值
时间 AOFAS 后踝关节评分 VAS 评分术前 68.1±2.7 6.1±0.7术后 3 个月 79.5±3.6 3.5±1.3术后 12 个月 92.7±4.1 1.9±0.8 t1 值 2.98 2.62 P1 值 0.010 0.020 t2 值 3.79 4.14 P2 值 0.002 0.001 t3 值 3.33 2.98 P3 值 0.005 0.010
3 讨论
通过X 线、CT、MRI 检查以及临床体征诊断Haglund 综合征准确度较高,持续性跟骨后方水平和外侧的肿胀疼痛、主动和被动活动时足后跟痛(跟骨撞击试验阳性)是诊断Haglund 畸形的主要依据。目前,最常用的X 线测量指标有Fowler-Phillip 角(跟骨外侧角)和PPL。Fowler-Phillip 角指跟骨外后上斜面和跟骨下表面之问的夹角,其正常值范围为40 ~69°,通常认为≥75°为异常,提示Haglund 畸形。但学者 BULSTRA 等[5]也证实,Fowler-Phillip 角和Haglund 畸形并无相关性,假阴性率较高,他的研究中,Fowler-Phillip 角假阴性率高达86%~100%。PPL 是以连接跟骨前结节和内结节的切线为基线,以跟距关节后缘到基线的垂直距离作一条平行于基线的上线,如跟骨后上结节在该线以上为PPL 阳性,反之为阴性。与Fowler-Phillip 角相比,PPL 对预测Haglund 畸形及跟后痛的灵敏度更高[6]。MRI 检查可观察跟腱和滑囊的显影,了解跟腱末端的炎症程度、是否有滑囊和钙化灶。因此,MRI 可提供诊断依据并指导手术方案设计[7]。本研究15 例患者中,12 例Fowler-Phillip角小于75°,仅3 例超过75°,假阴性率达80%,但所有患者的跟骨后上结节均高出PPL,阳性率达100%。笔者认为,在诊断Haglund 综合征时,除临床症状和体征外,结合MRI 表现是必要的,MRI 表现同样也是判断手术指征的重要指标,对于合并跟腱钙化或者变性的患者,单纯行跟骨成形术往往效果不够理想。另外,由于Fowler-Phillip 角假阴性率较高,相比较而言,PPL 在诊断中比Fowler-Phillip 角更有意义。
对于Haglund 畸形的治疗首先保守治疗为主,包括:减少负荷、避免鞋子和足跟后部的摩擦,非甾体抗炎药,局部封闭,冲击波治疗。对于严格保守治疗6 个月以上无效的患者主张手术治疗,手术治疗方式包括跟骨后上结节切除和跟骨截骨术。跟骨后上结节切除术又可分为开放式切除和关节镜手术。国内于2010年才有关于Haglund 畸形的文献报道,方法多以开放手术为主[8]。传统开放式手术切除包括内侧入路[9]、经跟腱劈开入路[10]和外侧入路[11]。这种手术方式操作简单、容易被临床医生掌握,但是手术并发症相对较多,临床效果并不理想。关于开放式手术的效果,国内外文献报道不一,症状改善率在50%~76%[2]。PHISITKUL 总结了切开手术治疗Haglund 综合征的并发症,包括:软组织液化,跟腱撕脱骨折,皮神经损伤,瘢痕导致的疼痛不适等,是导致切开手术优良率低的原因[12]。由于切开手术并发症较多,患者手术满意度不高。
关节镜下跟骨成形术创伤小、恢复快,创口并发症较少,软组织愈合优良,有利于患者早期活动,该手术尤其适合有一定关节镜基础的外科医生[13]。但关节镜手术的缺点在于:不如切开手术容易掌握,需具备一定关节镜经验的手术医生操作,要尽量减少并发症的发生;而且,跟腱病变在镜下不能清晰显示,需严格掌握手术适应证。JEROSCH 等[14]采用关节镜行跟骨成形术治疗Haglund 综合征患者,3 例因术前存在跟腱止点钙化导致内镜手术失败,改行切开手术治疗,该作者认为,跟腱止点钙化变性是关节镜手术的禁忌证,建议行切开手术治疗。LOHRER 等[15]也认为,对合并跟腱病变的Haglund 综合征患者来说,切开手术是唯一的选择。本研究严格掌握手术适应证,并未纳入跟腱钙化或者变性的患者,术后效果良好,无失败病例。跟骨截骨术主要用于骨性畸形严重、跟骨高度倾斜、合并高弓足畸形或用于跟骨骨骺未闭的青少年,能降低跟腱张力[16]。
本研究显示,术后3 个月时患者AOFAS 后踝关节评分和VAS较术前均有所改善,差异有统计学意义,但仍未恢复至正常水平。这主要是因为术后3 个月内患者仍处于炎症减退期和软组织及骨愈合期,未从事体力劳动及正常运动,随着患足疼痛的逐渐好转,多数患者于术后3 ~6 个月开始从事体力劳动,并且逐渐恢复正常运动。所有患者术后12 个月AOFAS 后踝关节评分和VAS 较术后3 个月恢复效果更加显著,基本达到正常水平。笔者认为,经关节镜微创跟骨成形术治疗的Haglund 综合征患者,可以在术后3 个月逐渐开始正常劳动和运动,术后1年左右基本能恢复至正常人水平。
本研究术中未选择2.7 mm 内镜,虽然2.7 mm 关节镜细小,但笔者认为,4.0 mm 关节镜具有更好的视野,且操作性与2.7 mm 关节镜无明显差别,这与眭杰等[17]的观点相同。本组患者优良率较高,笔者结合自身经验总结以下原因:①关节镜可以处理跟骨后上突和滑囊,但跟腱病变镜下不能清晰显示,手术适应证需要严格掌握,本研究将跟腱钙化或者变性的患者排除在外;②由于足部细菌较多,注意无菌操作,彻底消毒,术前标记入路,术中精细操作,手术全程避免损伤跟腱,彻底清除Haglund 畸形;③术中尽量将组织碎屑清理干净,残留物可能导致术后疼痛,等离子电刀有效止血,减少术后出血,术后放置引流管;④样本量小及随访时间较短,这也是影响总有效率的一个重要原因。
综上所述,关节镜微创跟骨成形术治疗Haglund综合征临床效果显著,创口小、恢复快,可以逐渐推广至门诊手术室进行,但需严格掌握手术适应证,以提高术后满意度。本研究不足之处为样本量小,仍需大样本对照研究和长期随访。

