腹腔镜手术与开放手术对Ⅱ期和Ⅲ期右侧结肠癌患者预后的影响
应东建,马祥祥,阮一,周新华
(1.宁波市医疗中心李惠利东部医院 肝胆胰外科,浙江 宁波 315040;2.宁波市象山县中医医院 普外科,浙江 宁波 315700)
结肠癌是我国高发的消化道恶性肿瘤,因为受到西方饮食习惯的影响,发病率呈指数增长。自从JACOBS 等[1]在1991年报道了腹腔镜结肠切除术后,许多研究探讨了腹腔镜手术的可行性。已有研究[2]证实,腹腔镜手术的长期疗效不亚于开腹手术。尽管许多数据仍有待统计学验证,仍有研究[3]认为,腹腔镜手术比开腹手术更具优势。腹腔镜操作者必须克服学习曲线,但是学习曲线一旦得到克服,腹腔镜手术的优势将得到多方面的体现。我院2009年引入了腹腔镜手术,目前腹腔镜结肠癌手术已成为我院开展较好的治疗方法。本研究探讨腹腔镜结肠癌手术和开腹手术的长期肿瘤学疗效差异,并分析短期和长期疗效与腹腔镜经验学习曲线的关系。
1 资料与方法
1.1 一般资料
回顾性分析2013年1月-2014年12月在宁波市医疗中心李惠利东部医院接受结肠癌根治术的200例Ⅱ期或者Ⅲ期结肠癌患者的临床资料。纳入标准:肿瘤位于盲肠、升结肠以及结肠肝曲;可耐受开腹手术或腹腔镜手术,心肺功能正常,术前美国麻醉医师协会(American Society of Anesthesiologists,ASA)评分属1 ~3 级;择期手术;自愿加入本研究。排除标准:结肠癌Ⅳ期患者;肿瘤侵犯邻近脏器组织;合并急性肠梗阻或穿孔,需急诊手术;既往有开腹手术史,考虑腹腔镜下操作困难。将200 例患者分为3 组:①腹腔镜手术尚未在我院开展时的患者(n=58);②第一台腹腔镜手术至学习曲线未克服之前在我院治疗的患者(n=27);③学习曲线克服之后的患者(n=115)。患者年龄25 ~78 岁,平均(61.9±12.6)岁。3 组患者一般资料见表1。
1.2 手术方法
仰卧分腿位,术者位于患者两腿之间,扶镜助手位于患者左侧,手术助手位于患者右侧,采用五孔法。全面探查,除外有无同时性肿瘤,明确肿瘤位置、肠管浆膜浸润情况和与肿瘤周围组织的关系,决定手术切除范围。选择尾侧中间入路,牵拉绷紧结肠系膜,定位肠系膜上静脉(superior mesenteric vein,SMV)血管蒂和回结肠血管,始终以SMV 为导向,自下而上。超声刀打开回结肠血管下缘的结肠系膜,进入右结肠后间隙,继续向头侧扩展,指引结肠系膜前方的解剖。解剖裸化回结肠血管和起源处的SMV,结扎回结肠血管后,向头侧裸化SMV,沿右结肠后间隙向头侧和右侧游离结肠系膜,拓展右侧Toldt’s 间隙,逐渐暴露十二指肠降部、胰腺钩突和胰头。沿SMV 向头侧追踪可定位并结扎右结肠动脉,继续向头侧游离,于横结肠系膜根部下方的胰头前方找到胃结肠静脉干,根部游离各分支,离断右结肠静脉。扩大右半结肠切除术需离断胃网膜右静脉,保留胰十二指肠上前静脉或其他属支。于肿瘤远端10 ~15 cm 处,紧贴胃大弯血管弓下方,切开胃结肠韧带,进入小网膜囊。向右侧游离肝结肠韧带、横结肠和结肠肝曲。向下翻转横结肠,紧贴横结肠系膜后表面向下游离,使横结肠后间隙和前面解剖的右结肠后间隙在胰腺前方处贯通。向近心端游离末段回肠至少10 cm。由回盲部开始,切开外侧结肠系膜与腹膜愈着形成的“黄白交界线”直至肝曲,沿升结肠及其系膜后表面向头侧及中线侧游离,完成右半结肠的游离。根据肿瘤大小,于右侧中上腹做长约4 cm 正中切口,保护切口,25 mm 管状吻合器或手工行回肠横结肠端侧吻合。
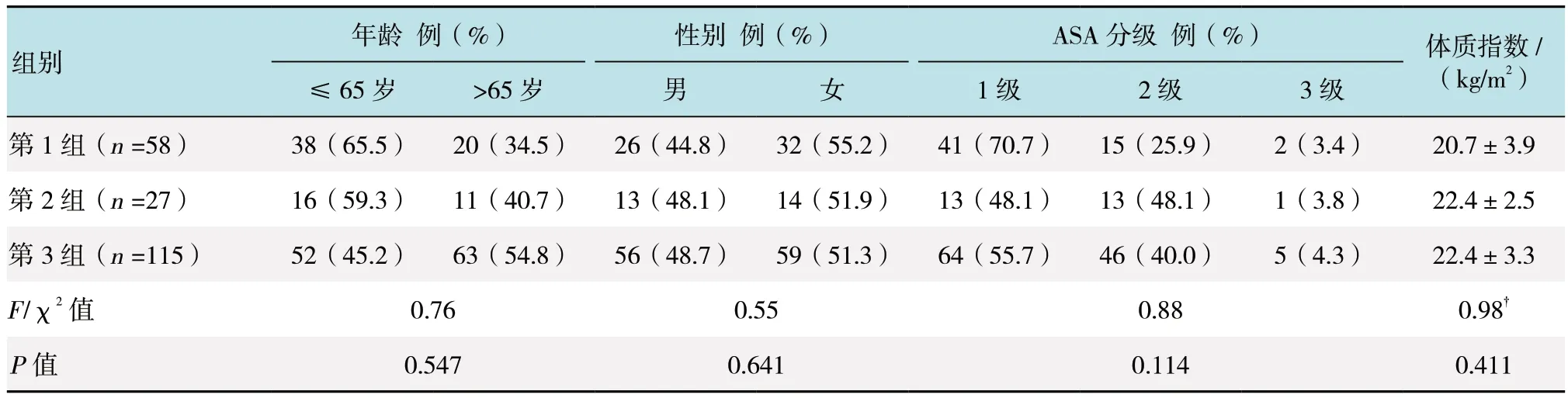
表1 3 组患者一般资料比较Table 1 Comparison of general information among three groups
1.3 随访情况
术后第1年每3 个月随访一次,此后每6 个月随访一次,直至术后5年,5年后每年随访一次。本组患者的末次随访时间为2018年12月。随访内容包括检测血红蛋白、肝功能和癌胚抗原(carcinoembryonic antigen,CEA)水平,行胸部X 线、肝脏超声检查。每年行CT 或结肠镜检查一次。
1.4 统计学方法
数据处理采用SPSS 19.0 统计软件,计量资料以均数±标准差(±s)表示,两组比较用t检验,3 组间计量资料比较采用方差分析,计数资料以率(%)表示,比较采用χ2检验,P<0.05 表示差异有统计学意义。找出对患者3 和5年总生存率(overall survival,OS)和无病生存期(disease-free survival,DFS)有影响的因素,单因素分析筛选出的有统计学意义的因素,继续进行多元Cox 回归模型分析,其引入检验水准为P<0.05,剔除检验水准为P>0.1,最终找出对患者3 和5年OS 和DFS 有影响的独立因素。
2 结果
2.1 3 组患者手术情况比较
第2 组和第3 组手术时间比第1 组更长,差异均有统计学意义(P<0.05),但第3 组ICU 停留时间和住院时间短,差异均有统计学意义(P<0.05)。见表2。
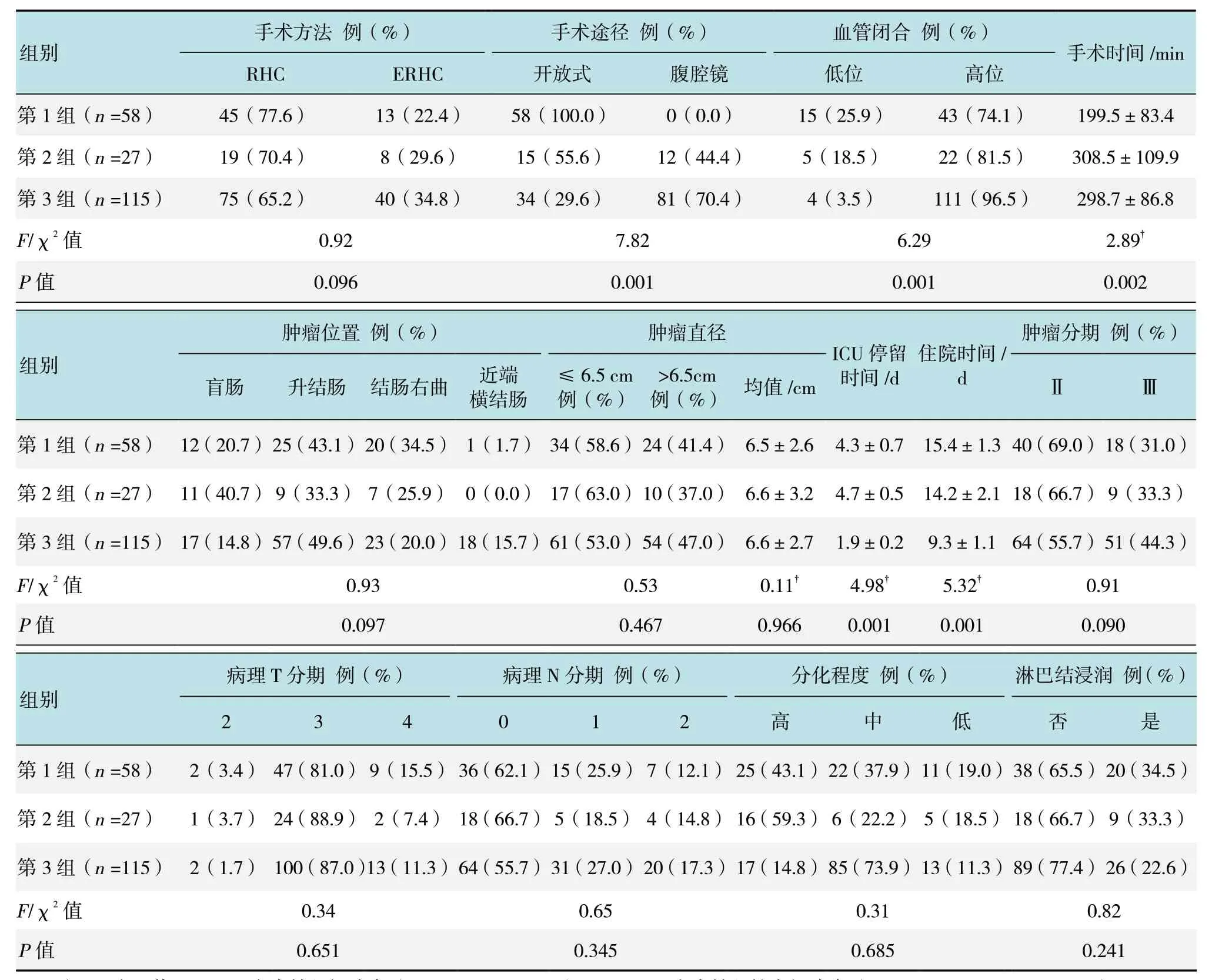
表2 3 组患者手术情况和肿瘤相关指标比较Table 2 Comparison of surgical status and tumor-related indicators among three groups
2.2 3组患者OS和DFS比较
2.2.1 患者OS 情况本组结肠癌患者3 和5年OS分别为74.1%和58.9%。第1 组、第2 组和第3 组的 3年 OS 分 别 为 86.1%、70.3% 及 77.2%, 差 异无统计学意义(P=0.663),5年 OS 分别为 82.5%、66.7%及71.2%,差异无统计学意义(P=0.718)。单因素分析发现,血管闭合、肿瘤分期、分化程度、淋巴结浸润、淋巴结数量和再次手术是结肠癌患者3年OS 的影响因素;肿瘤分期、分化程度、淋巴结浸润、淋巴结数量和再次手术是结肠癌患者5年OS 的影响因素。见表3。进一步采用多元COX回归分析(表4)发现,肿瘤分期、分化程度、淋巴结浸润是结肠癌患者3年OS 和5年OS 的危险因素。
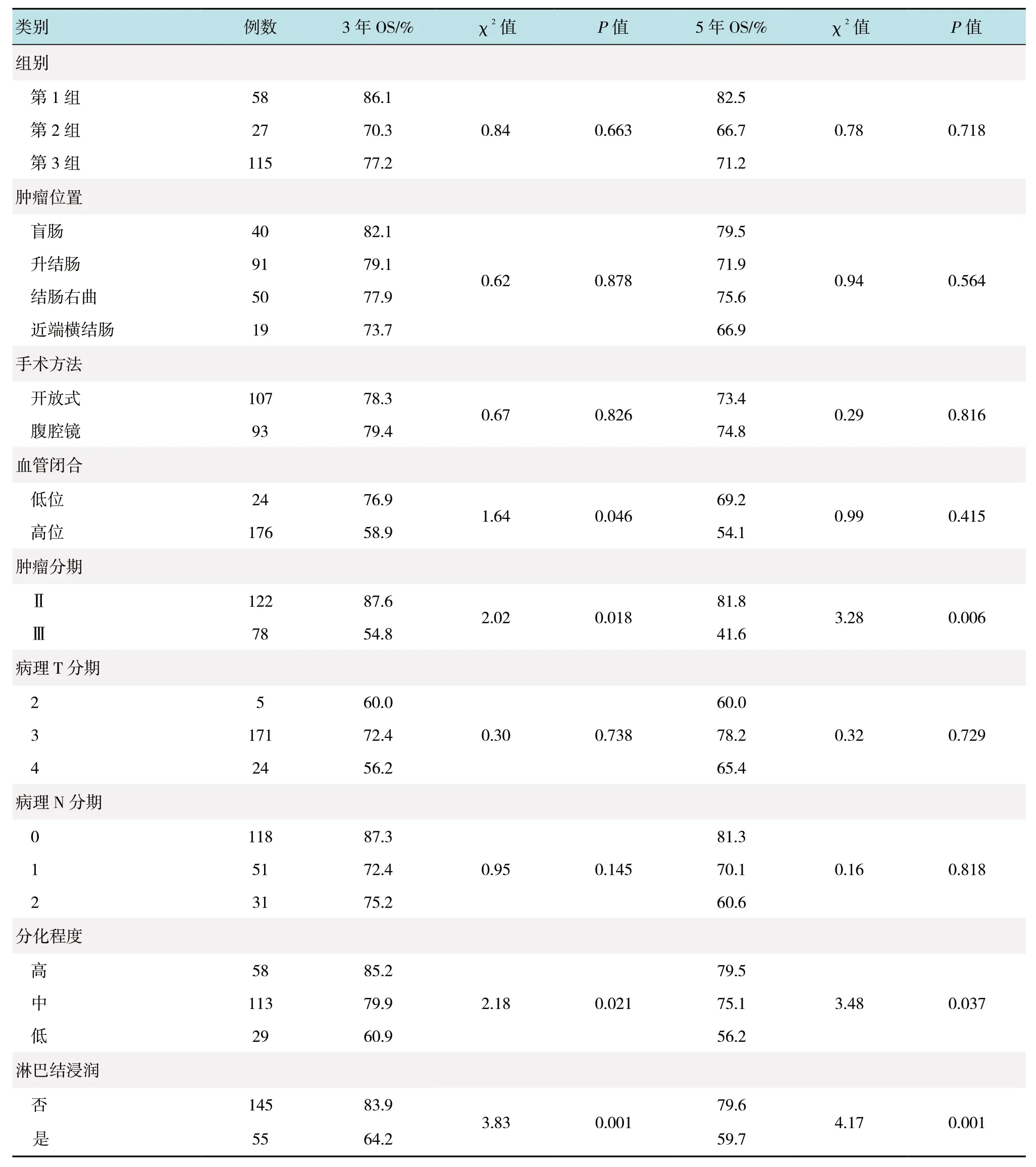
表3 结肠癌患者3 和5年OS 生存率的单因素分析Table 3 Univariate analysis of influencing factors for 3-year and 5-year survival rate in patients with colon cancer
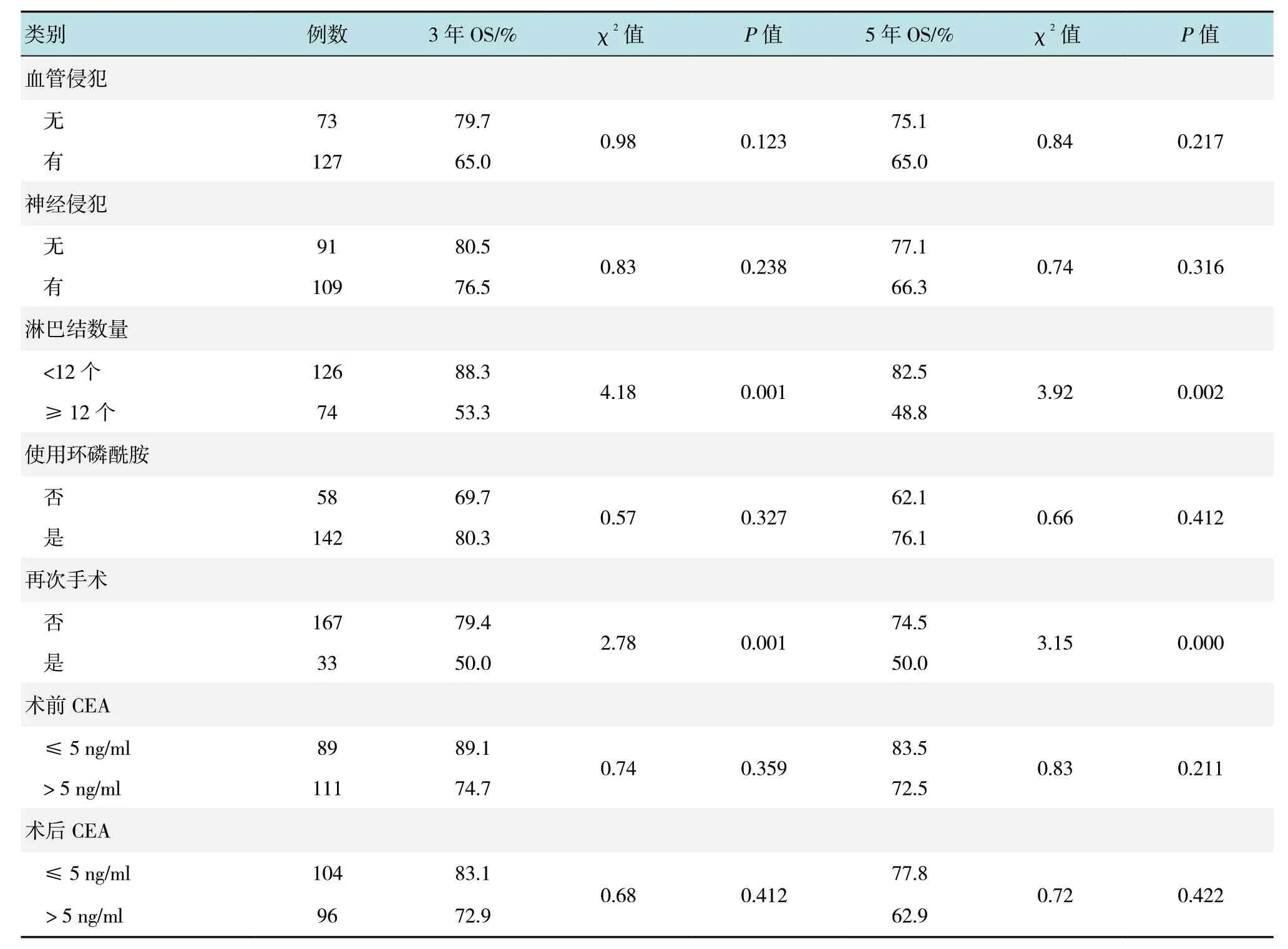
表3 续Table 3
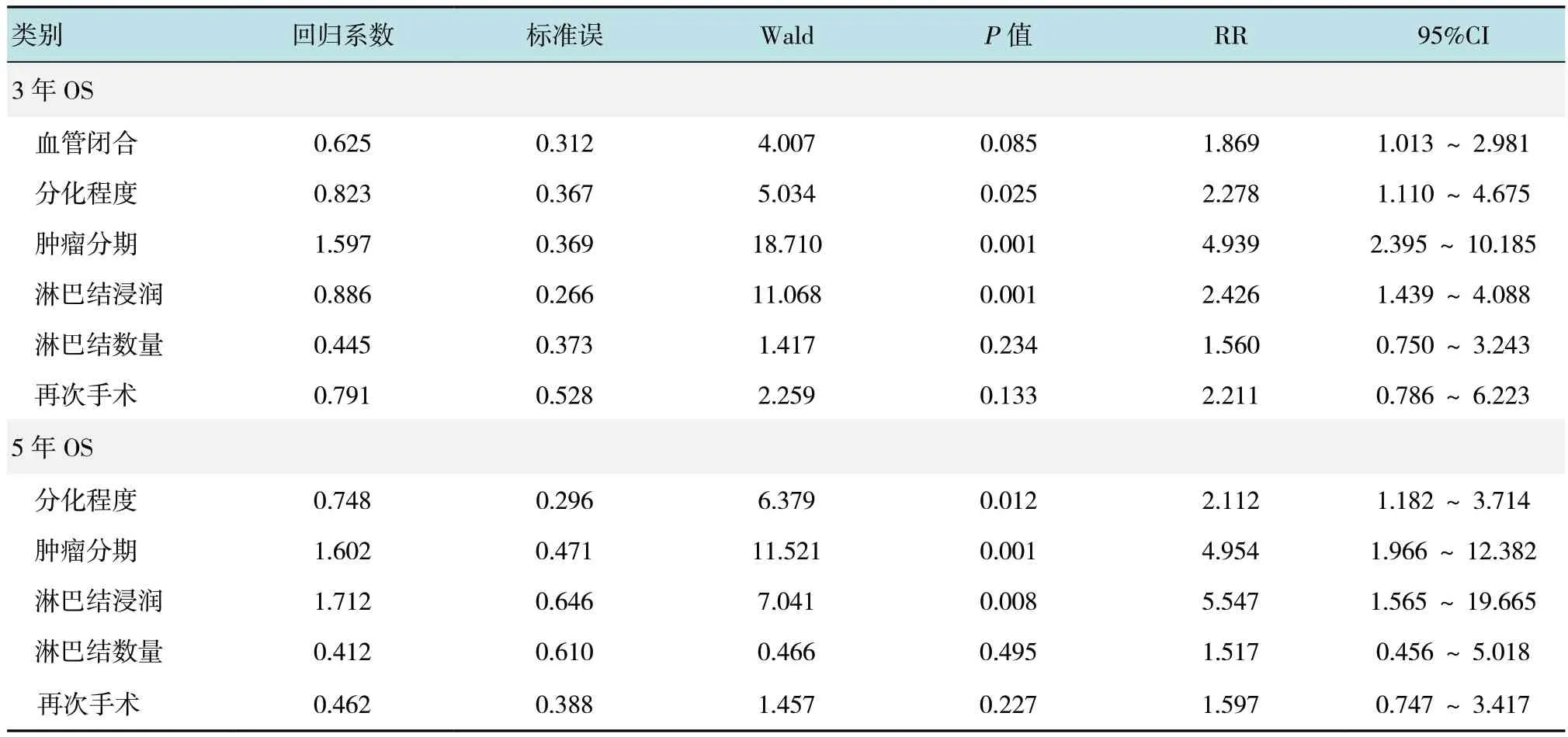
表4 结肠癌患者3 和5年OS 生存率的多元 COX 回归分析Table 4 Multivariate Cox regression analysis of influencing factors for 3-year and 5-year survival rate in patients with colon cancer
2.2.2 患者DFS 情况本组结肠癌患者3 和5年的DFS 分别为79.8%和77.2%。第1 组、第2 组和第3 组3年DFS 分别为87.5%、66.7%及82.8%,差异无统计学意义(P=0.551),5年DFS 分别为85.6%、62.9%及81.5%,差异无统计学意义(P=0.617)。单因素分析发现,肿瘤分期、分化程度、淋巴结浸润、淋巴结数量和术前CEA 是结肠癌患者3年DFS 的影响因素;肿瘤分期、分化程度、淋巴结浸润、淋巴结数量和术前CEA 是结肠癌患者5年DFS 的影响因素。见表5。进一步采用多元COX 回归分析发现,淋巴结浸润和术前CEA 是结肠癌患者3年DFS 和5年DFS的危险因素。见表6。
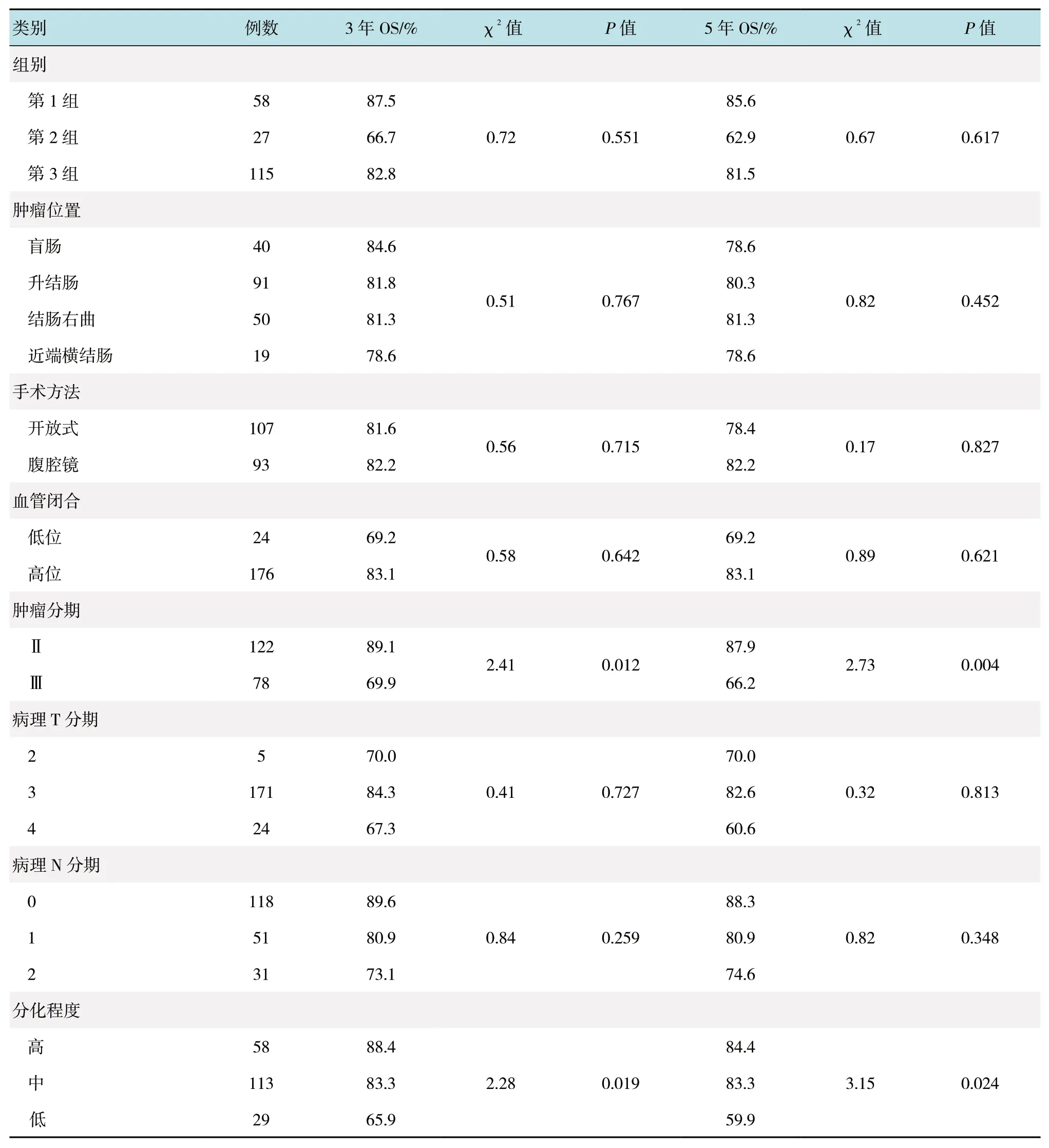
表5 结肠癌患者3 和5年DFS 的单因素分析Table 5 Univariate analysis of influencing factors for 3-year and 5-year DFS in patients with colon cancer
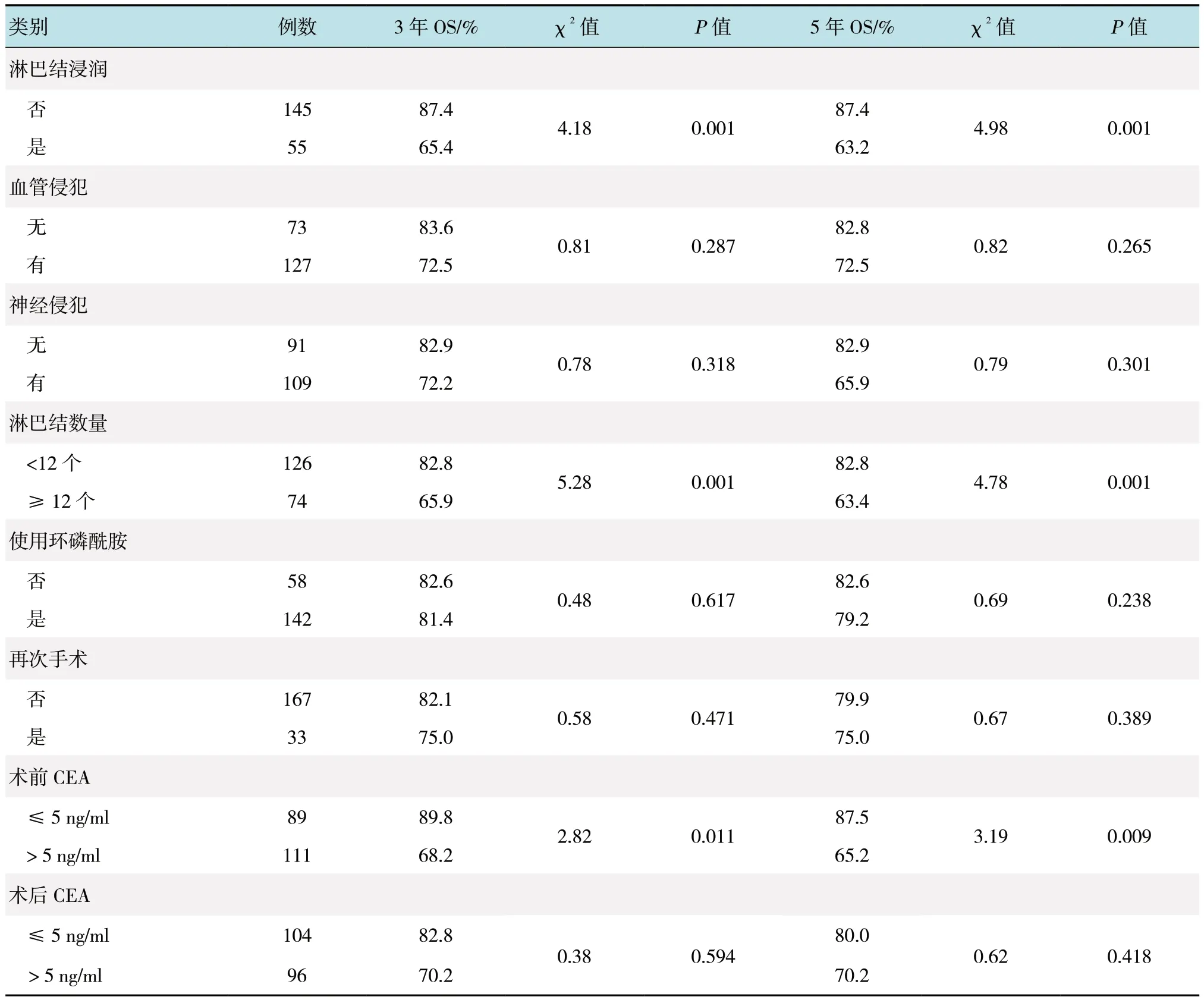
表5 续Table 5
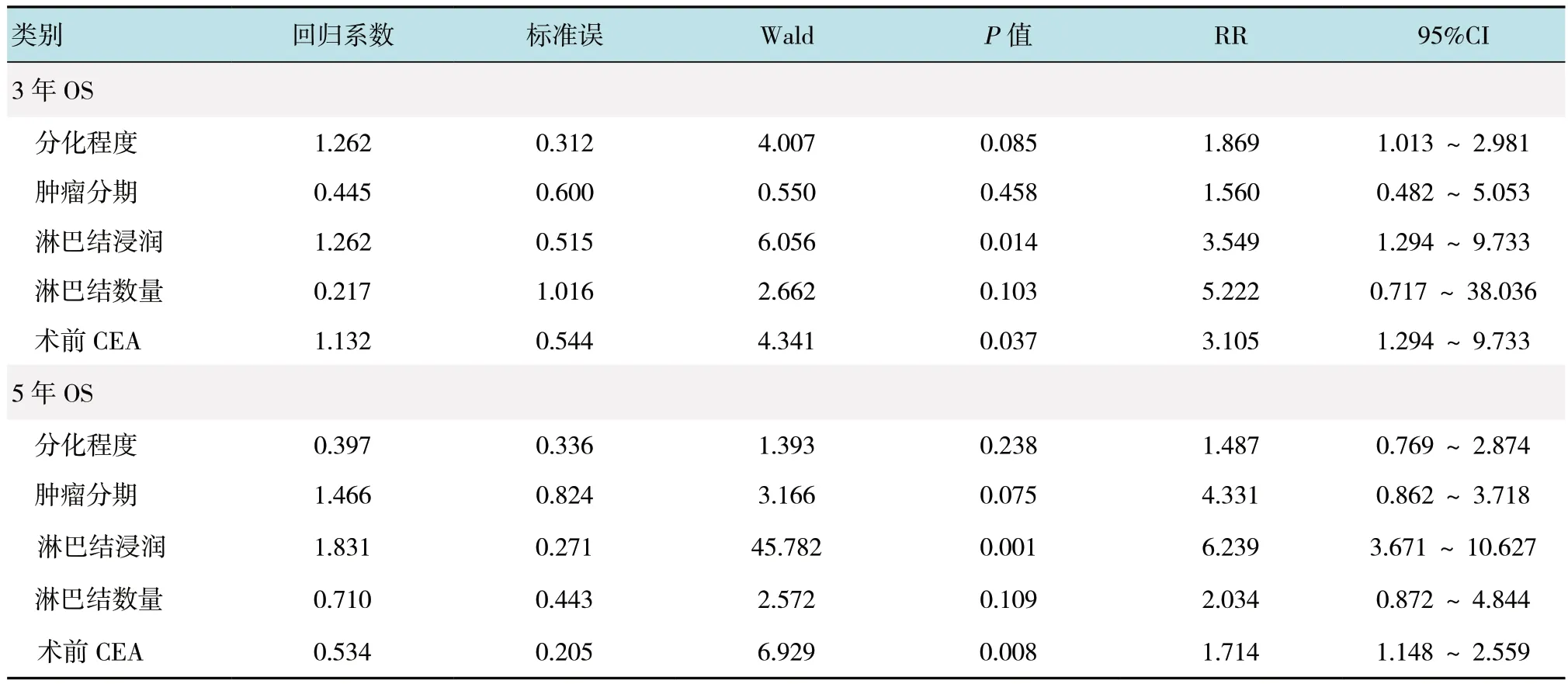
表6 结肠癌患者3年和5年DFS 的多元 COX 回归分析Table 6 Multivariate Cox regression analysis of influencing factors for 3-year and 5-year DFS in patients with colon cancer
3 讨论
相比开腹手术,腹腔镜结肠切除术具有许多优点,短期手术疗效提高,包括:止痛的需求降低,饮食恢复早,住院时间短,术后死亡率降低[4]。然而,在癌症手术中,长期肿瘤学疗效比围手术期疗效更加重要。有前瞻性的随机对照试验[5]表明,结肠癌腹腔镜手术的肿瘤学疗效不亚于开腹手术。但是,许多机构依然在考虑是否要将腹腔镜手术作为结肠癌手术的标准治疗方法,因为腹腔镜手术学习曲线较长,可能会让外科医生觉得这是一个大的挑战,而且经验学习曲线较长,可能会降低肿瘤学疗效[6]。
对于长期肿瘤学疗效,预后因子被分为两类,一类是对于肿瘤本身而言的,另一类是对于手术方法而言的。对于肿瘤本身而言的预后因子包括:浸润深度,淋巴结转移,肿瘤分化,脉管神经入侵,术前血清CEA 水平。对于手术方法而言的预后因子包括:适当的切缘,彻底的淋巴清扫术,切除足够的淋巴结。本研究表明,淋巴结浸润和术前CEA 是结肠癌患者3年DFS 和5年DFS 的危险因素。肿瘤分期、分化程度、淋巴结浸润是结肠癌患者3年OS 和5年OS 的危险因素。因此,具有以上不良预后因子的患者,如化疗等辅助治疗,可能有利于改善长期肿瘤学疗效。
淋巴结切除数量可能不仅与外科医师解剖知识和经验有关,还与精确病理报告系统有关,检查到的淋巴结数量本身具有预测疗效的价值。淋巴结检出数目越高,Ⅱ期和Ⅲ期结肠癌患者存活率也相应提高[7]。PTOK 等[8]分析了外科医生经验对腹腔镜结肠癌切除手术成功率的影响,发现克服了学习曲线的外科医生实施手术的患者DFS 生存期较好,若出现手术后并发症,如吻合口漏,会降低存活率。TSUCHIYA 等[9]揭示流血过多、手术时间延长和手术操作增多等因素会增加外科手术执行者的压力,外科手术压力引起的许多反应(神经内分泌反应、细胞因子反应、代谢反应和其他未知的生物反应)都会使肿瘤转移的风险增加。学习曲线期间,腹腔镜中转开腹或围手术期并发症等增加手术压力的因素可能会对DFS 造成负面影响。考虑到免疫学影响,第2 组的长手术时间可能会对DFS 造成负面影响。
KANG 等[10]探讨了腹腔镜辅助手术遇到技术性困难对肿瘤安全性的影响,腹腔镜术后肿瘤学安全性、技术困难和执行操作的次数是评价外科医生腹腔镜学习曲线的重要指标。我院开展腹腔镜手术早期,遇到了很多技术困难,这些技术困难是由缺乏经验引起的,都对患者术后的DFS 造成了一定的负面影响。因此,外科医生必须严加学习,以减少这些与外科操作有关的风险因子。学习曲线期间,尽管外科医师尝试保持肿瘤学原则,不接触瘤体的游离技术治疗仍有不足之处,诸如中转开腹率、手术时间及围手术期并发症等手术相关危险因素均会增加。这些因素可能都会增大手术压力,但是由于腹腔镜技术发展突飞猛进,外科医生熟练操作腹腔镜程度提高,使得目前腹腔镜根治术已经成为治疗右侧结肠癌的标准术式。
右侧结肠系膜从后腹膜切除,没有接触结肠本身,只针对切除病变结肠的肠系膜。对于右结肠切除术,如果病变存在于回结肠动脉、静脉、中结肠动脉和静脉的右侧枝干以及右结肠动脉和静脉,需将其从原发位置切除。这些病变在原发位置被切除3 次,第2 次和第3 次将末梢彻底切除,使得病变结肠和肠系膜与肠系膜上动脉和静脉彻底分离,而不伤及或接触到结肠其他部位。因此,高位血管结扎术(D3 淋巴结切除术)在引入腹腔镜手术后在临床更为广泛使用。中间到外侧的方法比外侧到中间的方法更加适合于不接触原则。近年来,腹腔镜技术的进步促进了D3 淋巴结切除术中间到外侧治疗法的发展[11]。相比经典的外侧到中间法,D3 淋巴结切除术采用中间到外侧法,更加符合肿瘤手术的不接触瘤体的游离技术原则。HAYASHI 等[12]表明,外科操作时,不接触瘤体的游离技术能够预防癌细胞被流入到门脉循环系统中。由于腹腔镜手术的开展,中间入路已成为我院开腹和腹腔镜D3 淋巴结切除术的标准方案。本研究中,两名外科医师执行腹腔镜手术,主治医师是我院腹腔镜腹部外科手术开拓者,2008年11月开始进行腹腔镜右侧结肠癌手术。另一位医师为助理医师,也于2009年3月作为主治医师腹腔镜手术的助手。结果表明,第2 组腹腔镜手术长期肿瘤学疗效不亚于开腹手术组,第3 组腹腔镜手术长期肿瘤学疗效比开腹手术好。
综上所述,尽管在学习曲线过程中的操作会对患者的DFS 产生一定的负面影响,但是一旦手术标准化完成,腹腔镜手术能够获得与开腹手术相同的疗效。

