沉默FOXC1表达对A549细胞化疗敏感性的影响
葛路路,石 雁,朱静静,李艳娟,马东波,王 静,吴秋歌
1)郑州大学第一附属医院呼吸与危重症医学科 郑州 450052 2)新乡市中心医院呼吸内科 河南新乡 453000
癌症是全世界主要的公共卫生问题,肺癌位居癌症相关性死亡原因之首,预后差,其5 a生存率约为18%[1],其中非小细胞肺癌约占肺癌的85%,大部分患者在确诊时已属中晚期,丧失了手术机会[2]。以顺铂为主的一线化疗方案是非小细胞肺癌的主要治疗手段,顺铂化疗耐药的出现是治疗失败的关键原因[2-3]。转录因子叉头框C1(forkhead box C1,FOXC1)是叉头框超家族的一个重要成员,参与胚胎的正常发育和器官形成的调节,越来越多的研究[4-6]指出,FOXC1不仅与鼻咽癌、口腔癌、肝癌、乳腺癌、黑色素瘤、胰腺癌等多种肿瘤的发生发展有关,还能促进癌细胞的增殖、迁移、侵袭和远处转移。Xu等[7]发现FOXC1过表达可诱导散发性三阴性乳腺癌对蒽环类化疗药物的耐药。本研究通过向肺癌A549细胞内转染FOXC1 siRNA,观察细胞对顺铂敏感性的变化及细胞内Bcl-2、Bax、FOXC1蛋白及mRNA表达的变化,以期为改善非小细胞肺癌化疗耐药、提高治疗效果提供新的思路。
1 材料与方法
1.1主要试剂与仪器A549细胞购自中国科学院上海生命科学研究院细胞库;RPMI 1640培养基和胎牛血清购自美国HyClone公司;兔抗人FOXC1多克隆抗体购自美国Abcam公司;兔抗人Bcl-2、Bax单克隆抗体购自美国CST公司;辣根过氧化物酶标记的羊抗兔IgG-HRP二抗购自上海生工生物工程有限公司;FOXC1阴性对照(NC siRNA)、FOXC1 siRNA合成于上海吉玛制药技术有限公司;Lipofectamine2000购自美国Invitrogen公司;CCK-8试剂盒购自日本同仁化学研究所;BCA定量试剂盒购自北京索莱宝科技有限公司;细胞凋亡检测试剂盒购自美国BD公司。
1.2细胞培养取6孔板,将对数生长期的A549细胞按8×104个/孔进行接种,放置37 ℃、体积分数5%CO2培养箱常规培养。
1.3不同浓度顺铂作用下细胞增殖活性检测待细胞贴壁生长融合度达60%~70%,分别转染NC siRNA和FOXC1 siRNA。转染操作严格按照说明书进行。转染24 h后分别加入0.5、1.0、2.0、4.0、8.0、16.0、32.0 nmol/L顺铂继续培养,24 h后收获细胞,严格按照CCK-8检测试剂盒说明书操作检测细胞增殖情况。细胞增殖抑制率=1-[药物处理组A(570 nm)-调零孔A(570 nm)]/(对照组处理组A(570 nm)-调零孔A(570 nm)×100%。每组设3个复孔。
1.4细胞分组取对数生长期细胞,当细胞融合度达60%~70%时分组处理:空白对照组(不做处理)、转染试剂组(仅给予转染试剂Lipofectamine2000)、NC siRNA转染组、NC siRNA+顺铂组、FOXC1 siRNA组、FOXC1 siRNA+顺铂组,每组均设3个复孔。依据预实验结果,顺铂浓度和作用时间取4 nmol/L和24 h。
1.5各组细胞凋亡检测按照1.4分组并收集培养细胞,用预冷的PBS洗涤2次,加入Binding buffer制成1×106个/mL细胞悬液,每组取100 μL细胞悬液加入5 μL Annexin V-FITV和5 μL PI,室温避光孵育15 min。使用BD LSRFTM流式细胞仪在30 min内检测,计算早期凋亡率、晚期凋亡率及总凋亡率。
1.6各组细胞中FOXC1、Bcl-2和Bax mRNA表达的qRT-PCR检测按照1.4分组培养并收集细胞,依据RNA抽提试剂盒说明提取总RNA,所有步骤严格按照说明书进行。FOXC1、Bcl-2和Bax引物序列见表1。PCR反应体系为25 μL。PCR反应条件:95 ℃预变性10 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt方法分析各组mRNA的相对表达量。

表1 引物序列
1.7各组细胞中FOXC1、Bcl-2和Bax 蛋白表达的Western blot检测按照1.4分组培养并收集细胞,离心后加入细胞裂解液提取蛋白样品,采用BCA法进行蛋白定量。取蛋白样品与5×蛋白上样缓冲液按4∶1体积比混匀,煮沸变性。通过SDS-PAGE分离蛋白,采用湿转法将蛋白转至PVDF膜,置入含50 g/L脱脂奶粉的封闭液(用1×TBST配制)中室温封存1~2 h,分别加入兔抗人FOXC1多克隆抗体(按1∶1 000稀释),兔抗人Bcl-2和Bax单克隆抗体(均按1∶2 000稀释),4 ℃过夜;次日复温,30 min后TBST洗涤3次,5 min/次;后加入稀释的二抗(按1∶5 000稀释)室温孵育1~2 h,TBST洗膜3次,10 min/次,ECL化学法显色,采用凝胶成像系统及Image J软件分析,目的蛋白相对表达量=目的蛋白条带灰度值/GAPDH条带灰度值。
1.8统计学处理采用SPSS 24.0进行数据分析。应用单因素方差分析和LSD-t检验比较转染FOXC1 siRNA对顺铂作用下A549细胞增殖抑制率、细胞凋亡的影响以及相关蛋白及mRNA的相对表达量的差异,检验水准α=0.05。
2 结果
2.1转染FOXC1siRNA依据预实验结果组对顺铂作用下A549细胞增殖抑制率的影响见表2。由表2可知,在各浓度顺铂作用实验条件下,与转染NC siRNA的A549细胞相比,转染FOXC1 siRNA均表现出增强细胞增殖抑制率的效果(P<0.05);进一步将NC siRNA+顺铂组中的IC50[(4.66±0.58)nmol/L]与FOXC1 siRNA+顺铂组中的IC50[(2.08±0.69)nmol/L]比较,发现抑制FOXC1表达后A549对顺铂药物敏感性显著提高(P<0.05)。

表2 顺铂作用下A549细胞增殖抑制率(n=3)
2.2各组A549细胞凋亡的比较见表3。由表3可知,与其他组相比,FOXC1 siRNA+顺铂组A549细胞早期凋亡率、晚期凋亡率及总凋亡率明显提高。

表3 各组细胞凋亡率的比较(n=3)
△:与A、B、C组相比,P<0.05;*:与A、B、C、D组相比,P<0.05; #:与其他5组相比,P<0.05
2.3各组A549细胞中FOXC1、Bcl-2、Bax mRNA及蛋白表达的比较见图1和表4。与其他组相比,FOXC1 siRNA+顺铂组A549细胞中FOXC1和Bcl-2 mRNA及其蛋白的相对表达量下降,而Bax mRNA及其蛋白的相对表达量上升。
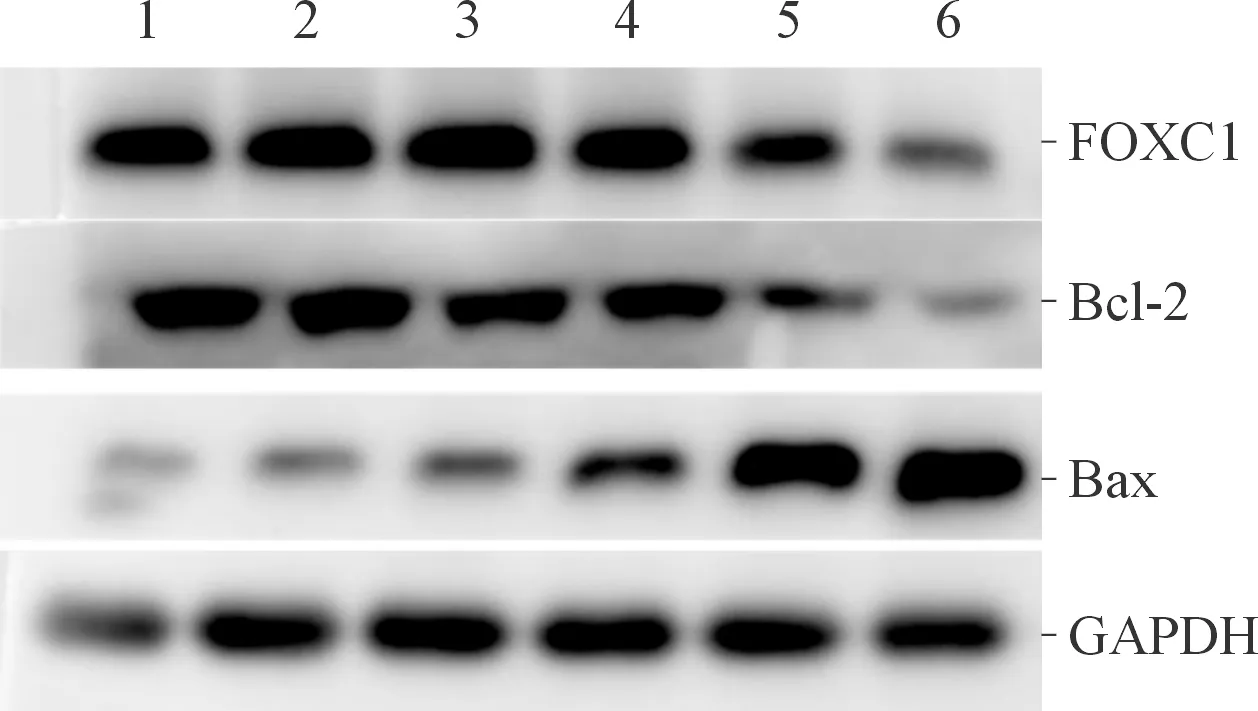
1:空白对照组;2:转染试剂组;3:NC siRNA组;4:NC siRNA+顺铂组;5:FOXC1 siRNA组;6:FOXC1 siRNA+顺铂组
图1各组A549细胞中FOXC1、Bcl-2和Bax蛋白的表达
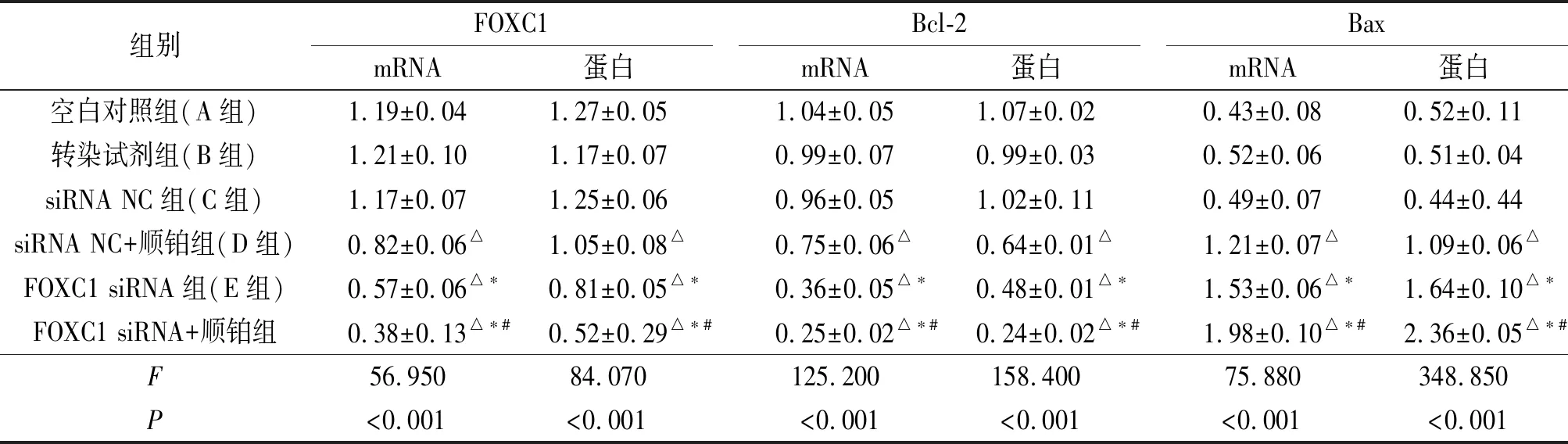
表4 各组细胞FOXC1、Bcl-2和Bax表达的比较(n=3)
△:与A、B、C组相比,P<0.05;*:与A、B、C、D组相比,P<0.05;#:与其他5组相比,P<0.05
3 讨论
尽管目前靶向抗癌治疗和免疫治疗方法激增,但顺铂仍是治疗肺癌最广泛使用的一线化疗药物[8],临床化疗耐药性被认为是晚期非小细胞肺癌患者治疗失败的主要原因[9-10],并且可能受到多种因素的交互影响[11]。
FOX家族是一类成员众多的转录因子,FOXC1编码基因在人类中定位于6q25,基因全长3 500 bp,仅含1个外显子,长为1 662 bp,FOXC1蛋白含553个氨基酸残基,相对分子质量约为56 700[12]。既往研究[13]表明FOXC1在NSCLC组织中表达明显高于癌旁正常组织,且与肿瘤分化程度、淋巴结转移及TNM分期相关。Chen等[14]的研究表明,FOXC1 siRNA能有效地沉默FOXC1在NSCLC细胞中的表达,并有可能通过调节细胞周期蛋白D1和上皮间质转化途径来增强肿瘤细胞的侵袭和迁移。此外,FOXC1还与肿瘤细胞的耐药性密切相关,下调FOXC1表达有助于促进肿瘤细胞的凋亡[15-16]。FOXC1还可以作为乳腺癌常规化疗药物(如5-氟尿嘧啶、表阿霉素、环磷酰胺、多西紫杉醇等)耐药的调节器,FOXC1表达增加可明显导致乳腺癌MDA-MB-468细胞对FEC化疗方案耐药,但是,转染FOXC1 siRNA抑制FOXC1在乳腺癌MA-MB-231细胞中的表达可提高对多西紫杉醇化疗的敏感性[17]。
本研究采用脂质体转染技术,通过转染FOXC1 siRNA抑制FOXC1在A549细胞中的表达;结果显示,转染FOXC1 siRNA后可明显增强A549细胞对顺铂的敏感性;且FOXC1 siRNA+顺铂组细胞凋亡率显著高于其他组。因此,FOXC1的表达对A549细胞的顺铂耐药性具有显著性影响。此外,本研究结果表明,转染FOXC1 siRNA在降低FOXC1表达的同时,可促进凋亡抑制因子Bcl-2表达的下降和凋亡促进因子Bax表达的升高。Bcl-2和Bax分别是最具代表性的抑制凋亡和促进凋亡因子,其表达与调控是影响细胞凋亡的关键途径[18]。因此,抑制FOXC1的表达可能通过上调促进凋亡因子Bax的表达、下调凋亡抑制因子Bcl-2的表达来促进肿瘤细胞的凋亡,提高A549细胞对顺铂的敏感性。
综上所述,通过转染FOXC1 siRNA抑制FOXC1的表达,可明显提高A549细胞对顺铂的化疗敏感性,促进细胞凋亡抑制因子Bcl-2表达的下降和凋亡促进因子Bax表达的升高。该研究结果可为后续提高A549细胞对化疗药物的敏感性研究,改善现有治疗策略提供参考。

