磁敏感加权成像及3D-ASL在各级脑胶质瘤分级中的价值
杜常月,苗娜,齐旭红,董卫敏,于洋,温智勇
作者单位:首都医科大学电力教学医院放射科,北京 100073
胶质瘤占恶性脑肿瘤的81%,有显著的死亡率和发病率[1]。近年来,影像学的发展为其提供了更多的信息。然而,各级之间是否存在影像差异,通过哪些影像手段进行级别区分,具体怎么区分等问题仍未完全清楚;且病理级别影响患者的生存率及预后。磁敏感加权成像(susceptibility weighted imaging,SWI)及三维动脉自旋标记(three-dimensional arterial spin labeling,3D-ASL)成像可以反映肿瘤的微血管、微出血及血流灌注。本研究主要探讨SWI及3D-ASL对鉴别各级胶质瘤的价值。
1 材料与方法
1.1 病例资料
回顾性分析2016年5月至2018年3月期间,到我院就诊并经术后病理证实的脑胶质瘤患者92例:Ⅱ级35例平均年龄为(41.89±12.76)岁;Ⅲ级13例,平均年龄为(40.92±12.51)岁;Ⅳ级44例,平均年龄为(54.41±10.97)岁。所有患者检查前均签署了知情同意书,均未接受过任何放化疗,于术前完成了头颅MRI平扫、SWI及3D-ASL序列扫描,并进行了头颅MRI增强扫描;所得图像较清晰。肿瘤实体部分太小、运动伪影太重影响检测的患者未纳入其中。
1.2 仪器与方法
采用GE Discovery 750W 3.0 T磁共振扫描仪及24通道头颅表面线圈,进行MRI检查,扫描序列包括:(1)头颅MRI平扫:轴位T1WI (TR 2087.4 ms,TE 24.0 ms)、轴位T2WI (TR 5281.0 ms,TE 104.0 ms)、轴位T2 FLAIR (TR 9000.0 ms,TE 95.0 ms),视野24 cm×24 cm,层厚5.0 mm,层间距1.5 mm。(2) SWI采用Ax SWAN序列(TR 38.3 ms,TE 22.9 ms),FA 15°,视野 24.0 cm×21.6 cm,矩阵352×288,层厚2.0 mm,无层间距,NEX为0.69。(3) 3D-ASL扫描:采用基于FSE的3D Spiral全脑采集,带宽62.5 KHz,矩阵512×512,NEX为3,Post Lable Delay 1525.0 ms,TR 4683.0 ms,TE 10.7 ms,层厚4.0 mm,无间隔,层数40,扫描时间4 min 32 s,扫描范围包括颅底至颅顶的全脑范围。(4)头颅T1WI序列的增强扫描(轴位、矢状位及冠状位)。
1.3 数据分析
将图像载入GE ADW 4.6工作站进行后处理,测量并记录各参数值。在SWI MinIP图上的肿瘤所在区域,半定量评估肿瘤内的敏感性信号强度(intratumoral susceptibility signal intensity,ITSS)[2],其中微出血为类圆形直径<5 mm低信号灶,肿瘤范围内连续出现的迂曲低信号为病理血管。可为以下几个等级[2]:0分为没有ITSS;1分为1~5个点状或细线性ITSS;2分为6~10个点状或细线性ITSS;3分为11个或更多的点状或细线性ITSS。利用钙化在相位图上表现为高信号,可以剔除钙化的影响。评分采用双盲法,由2名有经验的影像诊断医师独立分别对各组进行一次ITSS评分,如果2名医师的结果不一致,则以第三名高级职称的影像诊断医师结果为准。
对脑血流量灌注图与轴位T1增强图进行融合,由2名影像硕士研究生在有经验的医师指导下,于肿瘤灌注最明显的层面(伪彩图上实性部分色彩最鲜艳的部分)设置3个感兴趣区(region of interest,ROI),得到肿瘤最大脑血流量值(maximum cerebral blood flow,CBFmax),ROI大小在50 mm2左右,取这3个ROI的平均值作为最终数值。同样的方法,获取同层面健侧脑白质区血流量CBF1、健侧脑灰质区血流量CBF2、对侧镜像区正常脑组织CBF3。通过计算,得出相对参数r1 (CBFmax/CBF1)、r2 (CBFmax/CBF2)及r3 (CBFmax/CBF3)。为避免误差,ROI的选择均在肿瘤实质区域,尽可能避开囊变、坏死、钙化及周围水肿。测量完成后由1名副主任医师进行审核;如果2名医师的结果不一致,则以第三名高级职称的影像诊断医师结果为准。
1.4 统计学方法
应用SPSS 24.0统计软件进行分析,ITSS采用非参数Mann-Whitney U检验,3D-ASL各参数值采用单因素方差ANOVA分析,P<0.05表示差异有统计学意义。利用受试者工作特性曲线(receiver operator characteristic curve,ROC)评估两种技术对胶质瘤分级的诊断效能。
2 结果
Ⅱ、Ⅲ、Ⅳ级脑胶质瘤的常规增强扫描、3D-ASL和SWI序列图像详见图1~3。各参数统计分析结果详见表1、2。利用ROC曲线分析SWI及3D-ASL在各组比较中的曲线下面积(the area under the curve,AUC),详见图4。根据Youden指数确定各参数的最佳诊断界值、诊断敏感性、特异性(表3)。
表1 3D-ASL参数统计分析(±s)Tab. 1 Statistical analysis of 3D-ASL parameters (±s)
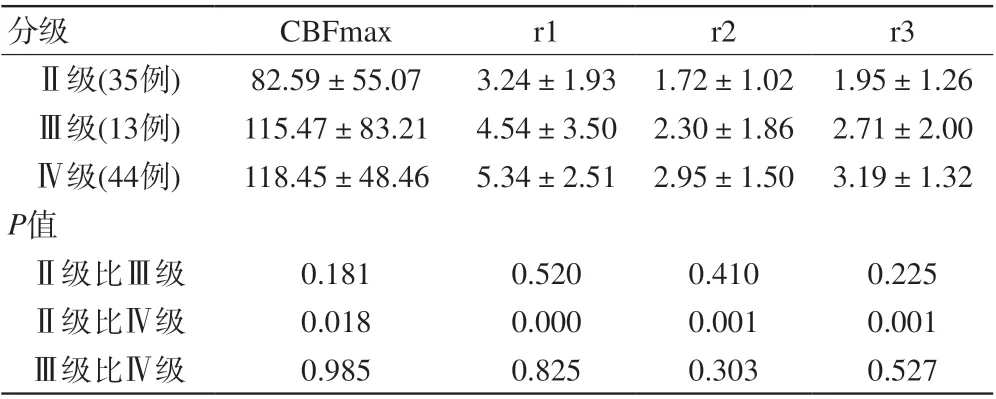
表1 3D-ASL参数统计分析(±s)Tab. 1 Statistical analysis of 3D-ASL parameters (±s)
注:CBFmax、r1、r2和r3值在各级胶质瘤内的结果。P≤0.05差异有统计学意义,P>0.05无统计学意义
分级 CBFmax r1 r2 r3Ⅱ级(35例) 82.59±55.07 3.24±1.93 1.72±1.02 1.95±1.26Ⅲ级(13例) 115.47±83.21 4.54±3.50 2.30±1.86 2.71±2.00Ⅳ级(44例) 118.45±48.46 5.34±2.51 2.95±1.50 3.19±1.32 P值Ⅱ级比Ⅲ级 0.181 0.520 0.410 0.225Ⅱ级比Ⅳ级 0.018 0.000 0.001 0.001Ⅲ级比Ⅳ级 0.985 0.825 0.303 0.527

表2 ITSS值统计分析(例)Tab. 2 Statistical analysis of ITSS values (n)
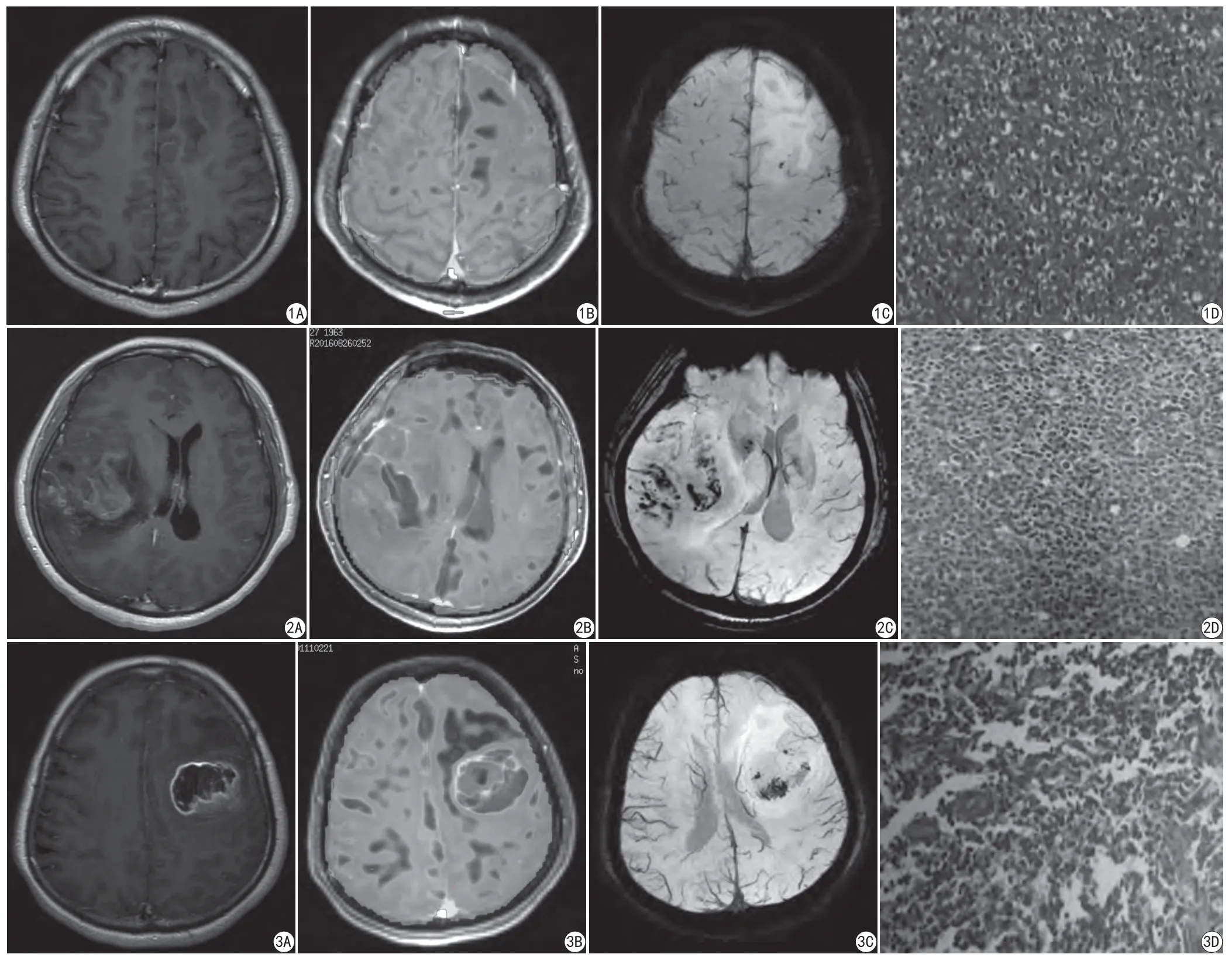
图1 男,32岁。左侧额叶少突胶质细胞瘤(WHO Ⅱ)。A:T1WI增强图;B:3D-ASL CBF图,肿瘤实质区可见斑片状低灌注;C:SWI MinIP 图,ITSS为1;D:病理图片(HE ×200) 图2 女,53岁。右侧颞叶间变性少突星形细胞瘤(WHO Ⅲ)。A:T1WI增强图;B:3D-ASL CBF图,肿瘤实质区可见高灌注;C:SWI MinIP 图,ITSS为3;D:病理图片(HE ×200) 图3 女,50岁。左侧额叶胶质母细胞瘤(WHO Ⅳ)。A:T1WI增强图;B:3D-ASL CBF图,肿瘤实质区可见高灌注;C:SWI MinIP 图,ITSS为3;D:病理图片(HE ×200)Fig. 1 Thirty-two years old man, a histologically verified grade Ⅱ oligodendroglioma in the left frontal lobe. A: Contrast enhancement on gadolinium-enhanced T1-weighted image. B: Tumor parenchyma showed patchy low perfusion on 3D-ASL CBF image. C: The ITSS was 1 on SWI MinIP image. D: The image of pathology (HE ×200). Fig. 2 Fifty-three years old woman, a histologically verified grade Ⅲ anaplastic astrocytoma in the right temporal lobe. A: Contrast enhancement on gadolinium-enhanced T1-weighted image. B: Tumor parenchyma showed high perfusion on 3D-ASL CBF image. C: The ITSS was 3 on SWI MinIP image. D: The image of pathology (HE ×200). Fig. 3 Fifty years old woman, a histologically verified grade Ⅳ glioblastoma in the left frontal lobe. A: Contrast enhancement on gadolinium-enhanced T1-weighted image. B: Tumor parenchyma showed high perfusion on 3D-ASL CBF image. C: The ITSS was 3 on SWI MinIP image. D: The image of pathology (HE ×200).
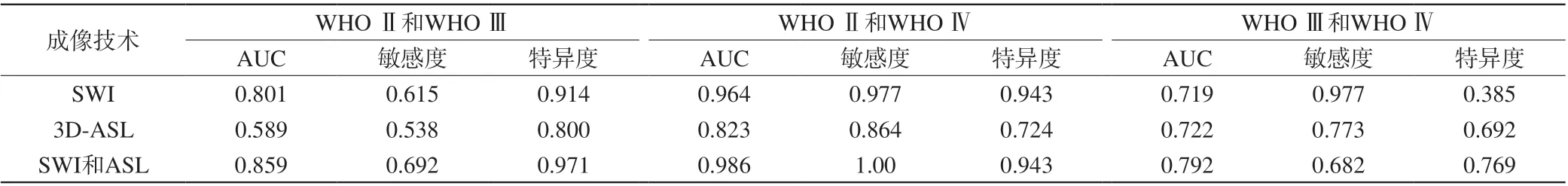
表3 SWI及3D-ASL的ROC曲线分析结果Tab. 3 Results of ROC curve analysis of SWI and 3D-ASL
3 讨论
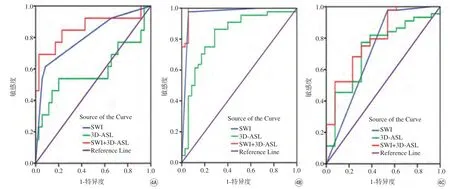
图4 A:SWI、3D-ASL及两种技术联合在WHO Ⅱ与WHO Ⅲ胶质瘤比较中的ROC曲线;B:SWI、3D-ASL及两种技术联合在WHO Ⅱ与WHO Ⅳ胶质瘤比较中的ROC曲线;C:SWI、3D-ASL及两种技术联合在WHO Ⅲ与WHO Ⅳ胶质瘤比较中的ROC曲线Fig. 4 A: ROC curves of SWI, 3D-ASL and combining two techniques in the comparison of WHO Ⅱ vs. WHO Ⅲ glioma. B: ROC curves of SWI, 3D-ASL and combining two techniques in the comparison of WHO Ⅱ vs. WHO Ⅳ glioma. C: ROC curves of SWI, 3D-ASL and combining two techniques in the comparison of WHO Ⅲ vs. WHO Ⅳ glioma.
血管生成的程度是评估良恶性肿瘤、确定脑肿瘤侵袭性的重要标志[3]。不同级别胶质瘤的新生血管程度不一致,血供和缺氧情况也有所差异,这就会造成灌注及出血差异。所以,定量研究和评价胶质瘤区域的血管生成及灌注情况,理论上可以对肿瘤进行分级鉴别。SWI对新生血管(静脉血和脱氧血红蛋白)、出血和钙化的检测非常敏感,是检测胶质瘤内部结构特征不可或缺的工具[4]。有研究表明,SWI可用于胶质瘤分级[5-6]。而ASL可以反映肿瘤的血供情况,可以作为评估脑肿瘤的工具[7]。以往大多数研究只是针对磁共振单个技术。但是,不同成像方式的组合可以提高诊断准确性、相互补充信息。目前,将SWI与其他技术结合起来对胶质瘤分级的研究不是很多[6],而且对胶质瘤进行细化分级的研究也很少。笔者采用SWI和3D-ASL两种技术,同时反映了肿瘤的微观血管结构和肿瘤中的血供情况,对Ⅱ、Ⅲ和Ⅳ级胶质瘤进行分级研究。
本研究结果显示:ITSS在鉴别(Ⅱ级与Ⅲ级比较)、(Ⅱ级与Ⅳ级比较)、(Ⅲ级与Ⅳ级比较)中差异均有统计学意义(P<0.05)。表现为级别越高,ITSS评分值越高。这与以往的研究部分类似[8-9]。分析原因可能是:(1)肿瘤级别越高,其内新生血管越多,这些新生血管由于生长迅速,多不成熟,容易引起破裂出血[10]。(2)高级别胶质瘤内瘤细胞生长迅速,需氧量增加,容易引起缺氧,导致血管内脱氧血红蛋白增加,表现为低信号。但是,与以往大多数研究[2]不同的是,本研究中有2例Ⅱ级胶质瘤中ITSS值为3。分析原因可能是,部分Ⅱ级胶质瘤新生血管比较迂曲、密集,且血管发育不成熟,引起了缺氧,导致脱氧血红蛋白的产生。
而CBFmax、r1、r2及r3仅在(Ⅱ级比Ⅳ级)组中,具有统计学意义(P<0.05)。分析原因可能是:(1) Ⅳ级胶质瘤中微血管密度比Ⅱ级更大(研究表明,ASL测量的CBF与脑胶质瘤组织中的微血管密度呈正相关[11-12]),灌注更为显著,体现出更高的TBFmax值及r值(r1、r2、r3)。这与国内外报道部分相似[13-15]。关于这一点,WHO胶质瘤分级标准中也提到,Ⅳ级胶质瘤微血管增生情况更为显著。以往也有文献报道,血管内皮生长因子(vascular endothelial growth factor,VEGF)在高级别胶质瘤中的表达相对较高,可诱导不成熟的肿瘤血管增生[16]。(2) Ⅱ级属于低级别,而Ⅲ级为高级别。3D-ASL各参数不能鉴别二者,而SWI可以鉴别,说明3D-ASL可能相对不稳定,SWI具有更高的鉴别意义。(3) Ⅲ级中可能已经存在一部分新生血管,血管密度已经有所增加;或者是Ⅲ级和Ⅳ级均会造成血脑屏障破坏,导致灌注增加。从而导致3D-ASL无法区分Ⅲ级和Ⅳ级。此外,本研究中在低级别胶质瘤中出现3例高灌注,以往有研究认为,低级别肿瘤的血流量高估,可能是瘤内血管分流或少突胶质细胞瘤1p19q杂合性联合缺失所致[17]。Ⅲ级中出现1例低灌注,Ⅳ级出现3例低灌注。分析原因可能是:部分高级别胶质瘤局部新生血管迂曲;或者局部血流缓慢;使灌注信息延迟。
在各参数均有统计学意义的(Ⅱ级比Ⅳ级)组中,SWI的AUC值(0.964)、敏感性(97.7%)和特异性(94.3%)均比3D-ASL大。而且,3D-ASL在各组中的AUC值、敏感性和特异性也不是很高。关于这一点,有研究表明,ASL由于对运动非常敏感,易出现大量伪影,运动伪影可能会使信号强度不准确,导致数据值偏高或偏低[18]。这进一步提示3D-ASL参数不够稳定。同时,本研究结果显示,利用SWI可以将高级别中的Ⅲ级和Ⅳ级区分开,这对临床有很大的价值。
本研究的不足之处:(1) SWI的评分是半定量评分,带有一定的主观成分,难免有偏倚。而这也直接影响统计分析的结果。因此,如何客观、精确地进行SWI定量分析仍是急需解决的问题,也是目前研究的软肋。(2) Ⅲ级的样本相对于Ⅱ级和Ⅳ样本量较少,仍需后期扩大Ⅲ级样本量。
综上,通过对比及联合SWI、3D-ASL两种技术,发现两种技术可以用于各级胶质瘤之间的鉴别。而且,SWI在胶质瘤分级中比3D-ASL要准确一点。但是,联合两种技术的诊断效能均大于单独应用某一种技术,具有更高的诊断效能。
利益冲突:无。

