DRD2 TaqIA不同基因型海洛因成瘾者抑制性控制网络的fMRI研究
李小怀,朱国平,蔡关科,敬甲兵,王帆,刘为,时宏,胡风,王玮*
作者单位:
1. 空军军医大学唐都医院核医学科,西安 710038
2. 浙江大学医学院附属第四医院放射科,义乌 322000
3. 甘肃省庆阳市第一人民医院放射科,庆阳 745000
海洛因成瘾是一种最严重的物质使用障碍,是由强烈的生物社会因素造成的慢性脑病[1],以认知自我控制受损为特征,包括控制毒品冲动或抑制冲动药物驱动行为的能力受损[2]。缺少抑制控制是成瘾行为的主要机制之一,这与多巴胺介导的神经回路有关,功能性磁共振成像研究已证明抑制控制所涉及多个区域,包括前额叶皮层、前扣带回、辅助运动区和前岛叶[3],特别是右侧额下回(inferior frontal gyrus,IFG)对抑制控制发挥重要作用[4]。有学者认为右额下回是动作抑制信号的节点,参与动作反应的暂停及停止过程[5-6],也同时参与减缓动作反应的过程[7]。反应抑制GO/NOGO任务中发现健康志愿者右IFG显著激活有关[8],而成瘾者右侧IFG功能活动失调被认为是一个显著特点[9-10]。
成瘾形成过程中基因因素起到了60%的作用[11],大多数与成瘾风险有关的基因主要影响物质滥用时个体生物学及新陈代谢过程[12]。多巴胺(dopamine,DA)是重要的神经递质,当成瘾性物质作用于神经系统内源性化学递质受体,产生下游信号转导效应,导致伏隔核中DA大量释放,作用于多巴胺D2受体(dopamine receptor D2,DRD2),激活奖赏连锁反应,调节DA释放量和奖赏位点,最终DA和DA受体结合后完成奖赏效应。DRD2两个等位基因分别为A1和A2,其等位基因为TaqI A+型(A1/A1和A1/A2,A+)与TaqI A-型(A2/A2,A-)[13]。DRD2 TaqI A多态性通过影响DRD2密度来调节DA效能,影响成瘾易感性[14]。
虽然先前的研究表明,抑制控制和刺激驱动注意力的损伤是海洛因成瘾的特点,并与右侧IFG的激活减弱有关,但目前还不清楚不同基因类型的海洛因成瘾者在认知控制期调节右侧IFG活动有何差异。因此,本研究探讨DRD2 TaqI A不同基因型海洛因成瘾者抑制控制网络的差异。
1 材料与方法
1.1 研究对象
收集招募海洛因成瘾者57例(海洛因组)。纳入标准:(1)符合《美国精神疾病诊断与统计手册》第四版物质成瘾诊断标准;(2)除海洛因和尼古丁外,无其他物质成瘾史;(3)视力正常或矫正后正常;(4)年龄18~50岁;(5)本人曾无重大精神创伤,无躯体疾病史。排除标准:(1)符合《美国精神疾病诊断与统计手册》第四版物质成瘾诊断标准以外的其他诊断标准;(2)脑部有实质性的病变;(3)磁共振禁忌证。收集海洛因成瘾者唾液标本,由美国应用生物系统公司(上海)采用聚合酶链反应-限制性酶切片段长度多态性技术,测定DRD2 TaqI A基因多态性,分为A+型组和A-型组[15-16]。在唐都医院社区招募年龄、受教育程度、吸烟情况相匹配的健康志愿者46名作为对照组(正常组)。所有受试者均为男性、右利手。本实验已通过唐都医院伦理委员会批准,受试者在检查前均被告知研究目的与内容,并自愿签署知情同意书。
1.2 冲动测评
本研究采用周亮等人修订的Barratt冲动性量表第十一版中文版(Barratt Impulsivity Scale,BIS-11)评估受试者的冲动性特征,共26个条目,采用1~4分四级评分法[17]。该量表分3个维度:注意力冲动、运动冲动、无计划冲动。量表的统计量为总分和各维度得分,得分越高说明冲动性越高。本量表具有较高的内部一致性信度,为测量冲动性的通用量表之一[18-19]。主试者由接受临床心理学专业培训的人员担任,当场检查、收回问卷。
1.3 磁共振数据采集
受试者在磁共振扫描前8h禁止饮茶、咖啡、酒以及服用任何药物。使用GE Signa Excite HD 3.0 MRI设备,8通道头线圈进行数据采集。扫描过程中受试者戴耳塞,处于静息状态(即睁眼,保持安静,不接受外界刺激、尽量不思考)。在正式数据采集之前,进行1 min模拟扫描,以适应环境。对受试者依次采集T2WI、静息态功能像、高分辨率T1WI。功能像采用梯度回波回波平面成像序列(echo planar imaging,EPI),参数如下:重复时间(TR) 2000 ms,回波时间(TE) 30 ms,反转角(FA) 90°,激励次数(NEX) 1,视野(FOV) 256 mm×256 mm,矩阵(matrix) 64×64,层厚4 mm,层间隔0 mm,共32层,150个时间点。3D高分辨率结构像数据采集采用快速扰相梯度回波序列,参数:TR 8 ms,TE 3.0 ms,FOV 256 mm×256 mm,矩阵256×256,空间分辨率1 mm×1 mm×1 mm,共166层。结构像由2名经验丰富的主治医师进行审阅,以排除脑实质存在器质性病变的受试者。
1.4 数据处理
1.4.1 预处理
基于matlab(https://ww2.mathworks.cn/)平台利用dpabi 2.3[20]及SPM12 (https://www.fil.ion.ucl.ac.uk/spm/)软件对静息态影像数据进行预处理,包括格式转化、时间校正、头动校正、分割、回归协变量(24个头动方向、脑脊液信号、白质信号)、空间标准化、高斯平滑(FWHM=6 mm)、去线性漂移、滤波(0.01~0.1 Hz)。头动在各个方向(x、y、z)的平动小于1.5 mm,转动小于1°。三组受试者均无因头动排除。
1.4.2 功能连接
对预处理后的静息态数据进行基于感兴趣区(regions of interesting,ROI)的功能连接分析。参考先前的研究[3,10,21-22],选取AAL模板中右侧额下回为种子点,提取其内平均时间序列,采用Pearson相关性分析该种子时间序列和全脑每个体素时间序列系数的相关程度,对r值进行Fisher z转换,将相关系数进行正态性变换,所获得的脑激活为脑区两点间的连接强度。
表1 行为学数据对比表(±s)Tab. 1 Behavioral data comparison table (±s)
注:(1) t1,P1为正常组与海洛因组两组独立样本t检验的t值与P值,两组间在教育时间指标间差异有统计学意义;(2) t2,P2为A+型与A-型两组独立样本t检验的t值与P值,两组在各个指标差异均无显著性差异,P>0.05
项目 正常组(46名)海洛因组 t1/t2 P1/P2 A+型组(35例) A-型组(22例)年龄(岁) 34.30±8.01 35.97±7.51 36.41±8.91 -1.15/-0.12 0.25/0.84教育时间(年) 10.28±2.18 9.34±1.78 9.05±3.06 2.34/0.46 0.02/0.65吸烟时间(年) 15.61±7.23 17.97±5.42 19.22±6.25 -1.98/-0.81 0.07/0.43每日0.25/0.13每日海洛因吸烟量(支) 16.96±9.69 20.71±9.42 16.68±9.65 -1.15/1.56—/0.41海洛因食用用量(克) — 0.43±0.5 0.33±0.24 —/0.84—/0.53时间(月) — 85.93±78.83 72.72±71.27 —/0.63
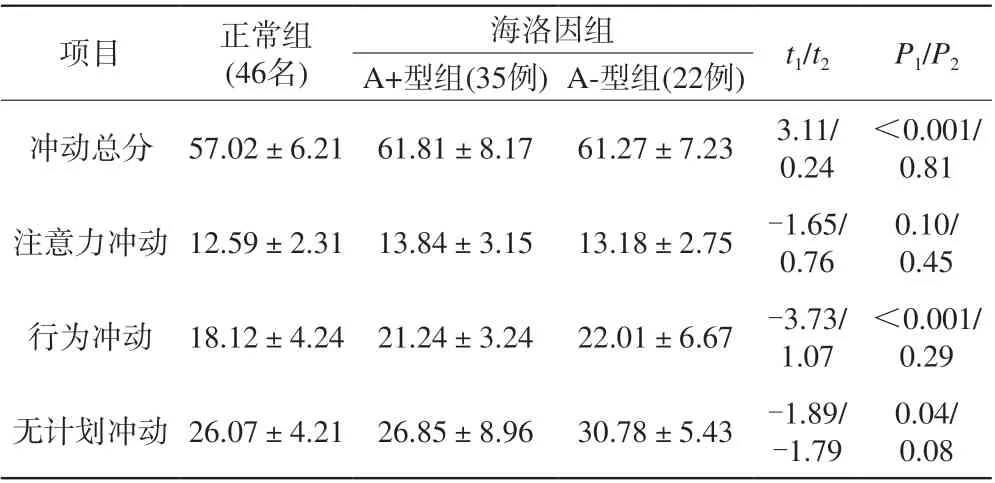
表2 组间抑制冲动评分比较Tab. 2 Comparison of inhibition scores between groups
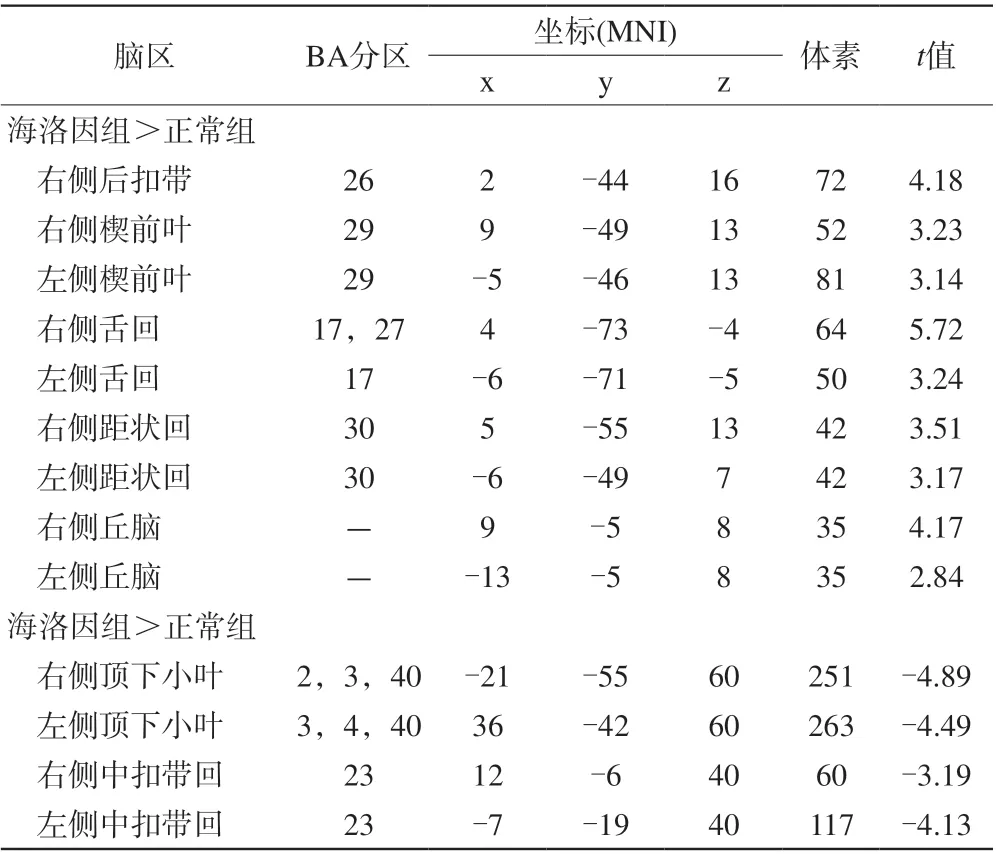
表3 海洛因组与正常组功能连接差异的脑区Tab. 3 Brain regions with differences in functional connectivity between the heroin group and the normal group
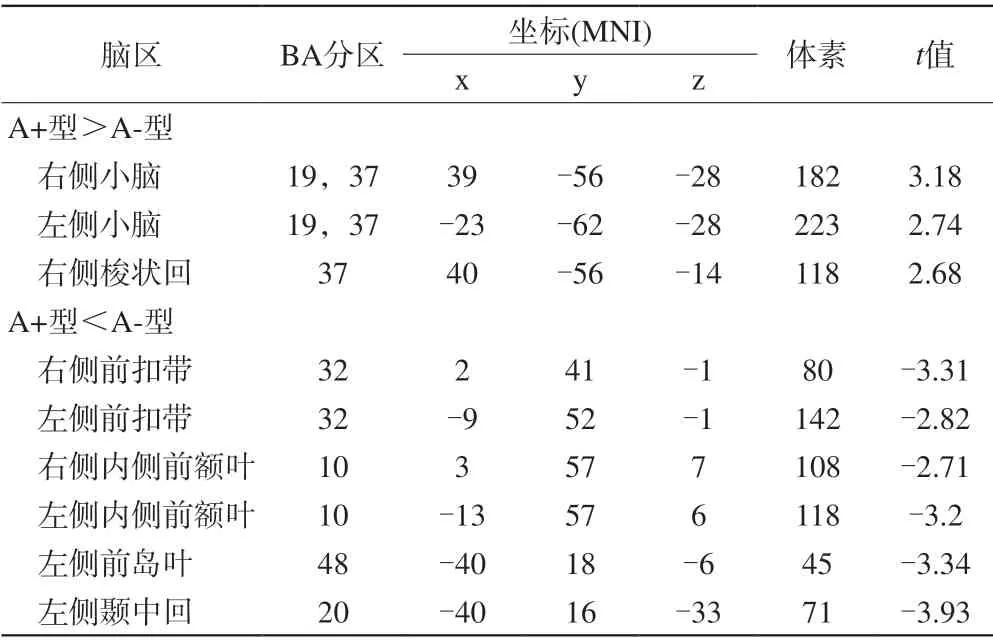
表4 A+型组与A-型组功能连接差异的脑区Tab. 4 Brain regions with different functional connections between A+ group and A- group
1.5 统计
1.5.1人口及心理学资料
应用SPSS 20.0统计分析软件对海洛因组与正常组、A+型基因组与A-型基因组的人口学(年龄、教育、每日吸烟量及吸烟时间、每日海洛因用量及海洛因食用时间)、心理学冲动性量表(冲动总分、注意力冲动分、运动冲动分、无计划冲动分)的计量资料进行描述性统计,以表示,并对上述指标进行两独立样本t检验,P<0.05为差异有统计学意义。
1.5.2 影像学资料
应用dpabi 2.3[20]中统计模块(Statistical Analysis)对影像结果进行分析。对海洛因组与正常组,A+型基因组与A-型基因组进行非参数置换检验,重复置换5000次,P<0.05,TFCE校正[23-24]。应用dpabi 2.3[20]中视图模块(Viewer)及XjView (http://www.alivelearn.net/xjview)呈现影像结果。
1.6 相关性分析
对两组间显著性差异脑区进一步探讨。选取脑区差异峰值坐标为球心,6 mm为半径,提取A+型与A-型海洛因成瘾者脑信号强度值,与抑制冲动评分、吸食海洛因情况做相关分析。
2 结果
2.1 一般人口学资料
正常组与海洛因组在教育时间间差异有统计学意义,在后续的功能连接分析中将作为协变量进行控制。A+型组与A-型组在各指标均无显著差异(表1)。
2.2 冲动性评分
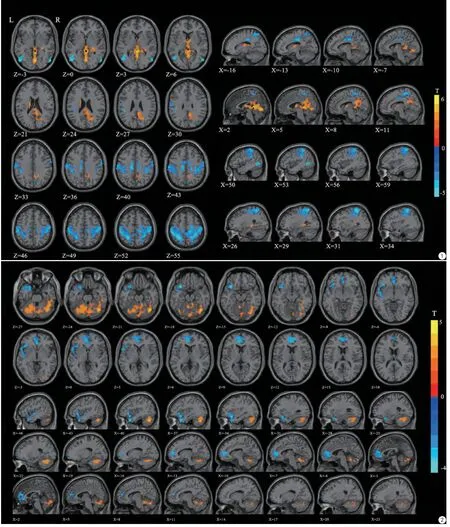
图1 海洛因成瘾组与正常组右侧额下回功能连接差异的脑区。非参数置换检验,P<0.05,TFCE校正。红色表示海洛因组>正常组,蓝色表示海洛因组<正常组 图2 A+型组与A-型组右侧额下回功能连接差异的脑区。非参数置换检验,P<0.05,TFCE校正Fig. 1 Brain regions with different functional connections between heroin group and normal group. Nonparametric replacement test, P<0.05, TFCE correction. Red indicates heroin group > normal group, blue indicates heroin group < normal group. Fig. 2 Brain regions with different functional connections between A+ group and A- group. Nonparametric replacement test, P<0.05, TFCE correction.
海洛因组与正常组在冲动总分、行为冲动、无计划冲动三指标间差异有统计学意义。A+型组与A-型组 在各个指标差异均无显著性差异(表2)。
2.3 脑功能连接
控制教育时间,与正常组相比,海洛因成瘾组右侧额下回功能连接增强区域为双侧楔前叶、舌回、距状回、丘脑和右侧后扣带,功能连接降低区域为双侧顶叶、中扣带(图1;表3)。
与A-型组相比,A+型组右侧额下回功能连接增强区域位于双侧小脑及右侧梭状回,功能连接降低区域为双侧前扣带、内侧前额叶及左侧岛叶、颞中回(图2;表4)。
2.4 相关性
A+型组与A-型组差异脑区与冲动抑制评分、吸食海洛因情况均无相关性(P>0.05)。
3 讨论
本研究利用基因技术对海洛因成瘾者DRD2 TaqIA基因进行分类,结合心理学与功能磁共振技术,探讨其调节抑制性控制过程中脑区的差异,结果显示,海洛因成瘾者心理冲动性更高;其右侧额下回与后默认网络连接增强,与感觉运动网络连接降低;且A+型海洛因成瘾者大脑调节抑制功能脑区(岛叶、内侧前额叶)和监测抑制功能脑区(前扣带)均与执行抑制功能脑区(右侧额下回)的连接降低。因此,本研究表明,海洛因成瘾者A+型在觅药行为中有更高的冲动行为,可能更易复吸。
3.1 冲动性与抑制性
A+型与A-型成瘾者在冲动差异无显著性,但与正常者相比,具有更高的冲动性,包括行为冲动和无计划冲动。冲动性是一种易导致不恰当或适应不良行为的倾向,突出表现为行为决策和行为抑制两个方面[25]。高冲动个体行为决策能力受损,常偏好即时可得的利益,忽视延迟的奖赏,无法抵制欲望和诱惑,做出不利于自己和他人的选择[26],同时,高冲动个体控制能力受损,难以对抑制信号做出快速反应,发生不受个体主观控制的行为,产生非期望的行为后果,如成瘾行为或复吸[27]。张东升等[28]通过抑制任务GO/NOGO范式对长期美沙酮维持治疗的海洛因成瘾者进行研究也发现,其抑制控制功能受损,可能是复吸率较高的原因之一。
右侧额下回主要与抑制控制或反应抑制有关[29],先前的研究也表明右侧额下回在反应抑制过程中起着关键作用[30],激活强度与认知控制有直接关联[10],评估抑制性控制功能的GO/NOGO任务范式研究中也发现右侧额下回激活[31]。在成瘾研究中发现,右侧额下回的皮层厚度降低[32],其激活强度也降低[33]。因此,本研究以右侧额下回为种子点作全脑功能连接,与正常组相比,海洛因成瘾者右侧额下回与后扣带、楔前叶连接增强,与顶下小叶连接降低,与感觉运动网络连接降低;且A+基因型海洛因成瘾者大脑右侧额下回与岛叶、内侧前额叶前扣带连接降低,与小脑连接增强。
3.2 抑制控制网络
与正常者相比,海洛因成瘾者抑制控制脑区右侧额下回到感觉运动网络的双侧顶叶功能连接降低,表明成瘾者对冲动觅药或吸食的行为抑制能力降低。前扣带参与自上而下的认知控制,抑制或克服不适反应,对行为进行监测,降低冲突[34]。A+基因型海洛因成瘾者抑制性控制脑区右侧额下回到前扣带区域功能连接降低,表明该类成瘾者外环境刺激或内环境变化时,前扣带对信息加工的冲突做出应答,引发右侧额下回认知控制的策略调节,抑制优势反应行为降低,可能无法阻止行为的冲突,导致再次觅药或复吸行为的可能。岛叶中具有较高密度多巴胺受体,在动机、情绪和成瘾行为中起着重要作用[35],在与自我监测和任务刺激间起到调节作用[36]。岛叶与前扣带、腹内侧前额叶皮层交互连接,负责对内脏信息或外界的刺激进行整合,对其冲突信息作出反应,决定机体的执行[36]。A+基因海洛因成瘾者右侧额下回到岛叶及腹内侧前额功能连接降低,表明,机体探测到突显刺激,传递抑制信号的能力减弱,可能导致认知控制下降。
小脑在以往成瘾研究中常被忽视,本研究表明可能在海洛因成瘾中也起着一定作用。一方面,小脑参与多项成瘾相关的脑功能改变,如运动、情绪记忆、计划、决策等多项功能[37]。小脑还参与抑制控制过程,并可能是成瘾的神经基础[16]。另一方面,小脑参与成瘾过程具有其解剖基础。小脑与大脑皮层、边缘系统和基底节间存在广泛的结构和功能连接,其中来自腹侧被盖区的多巴胺能神经元投射,可能是小脑参与海洛因成瘾的物质基础。对小脑在成瘾中的功能还需进一步探讨。
3.3 小结
局限性:(1)本研究只研究了右侧额下回与全脑功能连接,左侧额下回是否存在相同或相似结果,尚需进一步验证;(2)虽然可以根据实验结果推断可以功能连接的方向,但仍需技术方法验证。
总之,本研究利用基因技术对海洛因成瘾者DRD2 TaqIA基因进行分类,结合心理学与功能磁共振技术,探讨其调节抑制性控制过程中脑区的差异,结果表明海洛因成瘾者心理冲动性较高且抑制控制网络存在异常;与A-型相比,A+型海洛因成瘾者抑制控制能力更差,可能更易觅药或复吸。
利益冲突:无。

