采用静息态功能磁共振研究先天性重度感音神经性耳聋患儿相关脑区的ALFF值
刘梦秋,刘婕,刘影
作者单位:
中国科学技术大学附属第一医院(安徽省立医院),合肥 230001
大约有1‰~6‰新生儿出生时患有中度至重度感音神经性听力缺失,早期听力缺失可能影响听觉、语言和视觉发育的功能,许多研究发现耳聋患者的听觉皮层可以通过非听觉刺激,如视觉、语言和振动来激活。然而,耳聋导致语言等功能的变化机制需要进一步证据来支持,长期听力剥夺后听力相关脑区存在跨模式重组[1]。
先天性内耳畸形是儿童感音神经性耳聋(sensorineural hearing loss,SNHL)的重要病因,然而70%~80%的先天S N H L 的内耳影像学表现未见明显异常,20%~30%的患儿可见骨性内耳畸形[2]。动物模型的研究已经证明,幼年时期是听觉皮层发育的关键期[3]。皮层刺激不足或无刺激在可塑性的敏感时期,可能导致听觉和语言发育障碍。晚期植入人工耳蜗会使患儿的口语和语言能力受到影响。振幅低频波动(amplitude of low-frequency fluctuation,ALFF)是反映神经生理学的一个指标,本研究将通过比较失聪患儿和正常受试者的ALFF值来研究先天性重度感音神经性耳聋患儿因听觉剥夺而引起的脑区内在功能的变化。
1 材料与方法
1.1 研究对象(收集和去除被试的标准)
实验组:(1)选取出生后3 d及42 d未通过听觉脑干反应(auditory brain stem response,ABR)听力筛查的双侧先天性重度感音神经性耳聋患儿。所有婴幼儿的听觉脑干反应测试结果均大于90 db,表明严重的感音神经性听力损失。(2)聋儿MRI检查年龄为0个月至4岁。(3)除去各种中枢神经系统疾病,如脑白质发育不全、神经皮肤综合征、肿瘤、外伤、感染、癫痫等。(4)以往没有耳部的手术史。(5)以往没有服用过耳毒性药物的病史。
对照组:(1)患儿由于其他原因需做头颅磁共振扫描的检查,而后通过影像学手段查明头部并无异常;(2)所有对照组听力检查结果均为正常;(3)对照组年龄性别均与实验组匹配。
按照纳入及剔除标准,自2017年8月至2018年9月在我院共收集年龄0~4岁的双侧先天性极重度感音神经性耳聋婴幼儿共25例,其中0~2岁有16例,2~4岁9例;男13例,女12例,平均年龄(2.00±0.17)岁。对照组有20例,其中0~2岁共9例,2~4岁有11例。其中男有9例,女有11例,年龄为0~4岁,平均年龄(2.00±0.46)岁。依据大脑发育的关键时期(2岁)来分组,全部受试者检查前知情同意书由被试者父母签署,所有检查均由医院伦理委员会批准。
1.2 实验前准备
由于被试者年龄较小不能配合,在MRI检查前,所有婴儿口服10%水合氯醛,每公斤0.6 ml,最大不超过80 ml。待被试者熟睡后,检查前平卧于磁共振检查床上,头部用海绵垫固定,避免头动产生运动伪影。扫描过程中无任何任务需执行,让被试者安静地躺在检查床上。所有被试者均用MRI专用防噪音耳塞塞住外耳道,以减少噪音对被试者的干扰,并能保护被试者的听力。
1.3 实验数据采集及后处理方法
所有受试者均在GE 3.0 T磁共振扫描仪Discovery 750 W上进行扫描,详细的MRI序列包括:首先,获取全脑T1WI和T2WI的横断面图像。功能扫描成像采用血氧水平对比BOLD序列,详细参数为:TR 2000 ms,TE 30 ms,反转角90°,FOV 240 mm×240 mm,层厚4 mm,间隔0 mm,层数为33层,矩阵64×64,248帧,共计8480幅,扫描时间为8 min 16 s,无缝隙覆盖整个大脑。最后,采集矢状位3D结构像T1-3DBRAVO序列。
参数设置如下:TR 2000 ms,TE 3.2 ms,矩阵256×256,FOV 256 mm×256 mm,层厚1 mm,间隔0 mm,层数设为168层,反转角度9°,激励次数为1次,扫描用时为4 min 27 s。运用脑功能成像数据分析软件AFNI软件对图像进行后处理,先对每个被试的功能磁共振图像数据进行格式转换,即将保存在PACS系统中的DICOM格式的图像文件转换为AFNI数据处理需要的nii格式;去除最开始的10个时间点以排除干扰,进行头动校正,剔除三维平移大于1 mm和旋转角度大于1°的数据。对功能像数据进行重采样,将图像配准到标准空间上,然后对图像进行去线性漂移,减少诸多因素而造成的受试者图像数据偏离生理基线的程度;随后进行频域滤波以去除生理噪音。
1.4 统计学分析
组间分析:0~2岁耳聋患儿和2~4岁耳聋患儿与其相应的正常对照组、2~4岁耳聋患儿和0~2岁耳聋患儿分别进行组间比较分析(3 dttest),3 dttest是AFNI软件里的一个命令。得出两组之间的统计学差异,最后对组间分析结果进行MonteCarlo阈值校正,P≤0.005,计算出α≤0.01的最小数据簇大小(cluster size),得出ALFF值存在差异的脑区,统计并记录存在差异脑区以及信号类型。
2 结果
具体结果见表1~3和图1~3。
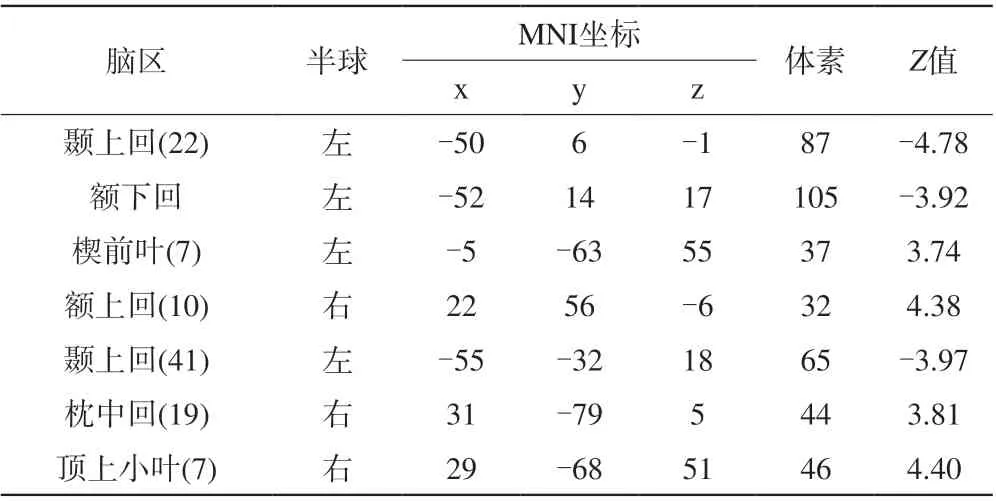
表1 0~2岁耳聋患儿与0~2岁正常被试的ALFF相比的组分析结果Tab. 1 Group comparisons of ALFF values between “younger” (0—2 years old) patients and age-matched healthy controls
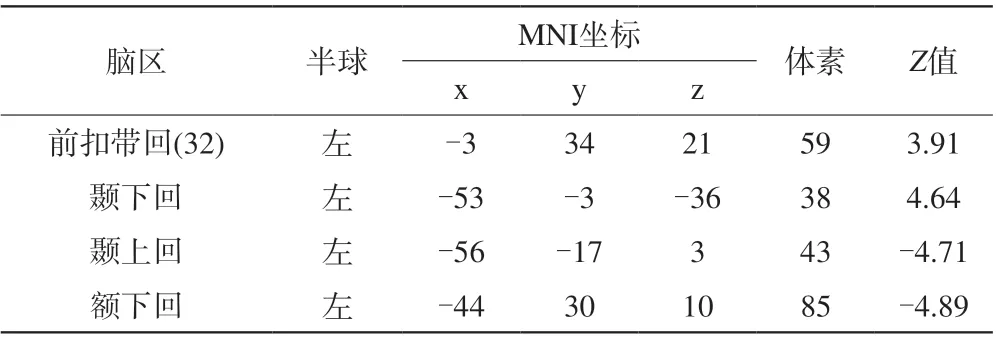
表2 2~4岁耳聋患儿与2~4岁正常被试的ALFF相比的组分析结果Tab. 2 Group comparisons of ALFF values between “older” (2—4 years old) patients and age-matched healthy controls
3 讨论
3.1 镇静状态下fMRl用于评价先天性感音聋儿听觉及语言相关脑区的可行性
本研究中由于患儿及被试者年龄较小,不能配合检查,需要在服用睡眠药物的情况下来研究相关脑区的ALFF值的改变。低频振荡信号在镇静状态下是否存在尚未明确,但目前已有一系列研究证实BOLD低频振荡信号存在于广泛的生理条件下,如清醒、麻醉状态的成人、轻度睡眠状态下、儿童及昏迷情况下[4-5]。有学者指出婴儿大脑在睡眠情况下有五种特殊的静息态网络,包括初级视觉皮层、双侧听觉皮层、双侧感觉运动区和默认脑网络,种种研究都表明镇静睡眠情况下仍存在ALFF信号[6]。因此镇静状态下对聋儿听觉及语言相关脑区的ALFF研究是可行的。
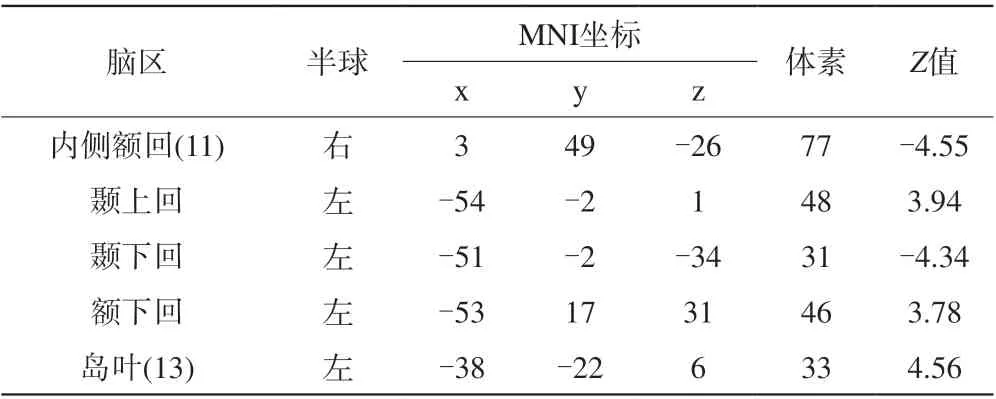
表3 2~4岁耳聋患儿和0~2岁耳聋患者的ALFF相比的组分析结果Tab. 3 Group comparisons of ALFF values between “older” (2—4 years old) and “younger” (0—2 years old) patients
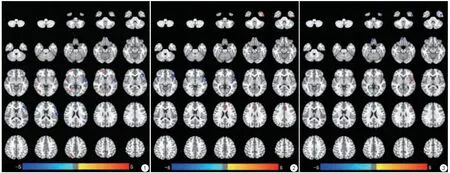
图1 0~2岁耳聋患儿与0~2岁正常被试的ALFF相比的组间分析结果 图2 2~4岁耳聋患儿与2~4岁正常被试的ALFF相比的组间分析结果图3 2~4岁耳聋患儿和0~2岁耳聋患者ALFF相比的组间分析结果Fig. 1 Comparison of ALFF values between “younger” (0—2 years old) patients and age-matched healthy controls. The averaged difference maps were displayed on a standard brain template. Fig. 2 Comparison of ALFF values between “older” (2—4 years old) patients and age-matched healthy controls. The averaged difference maps were displayed on a standard brain template. Fig. 3 Comparison of ALFF values between “older” (2—4 years old) and “younger” (0—2 years old) patients. The averaged difference map were displayed on a standard brain template.
3.2 听觉、语言脑区解剖及功能学定位
听觉脑区:包括初级听觉脑区(BA41区,颗粒型脑区)、次级听觉脑区(BA42区)及听觉联合区(BA22区)。语言相关脑区:包括双侧额中回、Broca区、Wernicke区。Broca区即左侧额下回后部(BA44、45区),Broca区在语言生成过程中具有多重功能,包括语音加工、高水平的语义加工、句子和谈话水平的加工,Wemicke区即左侧颞上回、颞中回后部、缘上回和角回。Holland等[6]对儿童群体的研究发现,随着年龄的增长,语言功能脑区优势化半球不断地向左侧发展,并且在语言发育时期左侧大脑半球受损时,语言处理功能转向右侧半球。因此,在大脑发育的早期阶段还无法说明语言功能是否完全存在偏侧化。所以本研究选择左侧语言相关脑区与右侧镜像语言相关脑区,即双侧额中回、额下回、颞上回、颞中回、缘上回、角回来作为0~4岁聋儿的语言相关脑区。
3.3 耳聋组与正常组组间比较ALFF值变化
本研究结果提示:镇静睡眠状态下耳聋组与之对应的正常听力组之间的比较ALFF值主要在听觉、语言处理相关的大脑区域下降。先前的文献也报道了严重的感音神经性听力损失的患者可能在语言和学习能力方面存在问题[7-8]。另外,在本研究中,发现0~2岁的聋儿组较相对应的正常听力组在右侧顶上小叶、左侧楔前叶(BA7)、右侧额上回(BA10)、右侧枕中回的ALFF值增加,2~4岁耳聋组较相对应的正常组比较在前扣带回(BA32)、左侧颞下回ALFF值增加,布德曼7区属于体感联合皮层,和空间定位有关,右侧顶上小叶也与空间定位有关。而布德曼10区为联合皮质区,参与前额叶皮质的整合功能。这表明与听力正常组相比,聋儿组的空间定向能力和躯体运动感觉增强。之前已有研究发现,在聋人身上,追踪物体和定向的能力得到了增强[9-10]。而右侧枕中回、左侧颞下回主要负责视觉信息的处理,提示在听力障碍的情况下会使视力能力增强[11]。另一项研究也表明,听觉剥夺后可以代偿使视觉能力增强,同时,在没有听觉刺激的情况下,视觉皮层对重组或神经可塑性更为敏感[12-13],行为研究也表明聋人有更好的视觉能力[14]。本实验结果显示耳聋组左侧楔前叶、前扣带回、左侧颞下回ALFF值高于正常组,扣带回被认为是边缘叶的一部分,它的作用包括情绪的生成和协调、学习和记忆,上述3种作用的整合深深影响我们行为的原因和后果[15]。它们都构成“默认网络”,因此可以推断听力障碍的病人的默认网络也许有了功能重塑。
3.4 耳聋组间的ALFF值的分析
Lonsbury-Martin等[5]研究表明,与正常听力者相比,年龄较小的耳聋患儿听觉皮层与相关脑区葡萄糖代谢较低,而这种低水平葡萄糖代谢则提示听皮质功能的可恢复性,并推测听皮质相对低水平葡萄糖代谢的缺失反映的是听皮质功能脑区被其他的认知功能脑区所取代,也提示听皮质功能的难恢复性及较差的语言认知能力。本研究中,2~4岁患儿与0~2岁患儿组间比较左侧颞上回及左侧额下回ALFF值升高,左侧颞下回ALFF值降低,提示随着耳聋持续时间的延长,听觉皮质及语言相关脑区的ALFF值逐渐升高,视觉相关脑区ALFF值降低,即发生不同程度的功能重组。由于听觉中枢的发育存在关键期,通常的观点认为先天性耳聋患儿人工耳蜗植入越早越好,但关键的年龄节点是多少,目前尚不明确[16]。由此,说明2岁后较2岁前听觉等相关脑区可能发生功能重组,进一步提示2岁后进行耳蜗移植,可能由于听觉及语言脑区发生较明显的功能重组而影响听力康复效果,推测这也是越早植入人工耳蜗效果越好的原因。
3.5 小结与展望
镇静状态下,与相应对照组相比,不同年龄段感音聋儿听觉及语言相关脑区ALFF值降低,视觉脑区、感觉系统相关脑区及默认网络ALFF值升高,说明耳聋患儿听觉、语言等相关脑区发生了功能重组,且随着耳聋持续时间延长,听觉及语言相关脑区ALFF值升高,推测2岁后进行耳蜗移植,会由于听觉及语言脑区发生功能重组而影响听力康复效果。
本研究的主要局限性是样本量较小,此外,耳蜗植入后对聋儿语言恢复的情况的临床资料尚未跟进。植入人工耳蜗后对聋儿相关听觉和语言脑区功能的影响在未来的研究中值得探究。
利益冲突:无。

