磁化率定量成像评估靶向药物对肺腺癌伴脑转移治疗反应的随访一例
李雪平,张鑫,李茗,张庆雷,张冰*
作者单位:
1. 南京医科大学鼓楼临床医学院,南京 210000
2. 南京大学医学院附属鼓楼医院医学影像科,南京 210000
1Nanjing Drum Tower Hospital Clinical College of Nanjing Medical University, Nanjing 210000, China
2Department of Radiology, Nanjing Drum Tower Hospital, the Affiliated Hospital of Nangjing University Medical School, Nanjing 210000, China
患者男,65岁。无明显诱因出现头痛及胸痛1个月余,伴有乏力纳差消瘦,2016年4月18日收治入院。首诊影像表现:胸部CT示左肺上叶肺癌可能。肺穿刺活检病理及基因检测:左肺腺癌。肺组织示肺泡上皮异性增生,部分区域间异型纤体浸润性生长(图1A)。免疫组化示癌细胞表达KI67约67% (+)、HER2 (0)、EGFR (+)、ERCC1 (++)、BRCA1 (-)、PD-L1(-)、E-CAD (+)、VIM。免疫组化及基因检测示EGFR阳性,EGFR基因第21外显子携带L858R突变。头颅MRI示双侧额叶及左侧枕叶见多发结节状异常信号影,呈环形强化(图1B),其中左侧枕叶病灶呈短T1信号(图1C),余脑内未见明确短T1信号影(图1D)。诊断印象:考虑为脑内多发转移瘤,左侧枕叶病灶伴瘤内出血可能。
入院诊断及治疗经过:左肺腺癌IV期,患者于2016年4月口服一代分子靶向药物EGFR-TKIs (吉非替尼),每2个月常规影像随访一次。2017年4月产生耐药后,改换三代靶向药物AZD9291,继续随访至2018年4月,共随访11次,其中随访第18、21及24个月增加了高分辨头颅磁化率定量成像(quantitative susceptibility mapping,QSM)。患者于2018年6月去世。
随访影像表现:(1)脑内多发环形强化病灶的转归:治疗2个月后、4个月至24个月,脑内均未见异常强化病灶。随访第24个月QSM示上述病灶呈多发结节状负信号(图1E),信号数值范围为-0.596~-0.295 ppm,考虑为多发钙化。(2)左侧枕叶短T1病灶的转归:治疗2个月后,左侧枕叶病灶短T1信号转变为长T1信号,增强后无强化,4~24个月无变化,随访24个月QSM示左侧枕叶见结节状正信号影(图1F),测量信号数值为0.845 ppm,考虑为含铁血黄素沉积。(3)随访中新发病灶的转归:随访24个月QSM示上述病灶呈多发点状负信号影(图1G),信号数值范围为-0.337~-0.279 ppm,考虑为多发钙化。靶向药物治疗前(图1D)、治疗2个月及4个月后脑内未见明显异常短T1信号影,随访6个月,脑内见新发多发点状短T1信号(图1H),增强后未见强化,之后至24个月,未见明显变化。(4)肺癌的体积随访变化:肺癌体积计算采用V=最大截面积×层厚×层数×π/6来评估(经Shapiro-Wilk检验P>0.05,数据呈正态性分布),患者首诊胸部CT肺癌体积为V0=11690.6 mm³,治疗2个月后V1=3778.5 mm3,以V1为参考值,采用单样本t检验分析患者靶向药物治疗4~24个月随访期间肺癌体积变化与V1之间的差异,结果显示无统计学意义(P=0.198)。使用SPSS软件(版本21;IBM,芝加哥,美国),P<0.05为差异有统计学意义。
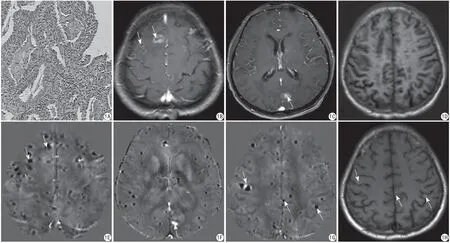
图1 患者,男,64岁。A:HE染色( ×200),肺泡上皮异性增生,部分区域间异型纤体浸润性生长。B~D:靶向药物治疗前。B:头颅T1WI增强示双侧额叶见多发环形强化灶(白箭);C:头颅T1WI增强示左侧枕叶见结节状短T1信号影,增强后可见强化(白箭);D:头颅T1WI平扫示脑内未见明显异常短T1信号影。E~G:治疗24个月后,高分辨头颅QSM检查。E:首诊双侧额叶多发环形强化病灶呈结节状负信号影;F:首诊左侧枕叶短T1信号病灶呈正信号影;G:治疗6个月后脑内新发多发点状短T1信号病灶呈负信号影。H:靶向药物治疗6个月后,T1WI平扫示脑内见多发新发点状短T1信号影Fig.1 A 64-year-old male patient. A: The results of HE staining ( ×200), heterosexual proliferation of alveolar epithelium and infiltrating growth of some interregional dysplasia. B—D: Before treating with molecule-targeted drugs. B: Axial pro-contrast T1WI shows multiple nodules with ring-enhancement in the bilateral frontal lobe (white arrow). C: Axial pro-contrast T1WI shows a nodule that demonstrates short T1 signal with enhancement in the left occipital lobe (white arrow). D: Axial pre-contrast T1WI doesn't demonstrate any short T1 signals in the cerebral hemisphere. E—G: After treating with molecule-targeted drugs for 24th months. The patient underwent brain QSM examination. E: Multiple nodules with ring-enhancement in the bilateral frontal lobe at first diagnosis show low susceptibility values. F: The lesion in the left occipital lobe shows a high susceptibility value. G: Multiple new lesions after treating with molecule-targeted drugs for six months show low susceptibility values. H: After treating with molecule-targeted drugs for six months. Axial pre-contrast T1WI demonstrates multiple nodules with short T1 signals in the cerebral hemisphere.
讨论 肺腺癌是发病率和病死率较高的恶性肿瘤,50%以上的患者会出现脑转移,大多数肺腺癌患者存在EGFR表达或过表达[1],分子靶向药物较广泛应用治疗中晚期患者。本例患者肺癌体积变化的统计结果说明靶向药物治疗后肺部肿块对药物的早期反应明显,治疗后病灶体积明显减小,但是治疗2个月之后,直至中晚期,病灶不再缩小,体积呈稳定趋势,提示早期疗效显著,中晚期疗效稳定在一定水平。
脑内多发转移瘤在增强MRI上呈环形强化,与血脑屏障破坏及肿瘤血管增生有关。由于靶向药物为小分子药物,可通过血脑屏障,以表皮生长因子受体酪氨酸激酶作为靶标,抑制受体酪氨酸激酶的活性,来抑制肿瘤血管生成和细胞增殖[2]。因此,在治疗随访全过程中,病灶未见异常强化及增大,随访后期,经QSM证实病灶转归为钙化,证明靶向药物治疗可抑制脑转移瘤病灶的生长及促进病灶内钙盐沉积。
根据短T1信号的形成原理,左侧枕叶短T1病灶,可能为出血,也可能为钙化。而QSM与常规磁共振相比,是唯一能从信号数值上定量区别出血(0.4~2.5 ppm)及钙化(-1.2~-0.6 ppm)的成像方法[3],该病灶经QSM证实为出血。瘤内出血可能由于肿瘤新生血管增多,血管壁发育不成熟导致血管脆性增加而发生破裂,也可能提示是靶向药物治疗控制不佳的病灶。
随访中新发的多发短T1病灶,可为钙化或微出血,随访后期,经QSM证实为钙化。由于常规MRI对微出血及钙化显示均不敏感,头颅CT虽可检测钙化,但对微小钙化及微出血显示不佳,且存在电离辐射,而QSM是高分辨磁化率成像(分辨率为0.6 mm×0.6 mm),对≥0.6 mm的微出血及钙化显示敏感,而且不存在辐射损伤,有利于转移瘤患者多次长期复查。因此,我们建议在肺癌伴脑转移靶向药物治疗的患者随访中,可在常规头颅MRI的基础上加入QSM序列,可以更好地观察评估转移瘤对药物的治疗反应。
利益冲突:无。

