SLC12A3 基因新突变致Gitelman 综合征1 例
王静 张玲玉 范红旗 秦瑶 张梅
南京医科大学第一附属医院内分泌科 210029
Gitelman 综合征( GS) 是一种常染色体隐性遗传的肾小管疾病,由编码噻嗪类敏感的钠氯同向转运子( NCCT) 基因发生突变所致,在亚洲的发病率为1/40 000 ~10/40 000[1]。患者通常表现为手足抽搐,有时伴有腹痛、呕吐或发热等非特异性症状。由于其与Batter综合征的临床表现极其相似,均以低血钾为首发表现,且起病较隐匿,在临床上极易造成误诊、漏诊,以致延误治疗。
现报道1 例南京医科大学第一附属医院内分泌科收治的GS 患者。基因测序发现SLC12A3基因位点V142L和D486N杂合突变,其中V142L为新突变位点。
1 病例介绍
先证者,27 岁,女性,因“反复肢体麻木及双下肢痉挛2 年余”于2017 年2 月15 日入院。该患者两年来反复出现面部、肢体麻木,并伴有突发的四肢抽搐症状,至当地医院就诊,查血钾低于3 mmol/L,给予口服氯化钾缓释片及螺内酯治疗后患者症状好转,但血钾始终未达3.5 mmol/L。2017 年2 月,患者突发下肢痉挛,伴严重呼吸困难。为进一步诊治收入南京医科大学第一附属医院内分泌科病房。患者既往无特殊病史,无使用泻药或利尿剂及酗酒的情况。其父母亲非近亲结婚,家庭成员没有类似的症状。
入院体格检查: 体温36.8℃,脉搏90 次/min,呼 吸18 次/min,血 压100/80 mmHg ( 1 mmHg=0.133 kPa),体重56 kg,身高160 cm,体重指数21.9 kg/m2。体型匀称,心、肺、腹( -) ,脊柱四肢无畸形,双下肢无水肿,双侧足背动脉搏动正常。双下肢肌力4 级。肱二头肌腱、肱三头肌腱、膝腱、跟腱反射存在。病理征阴性。
入院实验室检查: 中度低钾血症、低镁血症、低尿钙症、代谢性碱中毒、血浆肾素和醛固酮水平增加。具体实验室检查结果见表1。
此外,24 h 尿钾、钾排泄分数( FeK) 和随机尿钾/肌酐( uK/Cr) 在高尿钾症的诊断中具有重要意义[2-3]。该患者估算的肾小球滤过率( eGFR) >60 ml/min,肾功能良好,24 h 尿钾、FeK 和uK/Cr均明显升高,其低钾血症考虑肾性失钾所致,具体结果见表2。影像学和心电图检查无明显异常。
基因检测结果: 通过对SLC12A3 的26 个外显子区进行Sanger直接测序,发现该患者存在两个突变位点:V142L和D486N。其中,D486N与GS 发病相关[4]。V142L未见文献报道,是本研究发现的新突变位点。该突变位于编码区第424 号核苷酸位置,由鸟嘌呤变异为胸腺嘧啶,导致氨基酸改变p.V142L( 第142 号氨基酸由亮氨酸代替缬氨酸) ,为错义突变。进一步对其家系进行基因检测,发现其母亲存在V142L杂合突变,其父亲存在D486N杂合突变,其后代存在V142L杂合突变,均无低钾血症临床症状及生化改变。由于GS 属于常染色体隐性遗传病,杂合子不发病符合遗传规律。图1( 封三)展示了该患者家族谱系和具体的基因突变位点。
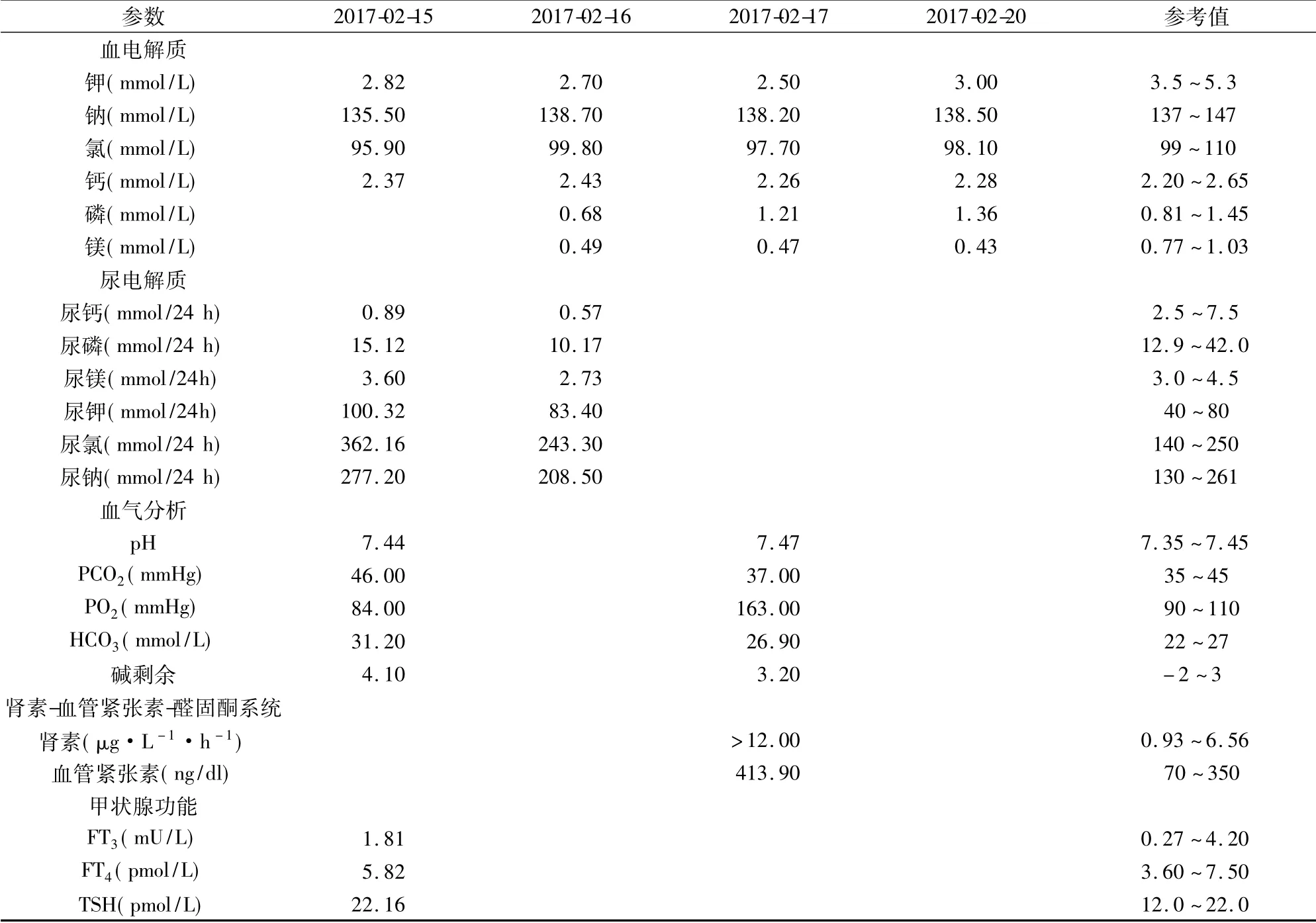
表1 患者住院期间实验室检查结果
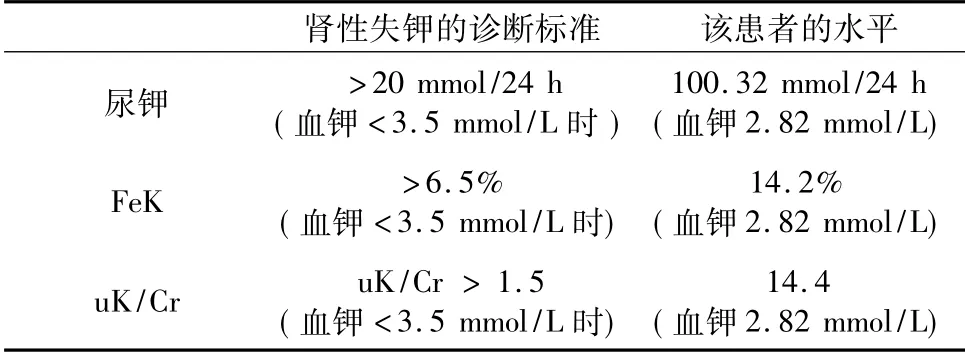
表2 患者的尿钾、FeK、uK/Cr
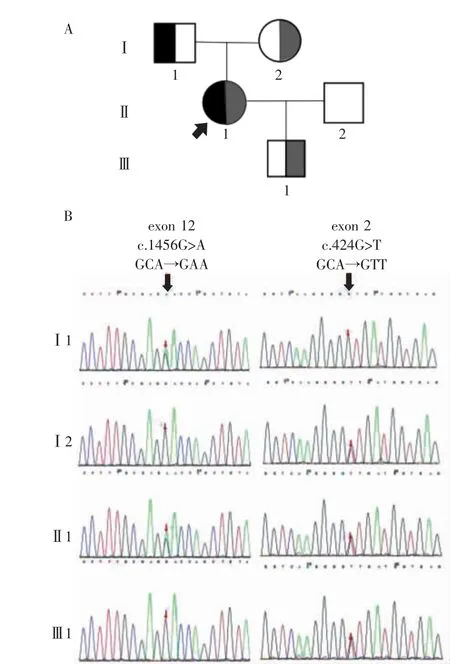
图1 患者家族谱系中的基因突变情况
计算机辅助鉴别有害的变异体: SIFT( http: //sift.jcvi. org/)[5]和PROVEAN( http: //provean. jcvi.org/index.php)[6]是两款用于评估外显子区变异是否损伤蛋白质功能的常用工具程序。SIFT软件输出的分值区间为0 ~1,当变异体得分≤0.05 时,判定为有害的( damaging) ,>0.05 时则判定为可接受的( tolerated) 。类似的,PROVEAN对位点保守性的评分若≤-2.5,则判定为有害的影响( deleterious) ,反之则是中性的变异( neutral) 。本研究中发现的两个错义突变均被判定为有害的变异,见表3。
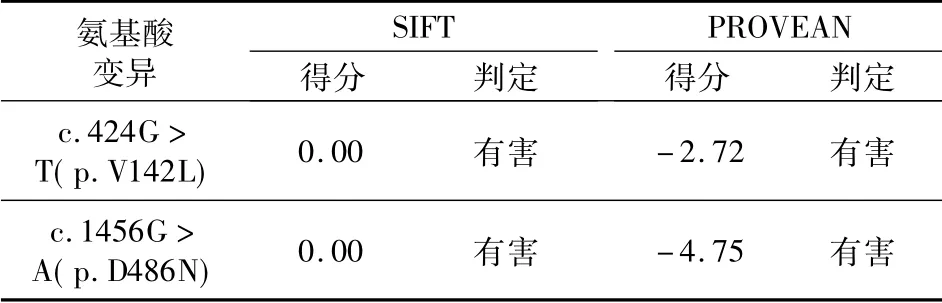
表3 氨基酸序列变异对蛋白质功能的影响
治疗及预后:根据患者症状及相关检查,临床诊断为GS。口服给予氯化钾缓释片1 g,一天3 次;口服门冬氨酸钾镁片0.6 g,一天3 次; 口服螺内酯40 mg,一天3 次。治疗后,患者的临床症状缓解,血钾维持在3.0 ~3.2 mmol/L。出院后1 年内随访,患者未出现严重低血钾事件。
2 讨论
1966 年,Gitelman等[7]首次报道了3 例血压正常、代谢性碱中毒,血浆肾素和醛固酮水平增加,低钾、低镁血症,血钙正常和低尿钙的患者,命名为GS。1996 年,Simon等[4]克隆出SLC12A3的cDNA,从而鉴定出SLC12A3 基因突变为GS 的致病原因。SLC12A3基因定位于16q13,包含26 个外显子,其编码的NCCT是含有1 021个氨基酸的多肽,有12 个跨膜结构域,胞内有亲水的氨基端和羧基端,是噻嗪类利尿剂的作用位点。人类NCCT特异性表达在肾脏远曲小管( DCT) ,肾小球滤过的Na+和Cl-约7% ~10%在此部位重吸收[8]。SLC12A3 基因突变导致NCCT 结构异常和功能障碍,使DCT 对Na+重吸收减少,流经集合管的Na+增多,促进此部位的Na+-K+交换和Na+-H+交换,尿钾排泄增多。同时,由于镁离子通道( TRPM6) 数量下降,使镁离子重吸收减少[9]。此外,Na+/Cl-联合转运异常可使细胞内Cl-的超极化作用减弱,Ca2+回吸收增加,尿钙减少[10]。最终患者发生低钾血症、低镁血症、低尿钙以及代谢性碱中毒。同时,由于血容量的缩减,患者血压偏低,促进肾素-血管紧张素和醛固酮的分泌,加重低钾血症和代谢性碱中毒。本例患者存在低钾血症、代谢性碱中毒,且肾素、血管紧张素水平均明显升高( 表1) ,与既往研究相似。
本例患者临床症状主要为肌肉痉挛,实验室检查提示血钙大致正常,血镁及尿钙偏低。通常GS患者血浆钙水平正常,肌肉痉挛的原因是由于低镁血症[11]。低血镁可引起甲状旁腺激素合成受损、分泌减少及终末器官对甲状旁腺激素和维生素D 的抵抗。此外,有些患者的血浆总钙浓度正常,但钙离子降低,这也可能是出现肌肉痉挛的原因[12]。
目前已报道SLC12A3基因有425 个GS 相关突变,其中包含268 个错义或无义突变,46 个小缺失突变,22 个大缺失突变,57 个剪接突变,22 个小插入突变,5 个小indel突变,4 个插入突变和1 个复杂重排[13]。本研究发现,该患者两个错义突变位点均为有害的变异,具体如何影响蛋白结构从而致病目前尚不知,需进一步完善功能试验以明确突变的具体意义。此外,虽然GS 是常染色体隐形遗传病,但只有18%的患者是纯合子,约45%是复杂杂合子,有高达30%的患者是单杂合子[14]。Xia等[15]分析252 例GS 患者的基因型与低钾水平的关系,发现复合杂合子或纯合子突变患者的血清钾水平低于单杂合子突变的患者;胞外突变的患者血清钾、镁水平也明显低于胞内、跨膜突变的患者。本例患者为复合杂合子,突变位点均位于胞内( 图2,封三) ,血钾水平始终在2.5 mmol/L 左右。
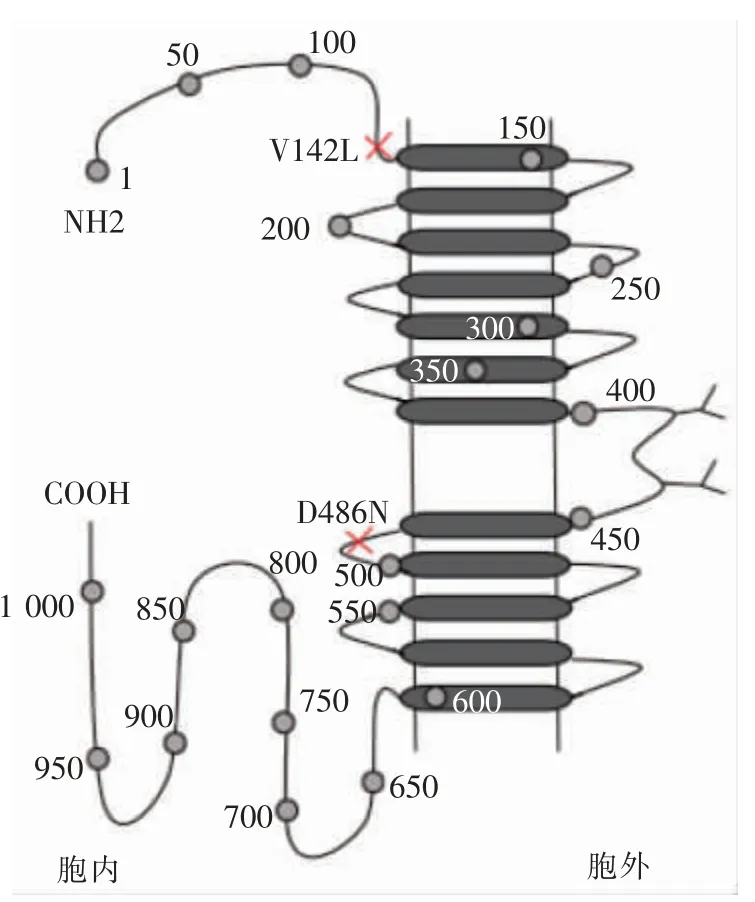
图2 NCCT 蛋白的示意图
GS 的治疗主要是高钠和高钾饮食,同时补充氯化钾和镁制剂,其中门冬氨酸镁、乳酸镁和氯化镁的生物利用度比硫酸镁和氧化镁高,但应注意口服大量镁制剂会导致腹泻,一般推荐氯化镁4 ~5 mg/( kg·d) 。此外,应同时用醛固酮拮抗剂或集合管上皮钠通道抑制剂以减少尿钾排泄[16]。此患者通过补充钾、镁及使用螺内酯治疗后,病情趋于稳定。
综上所述,GS 是低钾血症的罕见原因之一。本文通过基因检测明确了1 例表现为肌肉痉挛的GS患者。此患者SLC12A3存在V142L和D486N杂合突变。此外,完善家族谱系研究可以发现无症状的GS患者。通过给予适当治疗方案,患者预后良好。
本研究首次发现了SLC12A3 的新突变位点V142L,根据计算机辅助软件分析两个错义突变均为有害的变异,推测新的突变位点导致蛋白结构的改变,从而影响其功能。需进一步完善功能试验明确新突变位点与疾病的内在联系。此次新发现的SLC12A3 基因突变不仅丰富了GS 基因突变谱,而且有助于指导临床治疗。

