新城疫病毒昌吉株F基因的生物信息学特征分析
马吉强,刘建华
新疆农业大学动物医学学院,乌鲁木齐 830002
禽新城疫(ND)是由禽新城疫病毒(NDV)引起的一种度接触性急性传染病,NDV是禽副黏病毒Ⅰ型(Pigeonparamyxovirus1,PPMV-1)为唯一的成员,也是家禽养殖户的头号“杀手”[1]。其症状主要以呼吸系统、消化系统和神经系统的病变为特征,且传播迅速快,发病率与死亡率高[2]。新城疫病毒F基因的遗传变异与新城疫病毒的变异和流行具由密切的相关性,是NVD分子流行病学研究的首选基因。先前的学者多以NDVF基因全长序列来分析分子进化关系,但随着生物信息学的不断深入研究,有学者[3,4]发现NDVF基因的第1~374位核苷酸序列,在同源性、分子进化分析、流行病学调查等方面与全长序列完全一致。
本研究通过F基因的第1~374位核苷酸设计一对特异性引物,使用RT-PCR扩增、测序及序列分析,分析NDV-CJ株的同源性、分子进化及其氨基酸的理化特性、蛋白质结果特点,同时分析了分离株NDV-CJ株F基因的分子特征,为昌吉地区新城疫病毒的流行特点及预防提供理论依据。
1 材料与方法
1.1 菌(毒)株和质粒
新城疫病毒分离株NDV-CJ株由本实验室分离鉴定保存,大肠杆菌(Escherichiacoli,E.coli)DH5α,pMD18-T载体均购自宝生物工程(大连)有限公司(TaKaRa)。
1.2 主要试剂
DL-2000DNAMarker、2×PCRMix、1×TAE电泳缓冲液、Trizol、反转录试剂盒、基因组DNA提取试剂盒、pMD19-T载体和SolutionⅠ连接酶均购自大连宝生物工程有限公司;琼脂糖凝胶DNA回收试剂盒,诺维森生物公司;LB液体培养基、LB固体培养基及LB选择性固体培养基(Amp)均由本实验室自制。
1.3 NDV-CJ株的F基因RT-PCR扩增
根据GenBank及国内外已公布的F基因序列(登录号:A03663.1),采用Primer5.0设计了1对NDV的F基因序列特异性引物,用于实验室快速检测NDV:上游引物F1:5’-TTGATGGCAGGCCTCTTGC-3’,下游引物F2:5’-GGAGGATGTTGGCAGCAT-3’。预期扩增NDV的F基因片段大小为364 bp,引物由上海生工生物工程股份有限公司合成。
无菌取新鲜接种的鸡胚尿囊液(JIF),使用病毒全基因组RNA提取试剂盒提取NDV-CJ的总RNA。按照清除基因组DNA反转录试剂盒说明书进行反转录反应。通过对NDV F基因克隆以检测NDV-CJ株,PCR反应体系为20 μL,如下表1所示:反应条件为:95°C预变性5 min,35个循环(95°C变性10 s,55°C退火30 s,72°C延伸90 s),72°C延伸10 min,4°C保存待用。

表1 PCR反应体系的组成
1.4 目的片段的载体构建
配置1%琼脂糖凝胶,取上述获得的PCR产物5 μL,以100 V的电压进行电泳20 min左右。将目的条带切下后,按照琼脂糖回收试剂盒说明书将目的片段回收。并与pMD18-T载体,充分混合均匀后,置4°C条件连接过夜。所使用的连接体系(10 μL)为:目的条带回收产物5 μL、SolutionⅠ5 μL、pMD19-T载体0.5 μL。电转化将重组质粒导入E.coliDH5α感受态细胞中,经菌液PCR鉴定,将鉴定为阳性的菌液扩大培养,经质粒提取试剂盒提取质粒后送华大基因(北京)科技有限公司测序。
1.5 序列分析
通过BLAST将NDV的F基因的测序拼接结果后,采用Mgea6.0软件构建不同来源的NDV的F基因核苷酸系统进化树;利用生物信息学分析软件(见表3-2所示)分析其编码蛋白的基本理化性质、疏水性、可溶性、结构域、跨膜区、信号肽、亚细胞定位、磷酸化位点、糖基化位点、二级结构和三级结构等。

表2 蛋白质功能和结构预测相关软件网站
2 结果与分析
2.1 RT-PCR扩增结果
将NDV-CJ分离毒接种鸡胚后收集的新鲜尿囊液提取病毒总RNA后,经过清除DNA和反转录等步骤的处理,使用RT-PCR扩增,产物经1%琼脂糖凝胶电泳检测获得约364 bp特异性条带,与预期相符。即说明现有条件下本研究设计的F基因引物具有良好的特异性(见图1所示)。

图1 NDV-CJ F基因RT-PCR扩增产物
2.2 PCR扩增产物重组质粒的鉴定
将PCR产物经经1%琼脂糖凝胶电泳检测获得与预期相符的特异性条带,切胶后使用琼脂糖回收试剂盒回收目的片段,使用SolutionⅠ将回收的目的条带连接到pMD19-T载体上,再经转化、筛选、菌液PCR验证等,提取质粒后再次PCR扩增得到了约364 bp特异性条带(见图2所示),与预期相符。即说明成功将目的基因连接到pMD18-T载体上,且在导入E.coliDH5α感受态细胞中。

图2 菌液PCR鉴定结果
2.3 F基因序列分析
经测序结果发现,本实验使用的F基因特异性引物扩增处NDV-CJ分离毒的F基因,片段大小为364 p,与预期相符。并采用DNAMAN软件推导出其氨基酸的序列,由121个氨基酸组成。在NCBI在线Blast分析发现,与NDV的强毒株具有高同源性,且属于VII型,其典型特征明显:存在特征性氨基酸分别为K(第81位)和V(第101位),其他分型的NDV在第81位和第101位的氨基酸分别为R和I。
2.4 系统进化树的构建
为了研究NDV-CJ的F基因序的分子进化关系,使用MEGA6.0软件,采用邻接法(Neighbor-Joining,NJ),利用自举分析(Bootstrap,1000次重复)检验各分支的置信度,构建该基因及GenBank中检索到的15株NDV的F基因序列的系统进化树。由图3可知,分子系统进化关系与种属有密切关系,而与病毒的来源关系不大。本实验分离获得NDV-CJ属于VII分型,与Y98和TW/2000分离株遗传进化关系较为接近,均属于VIId分型。

图3 F基因的系统进化树
2.5 F蛋白的结构和功能预测
2.5.1 F蛋白理化性质
ExPASY在线ProtParam工具分析NDV-CJ分离毒F蛋白的理化性质,预测显示该蛋白分子质量约为12.83kD,其分子式为C561H953N163O166S6,理论等电点(PI)为10.12;由121个氨基酸组成,其中亮氨酸(Leu)最高(9.9%),正电荷残基数(Arg,Lys)16个、负电荷残基数(Asp,Glu)7个(见表3所示)。在哺乳动物体外培养的细胞中理论半衰期为30 h;脂溶指数为101.57,总平均疏水性为0.056,不稳定指数为48.14。

表3 F蛋白氨基酸组成
2.5.2 F蛋白氨基酸序列的疏水性分析
应用ProtScale在线软件预测表明,沿着F蛋白的肽链走向,亲/疏水性氨基酸均有分布,在第23位氨基酸处有最大疏水值为2.944,在第112位氨基酸处有最小疏水值均为-2.578,说明F蛋白有较强的疏水区域,该蛋白多肽链大部分区域分值为正值,说明该蛋白为疏水性蛋白(见图4所示);SOSUI在线软件预测NDV-CJF蛋白的可溶性,显示该蛋白属于可溶性蛋白。

图4 NDV-CJF蛋白疏水性分析
2.5.3 F蛋白的结构预测
在线软件预测NDV-CJF蛋白,分析发现该蛋白不存在结构域和跨膜结构。SignalP5.0Server在线软件预测该蛋白具有信号肽序列,具体序列:MGPRPSTKNPVPMMLTVRVALVLSCICPANS,说明F蛋白可能在跨膜运输中有信号识别作用;剪切位点位于第31~32位氨基酸,表明成熟肽始于第31位氨基酸(见图5所示)。TargetP1.1程序预测F蛋白亚细胞定位,分析显示分泌信号通路位点(SP)可能性为0.839,其他位点可能性为0.025,说明该蛋白属于分泌蛋白。
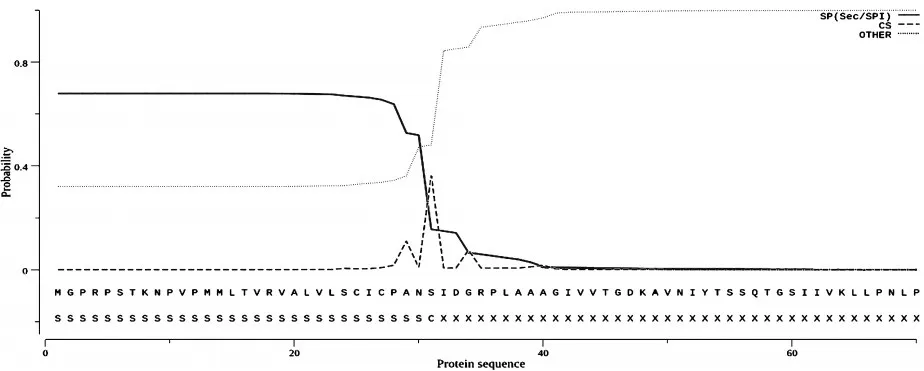
图5 NDV-CJF蛋白的信号肽预测
2.5.4 F蛋白磷酸化和糖基化预测
采用NetPhose3.1Server在线软件预测NDVCJF蛋白的磷酸化位点,显示当潜在磷酸化位点的阈值为0.5时,F蛋白存在16个潜在的磷酸化位点,其中包括7个丝氨酸(Ser)位点、8个苏氨酸(Thr)位点和1个酪氨酸(Tyr)位点(见图6所示),且该蛋白可能有 PKC、PKA、unsp、cdc2、INSR、DNAPK、ATM、CKⅠ、p38MAPK等9种保守性蛋白激酶位点。采用NetNGlyc1.0Server预测F蛋白蛋白糖基化位点时发现,F蛋白含有1个糖基化位点,NRTL峰为0.7610(见图7所示)。

图6 NDV-CJF蛋白磷酸化位点预测
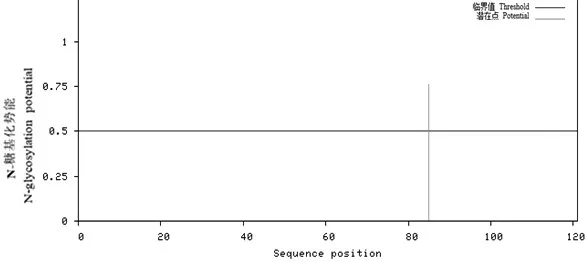
图7 NDV-CJF蛋白糖基化位点预测
2.5.5 F蛋白的二级和三级结构预测
通过SOPMA软件对新疆分离株F蛋白的二级结构进行预测,发现该蛋白含有42个α-螺旋(34.71%)、2个β-转角(1.65%)、53个无规则卷曲(43.80%)和24个延伸链(19.83%)(见图8所示)。以SWISS-MODEL预测得到F蛋白质的三维结构模型(见图9所示),该模型以第38~105位氨基酸残基建模的单链空间构型,与模板序列1g5g.1(3.30Å)的相似度为0.51%[5],序列一致性为91.11%。
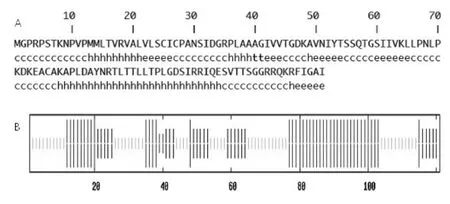
图8 NDV-CJF蛋白的二级结构预测

图9 NDV-CJF蛋白的三级结构预测
3 讨论
随着生物信息学的不断深入研究以及技术方法的不断更新,对序列分析及分子进化树的更加全面及针对性。目前F基因被广泛应用于NDV的快速诊断,沈志强等[6]在2003年通过RT-PCR扩增了F基因第1~374位核苷酸,通过与标准弱毒株(Clone30株)和我国标准强毒株(F48E9株)序列的同源性对比及F基因裂解位点氨基酸,判断分离株属于强毒株,且结果也与毒力测定结果相一致。吴杨通过对分离株F基因与选取的38株NDV构建分子进化树,获得了分离株的基因分型,同时了解了该分离株与近年流行株具有较近的遗传距离。本研究设计了一对F基因特异性引物(预期扩增目的片段364 bp),经RT-PCR扩增、测序及构建分子进化树,发现NDV-CJ株属于VIId基因分型,且与疫苗株(LaSota/46株)遗传距离较远,与Y98和TW/2000分离株遗传进化关系较为接近。表明该规模化养殖鸡场的新城疫病毒并不是疫苗免疫所引起,而是通过其他途径感染了近年来流行的的强毒株。
NDV的融合蛋白(F)具有使病毒囊膜与宿主细胞膜融合,使病毒穿入宿主细胞膜的作用[7]。故F蛋白裂解位点区氨基酸的组成和排列顺序不同,决定了新城疫病毒的毒力差异。故本研究针对F基因(364 bp)基酸序列进行结构和功能预测,结果表明F蛋白是一种偏碱性(PI理论值为10.12)、不稳定(不稳定指数为48.14,<40为稳定蛋白)和可溶性蛋白质。F蛋白在哺乳动物体外培养的细胞中半衰期长达30 min,表明该蛋白质可能含有信号肽序列并属于分泌蛋白。信号肽预测发现该蛋白含有信号肽序列:MGPRPSTKNPVPMMLTVRVALVLSCICPANS(剪切位点位于第31~32位氨基酸);亚细胞定位预测分析表明该蛋白属于分泌型蛋白。表明了蛋白质半衰期的长短在信号肽引导亚细胞定位中具有差异性,其结果与贾浩等[8]研究结论相一致。
蛋白二级结构中α-螺旋化学键能高,不易变形,可塑性低,起稳定蛋白骨架作用;β-转角和无规则卷曲易变形,可塑性高,存在蛋白质的空间结构等特点,利于与抗体结合,成为抗原表位的的可能性较大[9]。本研究采用在线生物信息学软件对F基因氨基酸序列进行结构相关的预测,结果表明该蛋白二级结构含有34.71%α-螺旋和43.80%无规则卷曲,且该蛋白三级结构也是以无规则卷曲和α-螺旋为主构成三维空间结构。综上结果所述,表明该蛋白具有稳定蛋白骨架作用,又具有较高的可塑性,有抗原表位的可能,这些结果为F基因第1~374位核苷酸可以与全长序列功能相当提供了坚实的理论依据。

