非洲菊单倍体植株生根研究
单芹丽,李绅崇,吴丽芳,余蓉培,李 帆,吴 旻,阮继伟,汪国鲜*,杨春梅*
(1.玉溪云星生物科技有限公司,云南 玉溪 652604;2.云南省农业科学院 花卉研究所/国家观赏园艺工程技术研究中心,云南 昆明 650205)
非洲菊(Gerberahybrida)为菊科大丁草属多年生宿根草本植物,是世界著名的五大鲜切花之一,属异花授粉植物,基因型高度杂合[1-2],品种间杂交后代的性状分离广泛[3],造成非洲菊自交系的选育非常困难。常规杂交方法通常需要4~6代、花费6~7年的时间才能获得纯合的自交系[4]。通过胚珠培养诱导的非洲菊单倍体植株,经染色体加倍培育成纯合二倍体,可快速获得自交系[5-6]。
笔者通过前期研究的积累,已培育出大量单倍体植株,结果表明:非洲菊单倍体开花植株与栽培品种杂合二倍体相比,株型较小[7-8]。因此,可根据开花植株的形态特征和生长特性鉴定出单倍体,通过考察和测定单倍体开花植株的园艺性状,快速筛选具有目标性状的非洲菊单倍体进行新品种培育。但非洲菊单倍体的组培苗生根较困难。目前,非洲菊的商业品种大部分为杂合二倍体[9],前人在基因型、基本培养基、植物生长调节剂、外植体类型、附加物添加等因素对非洲菊杂合二倍体生根的影响已开展了相关研究[10-12]。但是,非洲菊单倍体植株生根的相关研究报道较少,缺乏系统性研究。基于此,本试验以非洲菊单倍体和杂合二倍体植株为材料,比较培养基成分对非洲菊单倍体和二倍体的开始生根时间、生根率、根数、根长、株高和鲜重影响的差异,探究培养基和基因型对单倍体植株生根的影响,筛选单倍体生根的最佳培养基,并进一步研究不同单倍体在相同培养基中的生根效果。通过了解非洲菊单倍体植株的生根情况,旨在为培育单倍体开花植株奠定基础,推进非洲菊单倍体育种进程。
1 材料与方法
1.1 试验材料
材料来自云南省农业科学院花卉研究所培育的组培繁殖苗,杂合二倍体R1由非洲菊品种红极星花蕾诱导培育而来;单倍体qH1由非洲菊品种红极星胚珠诱导培育而来,单倍体qQ6和qQ12由非洲菊品种秋日胚珠诱导培育而来,单倍体qW25由非洲菊品种白马王子胚珠诱导培育而来,单倍体qY17由非洲菊品种阳光路胚珠诱导培育而来。以上试验材料株系的继代次数都已超过10次。
1.2 试验设计
先以同一非洲菊品种来源诱导培育的杂合二倍体R1(花托诱导培养的再生植株)和单倍体qH1(胚珠诱导培养的再生植株)组培繁殖苗为材料,接种在4种(A、B、C、D)含不同植物生长调节剂组合的MS或1/2MS培养基中,试验设计见表1。根据生根效果,筛选出非洲菊单倍体植株的最佳培养基后,再以不同单倍体株系qQ6、qQ12、qW25、qY17的组培繁殖苗为材料,接种在筛选的最佳培养基中。接种前称量每瓶苗的鲜重,每个处理10瓶,将繁殖苗切成单株,株高保留1 cm左右,每瓶接种20个单株。所有培养基pH值为5.5~5.8,均添加食用白糖30 g/L、琼脂7 g/L。置于温度(22±2)℃,光照强度2000~2500 lx的培养室中,光照时间为10 h/d。

表1 试验设计
1.3 数据统计与分析
培养期间,采用目测方法,每天定时观察1次,记录每个处理根系开始萌发的时间。培养25 d后,每个处理中随机抽取未污染的4瓶(4次重复),称量鲜重,计算每株苗鲜重增加速度,调查株高、生根率、根长、根数,计算每瓶苗各测量参数的平均值。
生根率=生根株数/调查株数×100。
单株鲜重增加速度/(mg/d)=(调查时每株苗的鲜重-接种前每株苗的鲜重)/培养天数。
试验数据采用Excel 2003和DPS 19.0软件进行统计分析,利用Duncan’s新复极差法对各处理进行差异显著性检验。
2 结果与分析
2.1 非洲菊单倍体和二倍体的生根培养比较
2.1.1 不同培养基中单倍体和二倍体根系的萌发时间及生根率比较 同一非洲菊品种来源诱导培育的单倍体和二倍体组培繁殖苗,在4种培养基中培养,各处理的根系萌发时间和生根率见图1。单倍体开始生根需要的时间显著比二倍体长,单倍体根系萌发时间需要13.8~15.3 d,二倍体根系萌发时间需要9~11.8 d。非洲菊植株在4种培养基中培养,单倍体和二倍体在培养基C中培养的根系开始萌发所需时间最短,即1/2MS基本培养基中在添加IBA 0.4 mg/L和NAA 0.3 mg/L的培养基有利于根系萌发。在1/2MS和MS基本培养基中添加相同配比的植物生长调节剂,倍性相同的处理5和处理7、处理6和处理8的根系萌发时间差异不显著,说明基本培养基的浓度对根系萌发时间影响不大,但植物生长调节剂配比的种类和浓度对单倍体和二倍体根系诱导所需时间存在显著影响。
同一品种来源诱导培育的非洲菊单倍体和杂合二倍体在不同培养基中培养25 d后,单倍体的平均生根率在77.5%~98.8%,二倍体的平均生根率在86.3%~100%。除培养基C外,其他3种培养基对单倍体和二倍体生根率的影响存在显著差异,并且单倍体的生根率较二倍体的生根率低。在培养基C中培养的二倍体和单倍体生根率都较高,说明培养基C既适宜二倍体生根,也适宜单倍体生根。

图1 单倍体和二倍体在不同培养基中根系萌发时间和生根率比较
2.1.2 培养基对单倍体和二倍体根长及根数的影响 单倍体和二倍体在不同培养基中培养25 d后,各处理间的根长和根数均存在显著差异(图2)。4种培养基中培养的单倍体根长均短于二倍体根长,其中在培养基C适于植株长根,二倍体平均根长为2.3 cm,单倍体平均根长为1.7 cm。
培养25 d后,在培养基A和培养基D中诱导的单倍体根数比二倍体根数少,而在培养基B和培养基C诱导的单倍体根数比二倍体根数多。二倍体在培养基A中诱导的根数最多,平均根数可达7.7条;单倍体在培养基B中诱导的根数最多,平均根数可达9.9条。

图2 培养基对单倍体和二倍体根长及根数的影响
2.1.3 培养基对单倍体和二倍体株高及鲜重增加速度的影响 单倍体在表1中的4种培养基中培养25 d后,株高显著低于二倍体的株高,鲜重增加速度显著慢于二倍体的鲜重增加速度(图3)。二倍体在培养基D中的株高最高,为4.5 cm;单倍体在培养基C和培养基D中的株高最高,且2个处理间的差异不显著,株高均为3.5 cm。二倍体在培养基B和培养基C中的鲜重增加速度较最快,每株植株每天鲜重的增加量平均分别为18.7 mg和19.3 mg;单倍体鲜重增加速度在不同培养基中的差异不显著,每株植株每天鲜重的增加量为10.3~12.0 mg。
2.2 不同非洲菊单倍体株系的生根培养比较
将同一非洲菊品种来源诱导培育的单倍体和二倍体组培繁殖苗接种在表1所列的4种培养基中培养,除鲜重增加速度外,各处理株高、生根率、根长和根数存在显著差异,说明培养基对单倍体生根效果有显著影响。结果见图1、图2和图3。综合各测量指标结果,筛选出适宜非洲菊单倍体生根的培养基为1/2MS+IBA 0.4 mg/L+NAA 0.3 mg/L(培养基C)。
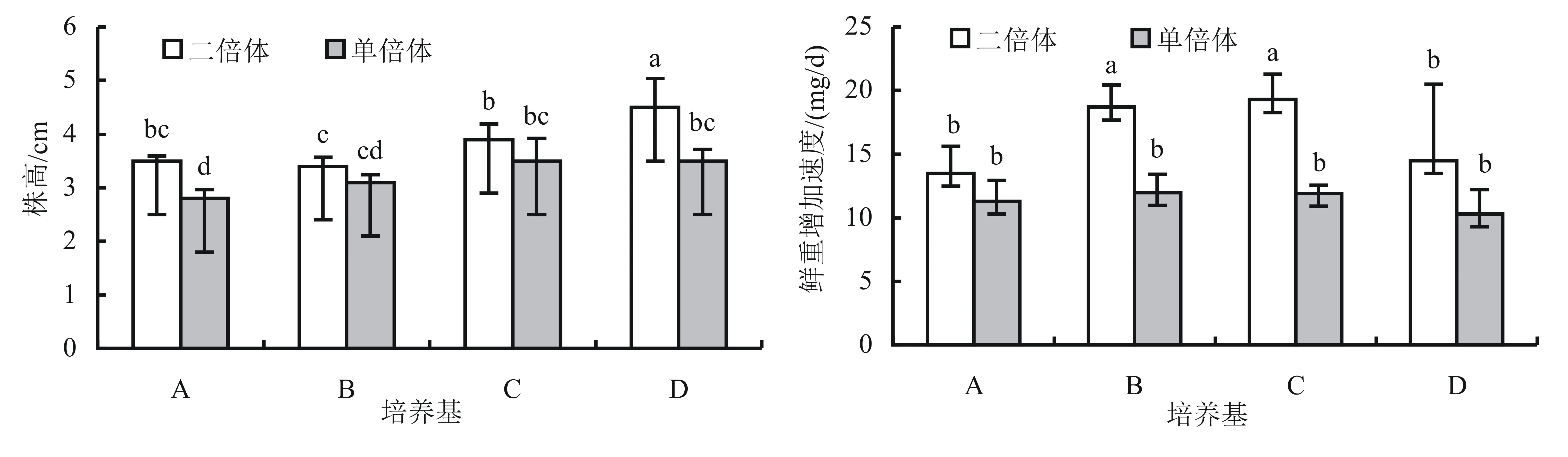
图3 培养基对单倍体和二倍体株高及鲜重增加速度的影响
5种单倍体在筛选的最佳培养基C中培养,各处理间根系萌发时间、生根率、根长、根数、株高和鲜重增加速度存在显著差异,说明基因型对单倍体生根效果有显著影响。单倍体根系开始萌发时间12~15 d,培养25 d后,根长1.1~1.7 cm、株高2.6~3.7 cm、生根率85%~98.8%、根数8.1~10.1条、鲜重增加速度11.0~12.6 mg/d(表2)。
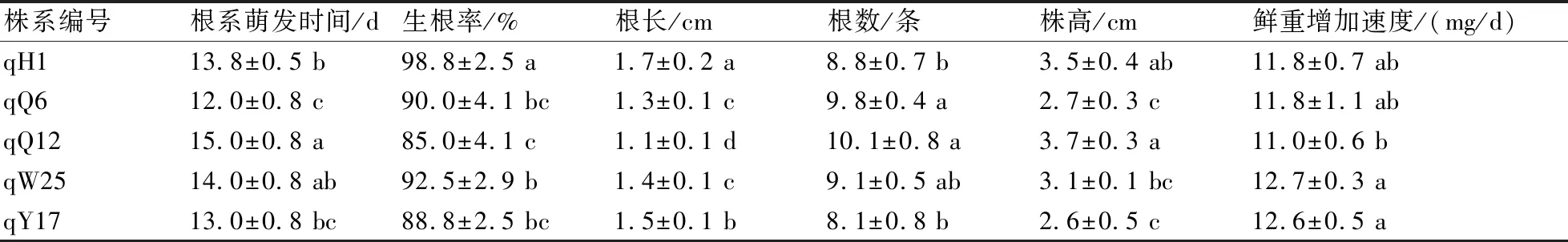
表2 不同单倍体株系的生根培养结果
注:小字母表示处理间在0.05水平上的差异显著性,字母相同则差异不显著,不同则显著。
3 讨论
单倍体育种技术是获得纯系材料行之有效的生物技术育种方法,近年来备受育种家关注。由于非洲菊单倍体长势较弱[7],加之单倍体的加倍率相对较低[13],限制了非洲菊单倍体在育种研究中的实践和应用。提高非洲菊单倍体的生根效果,能提升单倍体植株在育种研究中的应用价值。在植物组培技术研究中,生根率、根长和生根数一般是生根环节需考察的重要指标,而我们认为:根系开始萌发时间、株高和鲜重增加速度在提升种苗质量和节约生产成本方面具有举足轻重的作用,也应该列为生根环节考察的重要指标。为此,本试验将上述6项指标定为非洲菊单倍体生根培养研究的测量参数。
培养基是植物组织培养的物质基础,植物生长调节剂是培养基中的关键物质[14],植物生长调节剂对植株生长发育起着重要和明显的调节作用[15]。IBA主要是通过转化为IAA而起作用,常常用来诱导试管苗生根[16],我们采用本团队常用的非洲菊生根培养基MS+IBA 0.4 mg/L,对10个非洲菊单倍体株系进行初步生根培养试验,发现所有株系生根率不到50%,部分单倍体株系甚至不生根。前人研究认为培养基1/2MS诱导非洲菊的生根效果优于MS和1/4MS,并且1/2MS附加浓度为0.05~0.1 mg/L的NAA诱导生根所需时间最短,诱导率高达100%[10]。IBA浓度相同时,配组不同浓度NAA对试管苗的生根数、平均根长和新生叶片数影响较大;NAA浓度相同时,配组不同浓度的IBA对根的形态影响较小[11]。
本试验是根据前人的研究结果,结合我们前期的初步试验,在此基础上,通过对非洲菊单倍体在不同培养基中进一步做生根培养试验,筛选出适宜非洲菊单倍体生根的培养基为1/2MS+IBA 0.4 mg/L+NAA 0.3 mg/L。结果表明:培养基和基因型对单倍体生根效果存在显著影响。采用1/2MS培养基或添加适宜浓度的植物生长调节剂NAA,可显著提高单倍体的生根率,使单倍体的生根率达77.5%以上;在1/2MS和MS基本培养基中添加相同配比植物生长调节剂,单倍体的根系萌发时间和株高差异不显著,相同单倍体在不同培养基中培养的鲜重增加速度差异也不显著,除此以外,处理间各参数的测量结果均存在显著差异。培养25 d后,在培养基A和D中诱导的单倍体根数比二倍体根数少,而在培养基B和C中诱导的单倍体根数比二倍体根数多。

