软性输尿管镜碎石术治疗上尿路结石180例报告*
廖文成,李优苼,祝家兴,林 峰,徐开鑫,吴检发,张国玺
(1.赣州市赣县区人民医院泌尿外科;2.赣南医学院第一附属医院,江西 赣州 341000)
赣南地区是泌尿系结石的重灾区,泌尿系结石患者在泌尿外科住院患者中高居首位,泌尿系结石的治疗一直是我们关注的首要问题。近年来,随着腔内泌尿外科技术的提高及设备的不断完善,输尿管软镜在治疗上尿路结石方面的应用越来越被认可[1]。本文回顾性分析我院采用输尿管软镜碎石术治疗的180例上尿路结石患者的临床资料,探讨其安全性及有效性,现报告如下。
1 对象及方法
1.1临床资料回顾性分析我院2016年7月-2018年7月行输尿管软镜钬激光碎石术治疗的180例上尿路患者的临床资料。男101例,女79例。年龄19~78岁,平均47.2岁。所有患者术前均经病史、查体、实验室检查(血常规、肾功能、尿液常规及培养等)及影像学检查(泌尿系彩超、CT及KUB+IVU),明确诊断为肾结石或输尿管上段结石,有手术适应症。排除标准:(1)严重肾盂积水;(2)合并凝血功能障碍、严重心、肺功能障碍;(3)严重尿路感染或结核;(4)结石大小>2.5 cm。180例患者中输尿管上段结石39例,肾结石133例,肾结石合并输尿管结石8例。单发结石126例,多发54例,双侧结石12例,肾下盏46例,直径8~24 mm,平均18 mm。160例患者术前合并泌尿系感染。术前白细胞、红细胞、血肌酐分别为(7.36±2.25)×109·L-1、(4.16±0.38)×1012·L-1、(83.2±3.85) μmol·L-1。所有患者均术前留置患侧双J管至少1周。尿路感染患者术前均根据药敏结果采用敏感抗生素进行治疗,待血白细胞正常,尿白细胞阴性或(+)时,再行手术处理泌尿系结石。术前30 min给予抗生素预防感染。
1.2手术方法所有手术均为同一组医师完成,麻醉方法采用全麻或腰硬联合麻醉。患者取截石位,常规消毒铺巾,先于输尿管硬镜(F8.0/9.8WOLF输尿管镜)直视下拔出患侧双J管,置入斑马导丝至肾盂或输尿管上段结石处,然后沿着斑马导丝置入软镜外鞘(14F,美国COOK公司)。置入输尿管软镜(STORZS),采用注射器人工注水法,寻及结石,置入200 μm钬激光光纤(能量1焦耳,频率20 HZ),将结石粉碎后留置F5双J管4周。手术时间定义为软镜外鞘置入至手术结束。术后第2天复查患者血常规、肾功能、电解质、降钙素原等指标,复查KUB以明确碎石情况及双J管位置。术后4周再行KUB或CT检查明确结石清除情况。残留结石直径≥4 mm定义为结石残留。
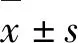
2 结 果
180例中170例一期顺利完成手术;4例因置入外鞘失败留置双J管2周后二期完成手术;6例因输尿管狭窄改行经皮肾镜取石术。170例完成输尿管软镜碎石术的患者,手术时间30~140 min,平均59.8 min;结石清除率为94.7%(161/170)。手术前后白细胞、红细胞、血肌酐比较差异均无统计学意义(P>0.05),见表1。术后发热发生率为7.6%(13/170),尿源性脓毒血症发生率为0.58%(1/165),因灌注液体外渗致腰痛发生率为1.17%(2/170),肾周血肿发生率为1.17%(2/170),无大出血、输尿管穿孔、石街等并发症,无死亡病例。术后住院时间平均2.7 d。
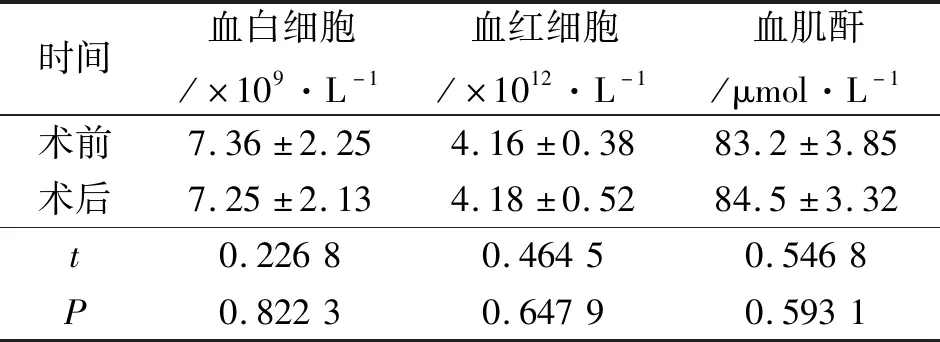
表1 患者术前、术后血分析比较
3 讨 论
随着腔内泌尿外科学技术及设备的不断发展,目前上尿路结石的治疗方法主要包括体外冲击波碎石术(ESWL)、经皮肾镜取石术(PCNL)及输尿管软镜碎石术(RIRS)。对于<2 cm的上尿路结石,ESWL、PCNL及RIRS均具有良好的疗效。ESWL虽具备费用低、创伤小及设备要求低容易开展等优势,但其碎石成功率受到患者肥胖、结石负荷、结石成分及结石位置等因素的限制。PCNL碎石效率高,对于>2 cm的肾结石也有很好的疗效,但其出血风险较大,术中术后并发症较多,对肾脏损伤较大。输尿管软镜具有出血少、术后住院时间短、无石率高、手术并发症较少等优势,虽因设备价格较高、易损耗等缺点一定程度上限制其应用推广,但对于ESWL治疗失败、肥胖、凝血功能障碍及行PCNL风险较大的患者可作为首选术式[2]。本研究通过输尿管软镜钬激光碎石术对180例上尿路结石患者进行治疗,取得较好的疗效。
输尿管软镜外鞘能否顺利置入是保障软镜手术能否进行及手术疗效的关键,软镜外鞘对于镜体可以起到良好的保护作用,同时减少镜体对患者输尿管黏膜的损伤。此外,软镜外鞘可以引流出灌洗液,保证视野清晰的同时降低肾盂内灌注压,减少术后感染的风险。目前,提升外鞘置入成功率的普遍做法为术前留置双J管1~2周[3]。本组患者均术前留置双J管1周,术中外鞘置入成功率为94.4%。王昊星等报道术前留置双J管3~5 d,手术成功率达到98%,手术时间明显缩短,减少术后感染的风险,增加手术的安全性。Miernik等[4]报道显示术前留置双J管可显著提升软镜外鞘置入的成功率,甚至达到100%。因此术前留置双J管有利于提升手术成功率,减少手术时间和降低手术并发症的发生风险。
输尿管软镜碎石过程中,为了确保手术视野的清晰,需不断进行灌注冲洗,但灌注量过大会造成肾盂内高压,从而增加手术并发症。因此,在保证视野清晰的情况下尽量降低肾盂内压对手术效果具有非常重要的意义。目前,常用的灌注方法包括灌注泵法、注射器人工注水法及吊袋法,三种方法各有优劣[5]。本组均采用注射器人工注水法,本组2例患者因灌注液外渗出现术后腰痛,可能与手术时间长,灌注量过大等有关。注射器人工注水法应以手术视野不影响手术操作的前提下尽量保持较低的肾盂内压力,保证手术顺利的情况下灌注液越少越好。
结石清除率是评价手术疗效的关键指标,结石大小对于结石清除率有较大的影响。对于直径小于2 cm的结石,软镜碎石效率要高于ESWL,与PCNL无明显差异,但软镜手术风险要低于PCNL,术后住院时间更短,恢复快。Okan等[6]研究显示,输尿管镜及PCNL各45例,输尿管软镜结石清除率为86.2%,PCNL结石清除率为80%。Jiang等[2]Meta分析综合701例PCNL和616例输尿管软镜手术,结果显示PCNL结石清除率要稍高于输尿管软镜,尤其对于>2 cm的结石。本组所有患者结石直径均<2.5 cm,一期结石清除率为94.7%(161/170)。结石位置及肾脏解剖也是影响碎石的关键因素,肾下盏结石清除率明显小于中上肾盏结石。肾盂与肾下盏夹角和肾盏漏斗长度会显著影响结石清除率,夹角越小,漏斗长度越长,结石清除率越低。本组肾下展结石患者46例,一期结石清除率为82.61%(38/46)。9例结石残留患者中5例因夹角过小或漏斗长度过长未能完全显露结石,2例结石因单侧结石多发,2例因双侧肾结石,行二期输尿管软镜碎石术后结石均清除。
输尿管软镜术后并发症主要包括术后出血、输尿管损伤、尿脓毒血症、感染性休克、全身炎症反应综合征、肾周血肿、输尿管石街等[7]。导致术后感染相关并发症的原因主要包括:①术前感染未控制;②术中持续灌注引起肾盂内高压,导致尿液反流入血;③手术时间过长等。本组术后发热13例,尿源性脓毒血症1例,主要原因可能为术前感染较重、手术时间长、术中灌注压控制不佳或合并糖尿病等所致。输尿管石街形成的主要原因为术中结石粉碎不彻底,有较大的碎石留下,主要与碎石方法和术者经验有关。利用钬激光从结石边缘采用虫噬法将结石彻底粉碎,能有效防止石街的形成。本组所有患者术后均未出现输尿管石街。输尿管软镜可造成输尿管黏膜损伤,甚至输尿管撕脱,术前预先留置双J管及术后留置双J管可有效减轻输尿管损伤的风险。肾包膜下血肿甚至肾脏破裂是一种少见的严重并发症,肾盂内高压力、手术时间、输尿管软镜鞘出水不畅、泌尿系感染及肾脏皮质较薄是其主要的危险因素。本组术后肾包膜下血肿2例,可能与患者肾脏皮质较薄,术中时间较长、灌注压过高、输尿管软镜鞘出水不畅等因素有关。术前留置双J管,控制术中灌注压,保证输尿管软镜鞘出水通畅可以降低肾包膜下血肿的风险[8]。
综上所述,输尿管软镜碎石术具有结石清除率高、出血少等显著优势。临床上需根据结石大小、位置、数量及合并症等情况个性化选择治疗方案,术前评估、术前准备及术者经验是影响手术疗效与安全性的主要因素。总之,输尿管软镜碎石术治疗上尿路结石具有良好的疗效及安全性,值得临床推广。
——可重复性或一次性输尿管软镜孰优孰劣?

