A. ferrooxidans培养过程中Al/Fe(摩尔比)对铁矿物形成产物的影响
姜艾伶,刘佳欣,熊慧欣,程 琳,齐维毅
(扬州大学 环境科学与工程学院, 江苏 扬州 225127)
综上所述,本文通过对含A.ferrooxidans菌、硫酸盐铁矿物和磷酸根离子环境中铁矿物的形成及其物相转化机理进行探讨,研究了外源添加磷酸盐(AlPO4)的A.ferrooxidansHX3培养液中铁矿物的形成,并分析了产物的物相与结构形貌。
1 材料和方法
1.1 细菌培养介质及接种物
改进型9 K液体培养基的配制: 称取(NH4)2SO43.5 g、KCl 0.116 g、K2HPO40.058 g、MgSO4·7 H2O 0.58 g和Ca(NO3)2·4 H2O 0.016 8 g,溶于1 L去离子水中,用9 M H2SO4调节pH值为3.2~3.3,于121℃下湿热灭菌15 min;上述溶液冷却后加入FeSO4·7 H2O 44.2 g(细菌所需能源),经0.22 μm醋酸纤维滤膜过滤灭菌。所有试剂纯度均为AR级,购买于上海国药集团化学试剂有限公司。
接种菌为A.ferrooxidansHX3(基因数据库登入号为HQ009292)。
1.2 铁矿物的形成实验
在500 mL锥形瓶中加入300 mL改进型9 K液体培养液,外源加入一定量的AlPO4溶液以使Al/Fe(摩尔比R)依次为0(即对照组CK)、0.04、0.4和1,然后接种5%的A.ferrooxidansHX3菌液,用1∶1 H2SO4调节初始pH值至2.8,于摇床(28 ℃和180 r/min)中培养。每处理均设置3个平行。
反应时间0~168 h内,每隔12 h拍照记录A.ferrooxidans培养液颜色和浊度变化情况,并测试其pH值(采用pHS-3C型数字pH计测定);取2 mL溶液于10 000 r/min离心去沉淀,上清液酸化后于4℃保存,待测Fe2+浓度(采用邻菲罗啉比色法测定;APHA)。每次取样前,用称重法补充因蒸发等损失的水分。同时,另将分别培养至2 d和7 d的A.ferrooxidans培养液中所有沉淀物取出,用去离子水反复洗涤以去杂质离子,40℃烘干后于干燥器皿中保存,待表征分析。
1.3 铁矿物的表征分析方法
晶型由德国BRUKER公司的D8 ADVANCE型多晶X-ray衍射仪测定(工作条件为CuKα线、40 kV、200 mA,扫描速度4°/min,扫描范围10°~80°);对照JCPDS卡片确定测试样品衍射特征峰对应d值。采用德国BRUKER公司的Tensor 27傅里叶变换红外光谱仪测定颗粒的表面结构组成及键合情况;该仪器配有一个带KBr分光镜的DTGS检波器,测试背景值400 mg KBr, 分辨率为4 cm-1。 形貌结构由Hitachi S-4800场发射扫描电子显微镜和Zeiss Supra55场发射扫描电子显微镜测定。
2 结果与讨论
2.1 细菌培养液颜色的动态变化
不同Al/Fe(摩尔比,R)下,A.ferrooxidans细菌培养液的颜色随时间的变化情况见图1。当R为0、0.04、0.4和1时,细菌培养液的颜色在初始48 h内由淡黄色转变成红棕色,同时伴随有红棕色沉淀物形成。但R为0.4和1时,处理溶液颜色分别在72 h之后逐渐呈现黄色和淡黄色,铁沉淀物为亮黄色。

图 1 不同Al/Fe条件下氧化亚铁硫杆菌培养液颜色随时间的变化Fig. 1 Color change of A. ferrooxidans cultures with time under various Al/Fe mole rates
2.2 溶液pH值和Fe2+浓度的变化
细菌培养初始阶段(48 h内),所有溶液中Fe2+浓度均由8 g/L迅速下降到0 g/L(图2a),可见溶液中的所有Fe2+在该阶段均被生物催化氧化成Fe3+,这表明AlPO4加入量对A.ferrooxidansHX3细菌氧化Fe2+的速率无明显影响。同时,溶液pH值均由2.8快速下降至2.2左右(图2b)。pH值下降主要是因为培养液中的Fe2+被生物快速催化氧化成Fe3+,Fe3+水解形成铁沉淀产物时向溶液中释放一定量的H+所致(Xiong and Guo, 2011)。细菌继续培养至60 h后,除R为1的培养液pH值已平稳在1.8左右,其余处理均由2.1持续缓慢下降至平稳值1.9或2.0。上述细菌培养液pH值变化呈现的差异,可能与细菌培养过程中铁矿物相转化程度不同有关(Xiong and Guo, 2011)。
2.3 铁沉淀产物的表征与分析
2.3.1 XRD与FTIR图谱
细菌培养介质中形成的2d-和7d-铁矿物产物(即细菌分别培养至48和168 h时取出铁沉淀物)的XRD谱线见图3左。依据文献(Liaoetal., 2009; Zhangetal., 2013; 张笛等, 2018)中依次报道的施威特曼石(PDF47-1775)、黄钾铁矾(PDF36-0427)和磷酸铁(PDF72-0471)的XRD谱线,可以发现R=0(对照)时,细菌培养至2天时形成铁沉淀产物的XRD谱线只出现施威特曼石的主要特征峰,其d值为4.86、3.39、2.55、1.95、1.66、1.51,这与本课题组前期研究结果一致(Xuetal., 2014);持续培养至7天时,介质中形成铁沉淀产物的XRD谱线出现了黄钾铁矾的主要特征峰,其d值为5.67、5.08、3.12、2.83、2.54、2.27、1.96、1.83,这表明溶液中的施威特曼石基本转变为黄钾铁矾。R=0.04时形成的2d-铁沉淀产物XRD谱线出现施威特曼石和黄钾铁矾的主要特征峰;当反应进行到7天时,铁沉淀产物基本转变为黄钾铁矾。随着R上升至0.4时,铁沉淀产物的XRD谱线不仅出现黄钾铁矾的特征峰,2d-和7d-铁沉淀产物的XRD谱线还分别出现了磷酸铁的特征峰(相应d值为4.55、4.26、2.79、2.50、2.34)和无定型磷酸铁偏移包峰。最后R=1时,细菌介质中形成的2d-铁沉淀产物的XRD谱线出现了无定型磷酸铁偏移包峰,这表明沉淀产物中除了无定型的磷酸铁,还有黄钾铁矾或/和施威特曼石;而7d-铁沉淀产物的XRD谱线上的磷酸铁包峰更强,表明随着反应的进行细菌介质中形成更多的无定型磷酸铁。2d-和7d-铁矿物产物的XRD谱线表明AlPO4的加入会加快黄钾铁矾的转变速度,且随着AlPO4加入量的增加会形成磷酸铁。
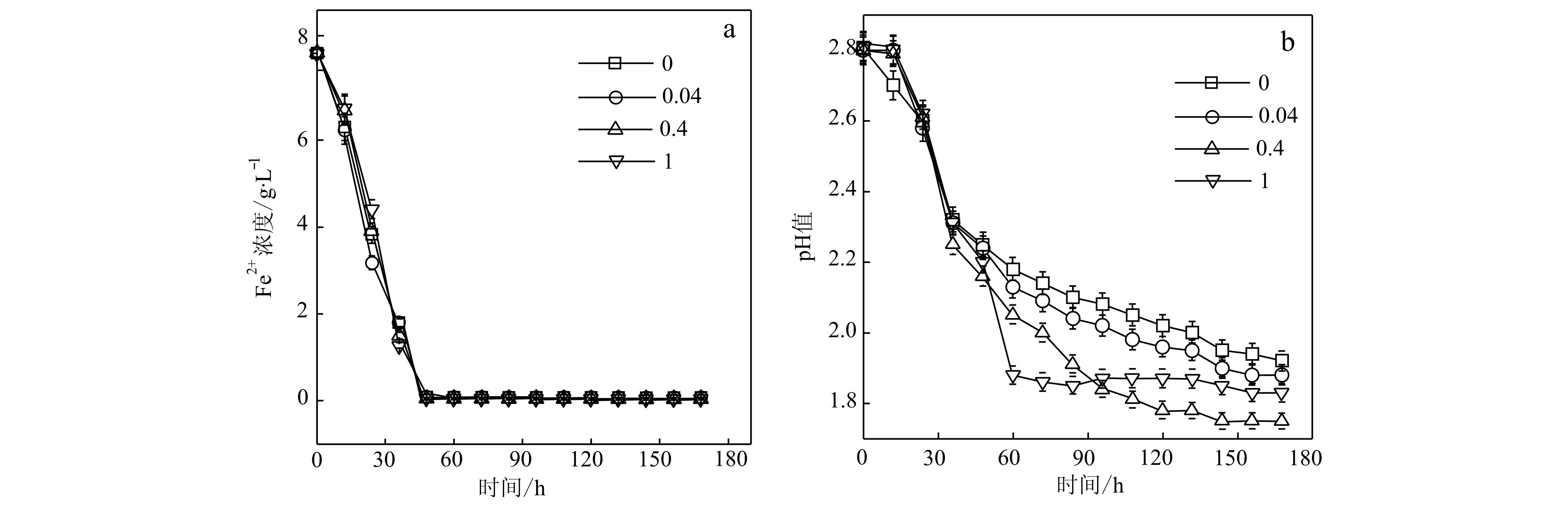
图 2 细菌培养液中Fe2+浓度(a)和pH值(b)随时间的变化Fig. 2 Changes of the Fe2+ concentration in bacterial cultures (a) and their pH values (b) with time
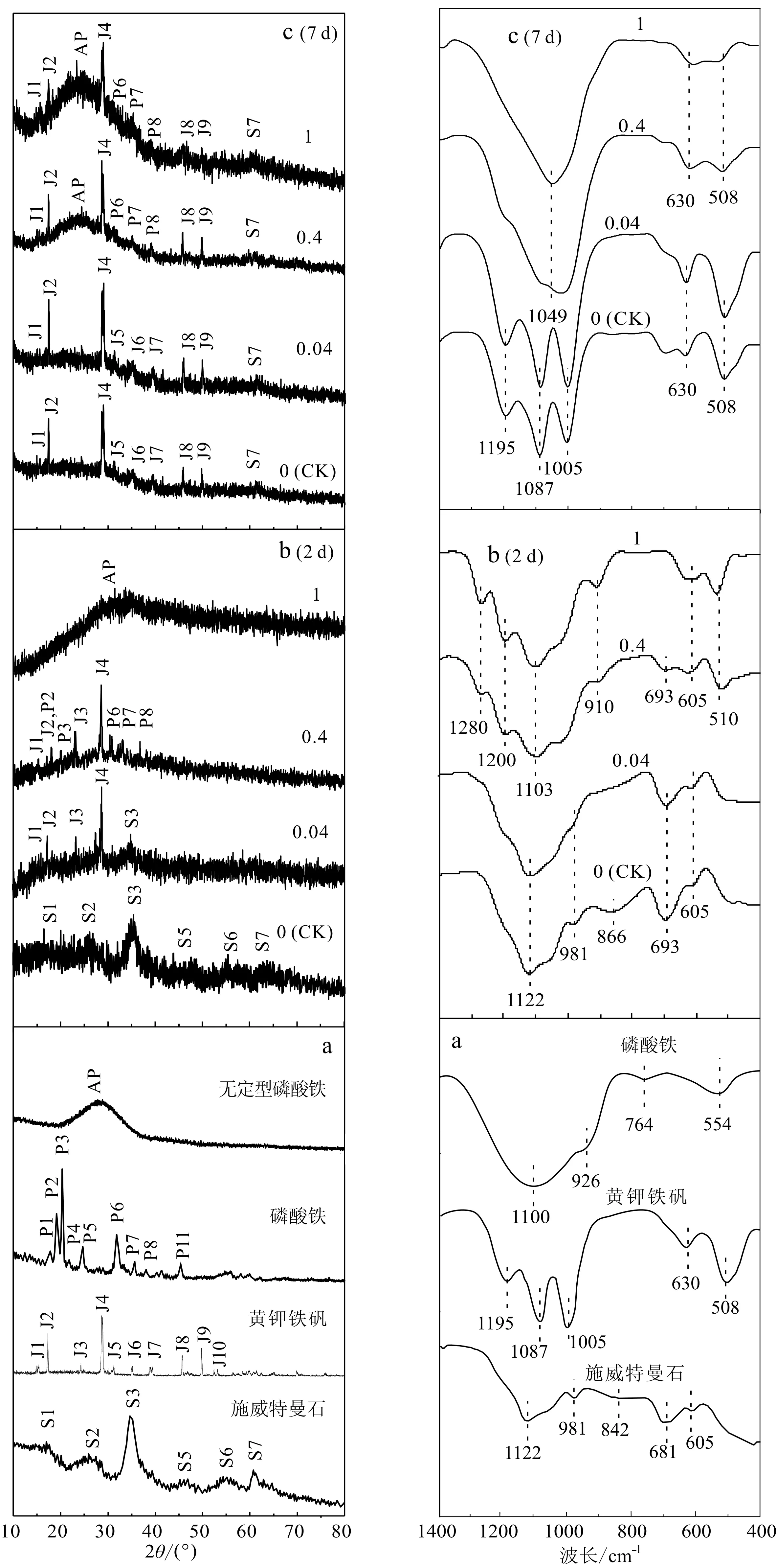
图 3 铁沉淀产物的X射线衍射图(左)和红外谱图(右)Fig. 3 XRD patterns (left) and FTIR spectra (right) of the iron precipitate productsS, J, P和AP分别代指施威特曼石、黄钾铁矾、磷酸铁和无定型磷酸铁。图a为文献Liao et al.(2009), Zhang et al.(2013), Lu et al.(2015), Xie et al.(2017),张笛等(2018)中的相应铁矿物的表征结果;图b和c分别为本文中2d-和7d-铁沉淀产物的表征结果S, J, P and AP orderly refer to schwertmannite, jarosite, iron phosphate and amorphous iron phosphate. Fig. a shows the characterization results for the corresponding iron minerals present in the references by Liao et al. (2009), Zhang et al. (2013), Lu et al. (2015), Xie et al. (2017), Zhang Di et al (2018); and Fig. b and c show the characterization results for 2d- and 7d-precipitates of iron mineral products
此外,细菌培养介质中形成的2d-和7d-铁矿物产物的FTIR谱线见图3右。与文献(Luetal., 2015; Xieetal., 2017; 张笛等, 2018)中依次报道的纯矿物相施威特曼石、黄钾铁矾或磷酸铁矿的红外光谱图比较发现,其中R为0和0.04时2d-铁沉淀的FTIR谱线与施威特曼石的基本一致,于693 cm-1处出现O—H…SO4的振动峰,于~1 122、981、605 cm-1处出现了典型SO4基团振动峰的吸收峰;反应进行到7 d时,这两个处理产生的铁矿物FTIR谱线与黄钾铁矾的基本一致,于1 195和630 cm-1处出现了SO4伸缩振动峰,于1 087和1 105 cm-1处出现了黄钾铁矾的SO4吸收峰,以及在508 cm-1处出现FeO6正八面体的振动峰。R=0.4和1时,细菌介质中获得2d-铁矿物的谱图在1 300~1 200 cm-1处出现了P—O的伸缩振动吸收带,于910 cm-1处出现P—O振动峰,表明PO4可能被施威特曼石吸附或参与了磷酸铁矿的形成(Wangetal., 2017);获得的7d-铁矿物的FTIR谱线与磷酸铁的基本一致(Luetal., 2015; Wangetal., 2017),于1 049 cm-1处出现P—O振动峰,于630 cm-1处出现Fe—O—P伸缩振动峰。
上述2d-或7d-铁矿物产物的FTIR与XRD结果一致表明,对照处理或AlPO4加入量较少(Al/Fe不高于0.04)时,培养液中初始形成的施威特曼石会逐渐转化为黄钾铁矾;而当AlPO4加入量使Al/Fe高于0.4时,形成铁沉淀产物中有磷酸铁出现。据相关文献(Gahanetal., 2009; Xiong and Guo, 2011)报道,上述铁矿物形成过程主要包括Fe2+氧化水解过程(反应式1和2)及施威特曼石、黄钾铁矾或磷酸铁矿的形成过程(分别为反应式3、4和5)。

Fe8O8(OH)8-2x(SO4)x+(24-2x)H+(3)
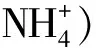
AlPO4含量较高时,发生反应:

由上述结果和相关反应方程可得出,氧化亚铁硫杆菌HX3培养溶液中的Fe2+可被快速生物催化氧化成Fe3+,且Fe3+易水解形成铁沉淀时有H+释放出来。当加入AlPO4至Al/Fe为0.04时主要出现铁沉淀的形成反应(施威特曼石)和转化形成反应(黄钾铁矾);R=0.4和1时出现磷酸铁矿形成反应。
2.3.2 FESEM形貌图
形成的2d-铁矿物的FESEM形貌结构如图4所
示(图像c2、d2分别为c1、d1存在颗粒的高倍图),对照(即R=0)中形成铁矿物施威特曼石为直径约为5~10 μm的“针垫”类球体的聚集体(图像a);R为0.04细菌溶液中铁矿物除含有聚集球颗粒形貌外,还观察到部分施威特曼石球体表面呈现有少量菱形状黄钾铁矾颗粒(图像b)。相比较,R增加至0.4时,覆盖在施威特曼石颗粒表面的菱形黄钾铁矾颗粒尺寸增大、数量增多,还额外观察到少许磷酸铁球状颗粒(图像c2);而当R为1时,磷酸铁球状颗粒数量明显增多(图像d2)。另一FESEM图(图5,其中图像a2、d2分别为a1、d1中存在颗粒的高倍图)为7d-铁沉淀产物的形貌结构,其中对照中形成铁矿物为少量施威特曼石和大量菱形状黄钾铁矾颗粒(图像a2),R为0.04处理中形成的铁沉淀为黄钾铁矾(图像b),而当R为0.4和1时铁矿物为磷酸铁球状聚集体颗粒(图像c和d2)。显然,细菌培养至7 d时,含较低量AlPO4的溶液中沉淀主要为施威特曼石和黄钾铁矾的混合物;而含较高量AlPO4的溶液中沉淀为黄钾铁矾和磷酸铁矿的混合矿相。

图 4 2d-铁矿物沉淀的FESEM形貌图Fig. 4 FESEM morphology images for the 2d-precipitates of iron minerals

图 5 7d-铁矿物沉淀的FESEM形貌图Fig. 5 FESEM morphology images for the 7d-precipitates of iron minerals
3 结论
(1) 氧化亚铁硫杆菌HX3培养初始2天内,溶液中Fe2+可快速生物催化氧化成Fe3+,Fe3+水解形成铁沉淀产物,同时向溶液中释放H+而使pH值下降。
(2) AlPO4的加入对细菌氧化Fe2+的进程基本无影响,但可促进Fe3+水解形成或转化形成不同物相的“针垫”类球状施威特曼石、菱形黄钾铁矾和球形磷铁矿3种铁矿物产物。
(3) AlPO4加入可促进黄钾铁矾的转化形成;较高的Al/Fe(摩尔比)值和磷酸根含量利于磷酸铁矿的形成。

