给水管网多相界面中微生物表面疏水性研究
张明露,徐绍峰,徐梦瑶,王 礼,柴杉杉,白 淼,张 灿*
给水管网多相界面中微生物表面疏水性研究
张明露1,徐绍峰1,徐梦瑶1,王 礼1,柴杉杉1,白 淼2,张 灿2*
(1.北京工商大学环境科学与工程系,北京 100048;2.中国人民解放军疾病预防控制中心,北京 100071)
采用疾病控制中心(CDC)生物膜反应器模拟给水管网系统,选取聚氯乙烯(PVC)和聚碳酸酯(PC)2种材质的挂片,通过微生物粘附碳氢化合物(MATH)实验和Illumina高通量测序相结合的方法,对反应器水相、生物膜相和颗粒物相中微生物的疏水性进行了研究.结果显示,PVC材质挂片反应器中优势菌为厚壁菌门,相对丰度为68.31%~81.00%,PC材质挂片反应器中优势菌为变形菌门,相对丰度为24.39%~64.40%.PVC材质挂片反应器中优势菌包含3类致病菌,PC材质挂片反应器中包含8类致病菌.PC材质挂片生物膜相较于PVC材质疏水性更高,利于微生物吸附形成生物膜,而PVC材质不易形成生物膜,对控制输送过程中的二次污染具有积极作用,但在管网实际应用中还应考虑其他工程因素的影响.
给水管网;生物膜;细胞疏水性;微生物碳氢吸附;高通量测序
饮用水微生物尤其致病菌是介水感染的主要风险来源.原水经过水厂处理后微生物含量大幅降低.但是随着输配水管道长度的增加,细菌会大幅增多,导致管网水的二次污染[1].管网中细菌附着于管壁形成生物膜,使其避免被流体冲刷,因此管网输送的水体和管网本身是一个庞杂的“反应器”[2].生物膜中的细菌具有很高的生物活性与密度,又有生物膜的保护作用,较之水中悬浮细菌更难以被灭活,这导致大量的细菌在管壁生物膜中生存与增长,对人类健康具有极大威胁[3-4].管壁生物膜的形成和管材性质[5]、滞留时间[6]、发生粘附的微生物等密切相关[7],其中微生物表面疏水性是其中一个重要指标.较弱的表面疏水性利于提高细胞的悬浮稳定性,而较强的表面疏水性则表征细胞对水环境的亲和力较低,利于吸附过程的发生.微生物表面疏水性对细菌在管道中的吸附和分布特征都有重要影响,在生物絮凝、生物挂膜、降解菌对污染物的吸附等过程中也有重要作用[8].前期研究表明,具有较强的表面疏水性和较低(更中性)电泳迁移率的微生物(如霍乱弧菌)在水处理过程中虽然可以通过静电和疏水相互作用被有效去除,但是在输配水管网中更易附着在管壁[9].表面疏水性对生物膜中细胞生长也具有一定影响[10],因此从细菌表面疏水性方面开展给水管网生物膜研究,对保障管网水的水质安全具有重要意义.环境领域微生物表面疏水性的检测通常采用微生物碳氢吸附能力法(MATH)[11],用于验证细菌与碳氢化合物的粘附性及其与表面附着之间的相关性.该方法在生物工程、石油开采、医学、食品工程等领域的研究中也有广泛应用.
目前关于管网生物膜的研究主要集中在细菌群落和腐蚀性质等方面,对管网多相界面疏水性与细菌群落的关系研究较少.本研究采用MATH实验和Illumina高通量测序相结合的方法,解析不同材质的模拟给水管网系统中多相界面的细菌群落结构及其疏水性,探究不同管材生物膜形成机制,为寻求控制管网中生物膜形成的技术方法提供理论基础.
1 材料与方法
1.1 模拟给水管网
选取美国疾病预防与控制中心(CDC)研制的生物膜反应器来模拟给水管网系统[12].反应器由体积为1L的玻璃容器组成,出水量达350mL,停留时间约为6h;8个独立的、可拆卸的聚丙烯杆支撑着聚氯乙烯材料的顶盖,顶盖上有一个进水口、一个取样口和一个气体交换口;每个杆上可以固定3个可拆卸的挂片(直径约1.27cm,厚度约0.3cm),细菌在挂片表面附着生长形成生物膜;容器底部固定一个带转子的隔板,反应器运行过程中与磁力搅拌器相连,转速控制在200~300r/min,给挂片表面提供均匀的剪切力,模拟实际管网中的水力条件.本实验选择的挂片材质分别为聚氯乙烯(PVC)和聚碳酸酯(PC),进水经蠕动泵输送到CDC反应器中,对反应器出水进行收集.反应器稳定运行60d后,对样品进行收集,对各指标进行检测.
1.2 管网多相界面样品的收集
分别收集10L进水和出水进行过滤,采用孔径0.22µm聚醚砜材质的滤膜 (GPWP04700),将过滤后的滤膜放入50mL离心管中,加入25mL磷酸盐 MgSO4缓冲液(PUM),震荡5min后置于超声仪内,40kHz下超声20min,即得到水相菌悬液;取3片挂片放入50mL离心管内,加入25mL PUM溶液,震荡1min后置于超声仪内,40kHz下超声5min,重复2次,即得到生物膜相菌悬液;收集50L反应器出水进行过滤,采用Swinnex过滤器 (Millipore SX0004700),直径47mm,孔径1.2µm的玻璃纤维素滤膜(Millipore APFC04700).将过滤完毕的滤膜放入50mL离心管内,加入25mL PUM溶液,震荡5min后,40k Hz下超声20min,得到颗粒物相菌悬液.
1.3 MATH测定
1.4 DNA提取与高通量测序
分别采集3mL烃系和10mL水系细菌细胞,使用Soil DNA提取试剂盒(MO-Bio,美国) 提取DNA,操作按照试剂盒的说明进行.DNA浓度采用Nanodrop 2000在260nm下测定(Nano-drop Technologies, Wilmington, DE).采用上游引物(5’- CAACGCGAAGAACCTTAC-3’)和下游引物(5’- CGACAGCCATGCANCACCT-3’)扩增16S rRNA基因的高变V6区[13].PCR反应采用Hot Start and Hot Star high fidelity Taq polymerases混合酶进行扩增.反应体系为50μL,反应条件为95℃预变性2min,95℃ 30s,55℃ 30s,72℃ 30s,循环30次;72℃延伸5min,PCR产物回收定量后应用Illumina测序平台测序.
1.5 表面疏水性评价指标
前期文献[14]中采用相对疏水性(RH)评估微生物总体疏水性,见式1.

除了RH,也可用烃-水分配系数(0hw)值的大小来表征总菌群的微生物疏水性高低,且0hw与RH成正比关系.其中TB代表总生物量,OD表示600nm光密度下的细胞浓度.见式2.

对于不同分类水平(从门到属)的细菌疏水性,应用特定的烃-水分配系数('hw),表征该分类水平的微生物疏水性高低,见式3.

在式3中,RN表示在正十六烷烃系和水系中不同分类水平的特定细菌群的读数.
通过比较0hw和'hw可以得到不同分类水平细菌的疏水性.如果'hw显著大于0hw,则该细菌是疏水性的.反之,该细菌被认为是亲水性的.此外,如果细菌的'hw与0hw值差异较小,则该细菌呈中等疏水性.
2 结果与讨论
2.1 CDC反应器多相界面的整体疏水性
如图1所示,CDC反应器多相界面的RH与0hw成正比,即RH越大0hw越大.PVC和PC两种材质挂片生物膜相的疏水性均高于水相和颗粒物相,说明生物膜相对疏水性更强.PC材质挂片生物膜相的0hw(1.76)远高于PVC材质(0.46),表明PC材质挂片生物膜疏水性更强.PC材质挂片水相的RH和0hw明显低于生物膜相,表明水相是相对亲水性.对于PVC材质挂片颗粒物相的RH和0hw则明显低于水相,表明颗粒物相是相对亲水性.
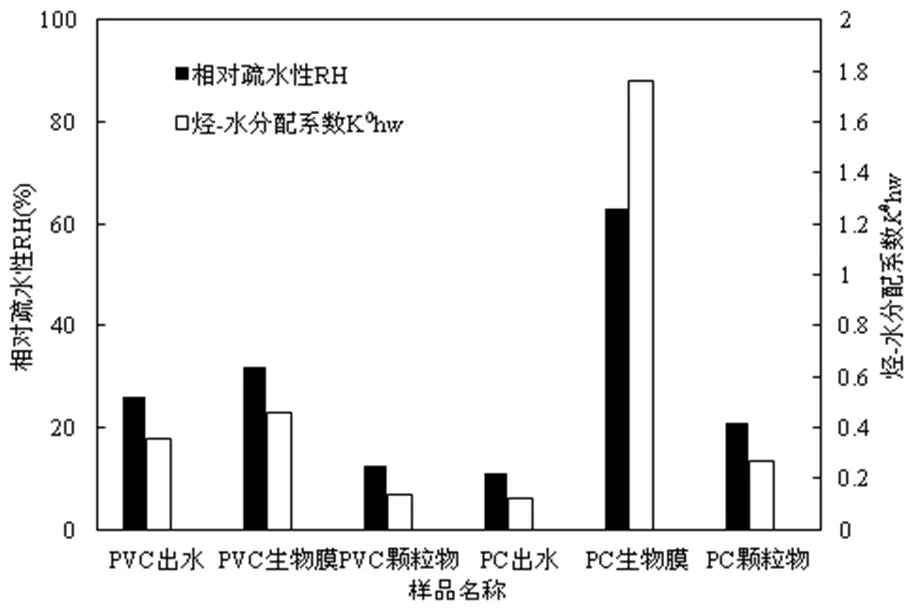
图1 PVC和PC材质挂片反应器多相界面的相对疏水性和烃-水分配系数
2.2 细菌群落结构分析
如图2(a)所示,图中汇总了8个样品中排名前10(总相对丰度>99.7%)的菌门,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)和酸杆菌门(Acidobacteria)等.除了生物膜相-烃系,其他7个样品中第一优势菌门均为厚壁菌门,其相对丰度为68.31%~81.00%,该菌在生物膜相-水系中相对丰度最高.生物膜相-烃系中第一优势菌门为变形菌门,相对丰度为55.01%,其次是厚壁菌门,相对丰度为37.09%.如图2(b)所示,8个样品中排名前10(总相对丰度>97.0%)的菌门分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi)等.厚壁菌门和放线菌门分别在进水相-烃系和生物膜相-烃系中的相对丰度最高,分别为60.84%和13.4%.
式中,Is为饱和电流,q为单位电荷,V为外加电压,n为理想因子,kB为玻尔兹曼常数,T为开尔文温度.图5(b)插图为加正向电压时,实验所得I-V特性曲线的拟合,其很好地拟合于

如图3(a)所示,图中汇总了8个样品中排名前20的菌属(平均相对丰度>0.5%),分别为乳球菌属()、、普罗威登斯菌属()、分支杆菌属()和不动杆菌属()等.除进水相-水系和生物膜相-烃系外,其他6个样品中第一优势菌属均为乳球菌属,其相对丰度为17.31%~20.72%,该菌属在颗粒物相-烃系中相对丰度最高.进水相-水系第一优势菌属为土壤杆菌属(),相对丰度为4.07%,生物膜相-烃系中第一优势菌属为变形菌门的普罗威登斯菌属,相对丰度为30.22%,其次为乳球菌属,相对丰度为8.05%.如图3(b)所示,8个样品中排名前20的菌属(平均相对丰度>1%)分别为斯科曼氏球菌属(),枝动杆菌属(),土壤杆菌属(),紫色杆菌属()和不动杆菌属()等.除进水相-烃系和生物膜相-烃系之外,其他6个样品中第一优势菌属均为枝动杆菌属,其相对丰度为5.64%~8.30%,该菌属在颗粒物相-烃系中含量最高.进水相-烃系中第一优势菌属为乳球菌属,相对丰度为15.08%,生物膜相-烃系中第一优势菌属为斯科曼氏球菌属,相对丰度为43.55%.

图3 2种材质挂片反应器多相界面的细菌属水平相对丰度
Fig 3 Relative abundance of bacteria level at the multiphase interface in PVC (a) and PC (b) reactors
2.3 细菌门水平疏水性分析
如图4(a)~(c),在PVC材质挂片反应器中,比较各相门分类水平'hw与总菌群0hw的大小,可知出水相中10个菌门的'hw均显著大于0hw(< 0.01),表明出水相细菌整体疏水性较高,其中排名第10的异常球菌-栖热菌门('hw-0hw=+6.21)疏水性最强;生物膜相中,仅排名第2的变形菌门和第10的浮霉菌门的'hw高于0hw,其他菌门如厚壁菌门、放线菌门、蓝菌门等的'hw则明显低于0hw(<0.01),表明在生物膜相中大多数菌门呈亲水性.颗粒物相中,除了第10位的异常球菌-栖热菌门('hw-0hw=-0.01)偏适中疏水性外,其他9个菌门均表现出高疏水性.
如图4(d)~(f),在PC材质挂片反应器中,出水相仅酸杆菌和蓝藻门'hw略低于0hw,而相对丰度排名前2位的变形菌门和厚壁菌门'hw略高于0hw(<0.05),这些菌门均表现中等的疏水性,其他菌门如放线菌门、绿弯菌门、疣微菌门等的'hw显著高于0hw(<0.01),疏水性较高;生物膜相中,排名第1的变形菌门呈适中疏水性,放线菌门和酸杆菌门呈较高疏水性,其他菌门则表现出较高亲水性;颗粒物相中包括变形菌门、厚壁菌门、放线菌门等在内的10个菌门的'hw均显著高于0hw(<0.01),说明生物膜相的细菌在门水平上的整体疏水性较高.

图4 2种材质挂片反应器多相界面排名前10的细菌门水平疏水性
.2.4 细菌属水平疏水性分析
如图5(a)~(c),在PVC材质挂片反应器中,出水相仅类芽孢杆菌属的'hw低于0hw,表现出亲水性,其他9个菌属均呈较高疏水性,说明出水的细菌在属水平上整体偏疏水性,其中普罗威登斯菌属('hw-0hw=+8.65)'hw最大,疏水性最强;生物膜相中,仅普罗威登斯菌属('hw-0hw=+13.42)和不动杆菌属('hw-0hw=+0.19)的'hw高于0hw,呈疏水性,其他8个菌属均偏亲水性;颗粒物相中细菌疏水性与出水相类似,仅类芽孢杆菌属呈亲水性,其他9个菌属均表现出较强疏水性,说明颗粒物相细菌在属水平上的整体疏水性较高.
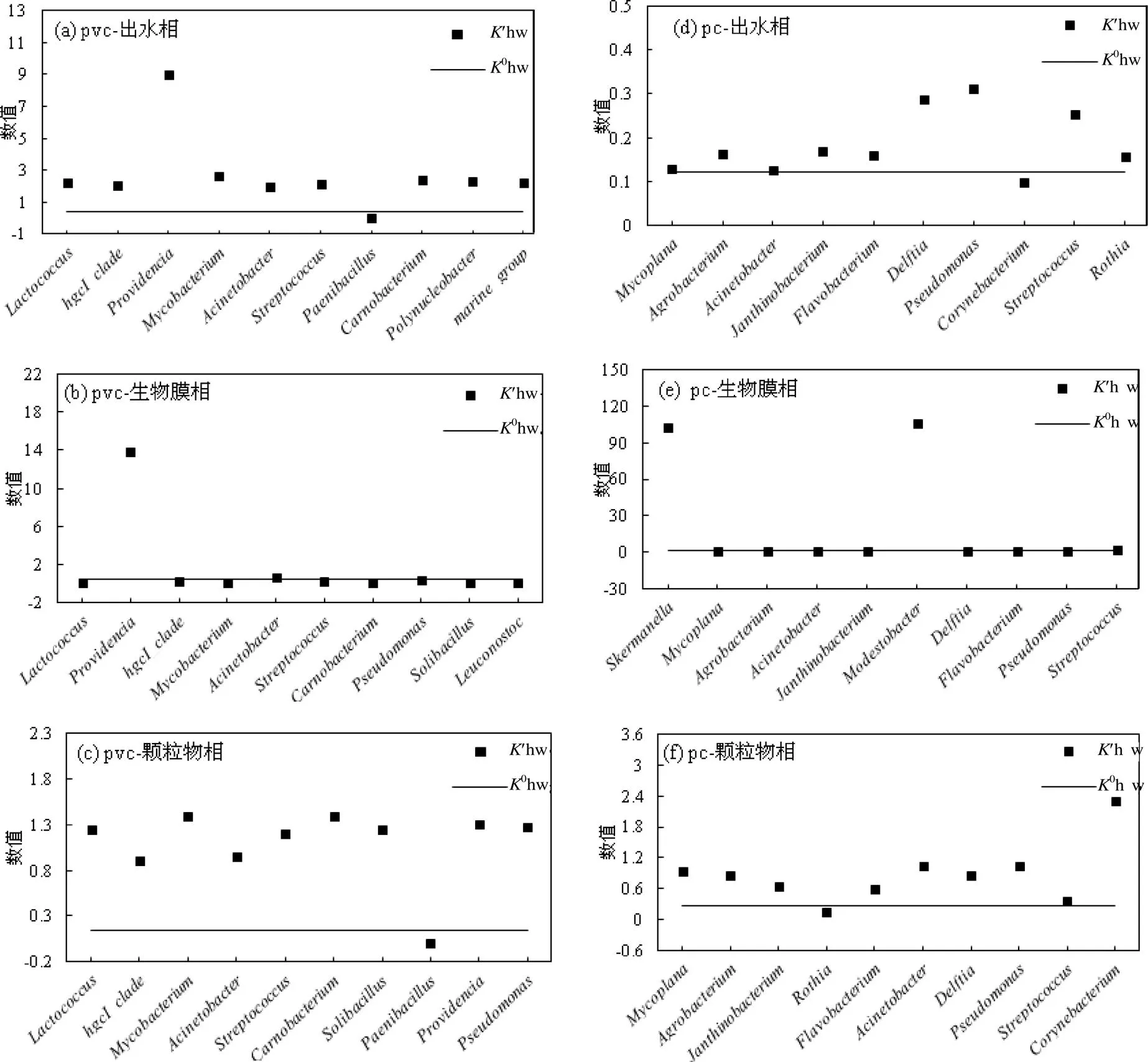
图5 2种材质挂片反应器多相界面排名前10的细菌属水平疏水性
.如图5(d)~(f),在PC材质挂片反应器中,出水相仅棒状杆菌属的'hw略低于0hw,其他包括枝动杆菌属和土壤杆菌属等在内的6个菌属'hw略高于0hw,这些菌属均呈中等疏水性,说明出水细菌在属水平上整体疏水性适中;生物膜相中仅排名第1位的斯科曼氏球菌属('hw-0hw=+101.33)和第6位的贫养杆菌属('hw-0hw=+104.06)表现出极高疏水性,其他菌属则偏亲水性;颗粒物相中仅罗氏菌属表现出亲水性,其他9个菌属均呈较高疏水性,说明颗粒物相细菌在属水平上的整体疏水性较高.
3 讨论
3.1 pH值对MATH测定的干扰和排除
本研究采用MATH测定与Illumina高通量测序相结合的方法,评估多相界面中不同细菌群体的细胞疏水性.以前的研究表明,除了表面疏水性之外,微生物对烃类液滴的粘附还依赖于pH值[15].这说明除了疏水性相互作用外,静电力也参与了粘附过程.本研究在MATH测定的实验中使用了PUM缓冲液,该缓冲液由于其高离子强度(大于150mM)而使静电效应降到最低,从而使疏水性相互作用更加明显[16].
3.2 PVC材质和PC材质对群落结构的影响
通过比较不同材质挂片反应器多相界面的细菌种群发现,PVC材质和PC材质挂片反应器中的微生物群落结构差异明显,存在部分共同的优势菌群,但相对丰度不同.门水平上,PC材质挂片反应器的水相中变形菌门是主要优势菌门,PVC材质挂片反应器中的主要优势菌门则为厚壁菌门,这2类菌门均为给水管网中的常见菌门[17-19].PVC材质挂片反应器的生物膜相-烃系中变形菌门相对丰度最高,说明变形菌门类细菌在PVC管壁更易形成生物膜.
PVC和PC 2种材质挂片反应器中的微生物在属水平上的差异较大,但都发现多种致病菌或条件致病菌,这些致病菌在其他饮用水的研究中也均有发现,如分枝杆菌[20-21]、不动杆菌[22-23]、代尔夫特菌[24-25]、铜绿假单胞菌[16,26]等.PVC材质挂片反应器中的优势菌属共包含3类致病菌,总相对丰度为4.22%~4.82%,其中分枝杆菌比例最高(1.09%~ 2.92%).PC材质挂片反应器中的优势菌属共包含8类致病菌,总相对丰度为24.07%~29.62%,土壤杆菌比例最高(1.46%~6.46%).2种材质挂片的反应器中均发现了不动杆菌和链球菌,不动杆菌可引起泌尿道感染、肺炎、继发性脑膜炎以及伤口感染,多发于免疫力低下人群,如新生儿和老年人[27];链球菌则可引起各种化脓性炎症、猩红、新生儿败血症等,在儿童中发病率较高[28],这些致病菌的检出表明饮用水微生物的安全性应引起足够重视.通过对比2种材质挂片反应器中致病菌种类和相对丰度可知,与PVC材质相比,PC材质中的致病菌的种类更多、相对丰度更高.2种材质的生物膜相-烃系的致病菌比例均较低,PVC材质中疏水性最强的致病菌为普罗威登斯属,PC材质中疏水性最强的致病菌为斯科曼氏球菌属,说明这2种细菌易附着于管壁上形成生物膜从而影响饮水健康,因此在处理给水管网二次污染问题时,应着重对这类细菌进行去除.
3.3 PVC和PC材质对表面疏水性的影响
通过比较水相、生物膜相和颗粒物相中细菌的表面疏水性发现,在门分类水平上,PVC和PC2种材质挂片反应器的出水相和颗粒物相微生物的整体疏水性均较高,其中PC材质挂片反应器的出水相细菌的疏水性稍弱于PVC材质.PVC材质挂片反应器的生物膜相相对丰度最高的厚壁菌门呈亲水性,其他菌门相对丰度较低,故PVC生物膜相整体偏亲水性.PC材质挂片反应器的生物膜相比例较高的2个菌门均表现出中等疏水性,因此PC材质挂片反应器生物膜相整体疏水性适中.在属分类水平上,PVC材质挂片反应器出水相和颗粒物相疏水性均较强,生物膜相中除了普罗威登斯菌属呈较高疏水性,其他菌属多表现为亲水性,故生物膜相整体呈亲水性.PC材质挂片反应器的出水相整体疏水性适中,生物膜相中由于占绝对优势的斯科曼氏球菌属疏水性较强,故生物膜相整体呈疏水性,颗粒物相则整体疏水性较高.其中,PVC材质反应器出水相的3种致病菌和PC材质反应器出水相的8种致病菌在生物膜相中均呈亲水性,而在出水相和颗粒物相中则表现出较强或中等疏水性,说明致病菌在生物膜相-烃系中数量较少,出现这一现象的原因可能与管壁生物膜的脱落有关.由于生物膜脱落导致微生物一部分进入水体中,一部分附着在颗粒物上,进而使出水相-烃系和颗粒物-烃系中致病菌数量增多,疏水性增强.此外,与PC材质挂片反应器生物膜相的疏水性相比,PVC材质挂片生物膜相相对亲水,这在一定程度上也说明PVC材质对微生物的吸附作用稍弱于PC材质.
4 结论
4.1 通过对实验室模拟管网条件下PVC材质和PC材质挂片反应器的进出水水相、生物膜相和颗粒物相分析发现,2种材质挂片的反应器各相样品中细菌群落均具有较高多样性,但群落结构明显不同,PVC材质挂片的反应器中优势菌为厚壁菌门, PC材质挂片的反应器中优势菌则为变形菌门;两种材质挂片上的微生物在属水平上的差异较大, PVC材质的优势菌是乳球菌属,PC材质的优势菌是斯科曼氏球菌属.
4.2 PVC材质和PC材质挂片反应器3相样品中的优势菌均存在部分致病菌或条件致病菌,其中PVC材质挂片反应器中优势菌包含3类致病菌,PC材质挂片反应器包含8类致病菌;PVC和PC2种材质挂片反应器中含量最高的致病菌分别是分枝杆菌和土壤杆菌,增加了饮用水的健康风险,应引起关注.
4.3 PC材质挂片生物膜相较于PVC材质疏水性更高,对微生物的吸附作用更强,易积累生物膜,但PC材质抗冲击性能好、安装方便、价格低廉.而PVC材质不易形成生物膜,对控制管网水质的二次污染具有积极意义.
[1] Power K N, Nagy L A. Relationship between bacterial regrowth and some physical and chemical parameters within Sydney's drinking water distribution system [J]. Water Research, 1999,33(3):741-750.
[2] 林文芳,余志晟,陈 曦,等.给水管网生物膜反应器及分子生物学研究方法进展 [J]. 环境科学与技术, 2012,35(6):71-78. Lin W F, Yu Z C, Chen X, et al. Advances in research methods of biofilm reactors and molecular biology in water supply networks [J] Environmental Science & Technology, 2012,35(6):71-78.
[3] 周玲玲,刘文君,张永吉.给水管壁生物膜附着异养菌与水中悬浮菌活性比较 [J]. 中国给水排水, 2007,23(21):37-40. Zhou L L, Liu W J, Zhang Y J. Comparison of activity of heterotrophic bacteria attached to biofilm of water supply wall and suspended bacteria in water [J]. China Water & Wastewater, 2007,23(21):37-40.
[4] 陈雨乔,段晓笛,陆品品,等.给水管网中耐氯性细菌的灭活特性研究 [J]. 环境科学, 2012,33(1):104-109. Chen Y Q, Duan X D, Lu P P, et al. Study on inactivation characteristics of chlorine-tolerant bacteria in water supply network [J]. Environmental Science, 2012,33(1):104-109.
[5] 张向谊,刘文君,高圣华,等.模拟配水管网中管材和余氯对生物膜形成的影响 [J]. 中国环境科学, 2006,(3):303-306. Zhang X Y, Liu W J, Gao S H, et al. The influence of pipe materials and residual chlorine in the stimulant water distribution pipe net on the biofilm formation. [J]. China Environmental Science, 2006,(3):303- 306.
[6] 叶 萍,申屠华斌,陈环宇,等.滞流工况下管网水中微生物群落对铁释放的影响 [J]. 中国环境科学, 2017,37(12):4578-4584. Ye P, Shen T H B, Chen H Y, et al. Influence of microbial community on iron release under stagnation condition in drinking water systems [J]. China Environmental Science, 2017,37(12):4578-4584.
[7] 孙慧芳,石宝友,王东升.供水管网内壁生物膜的特征及其对水质的影响 [J]. 中国给水排水, 2011,27(21):40-45. Sun H F, Shi B Y, Wuang D S. Characteristics of biofilm on the inner wall of water supply network and its influence on water quality [J]. China Water & Wastewater, 2011,27(21):40-45.
[8] 黄翔峰.MATH法表征环境微生物细胞表面疏水性的研究进展 [J]. 微生物学通报, 2015,42(1):200-206. Huang X F. Advances in MATH Method for characterizing the surface hydrophobicity of environmental microorganisms [J]. Microbiology China, 2015,42(1):200-206.
[9] Popovici J, White C P, Hoelle J, et al. Characterization of the cell surface properties of drinking water pathogens by microbial adhesion to hydrocarbon and electrophoretic mobility measurements [J]. Colloids & Surfaces B: Biointerfaces, 2014,118:126-132.
[10] Noriyuki I, Michio S, Hirosi Anzai, et al. Relationships among colony morphotypes, cell-surface properties and bacterial adhesion to substrata in[J]. Colloids & Surfaces B Biointerfaces, 2003,30(1):51-60.
[11] Djeridi I, Cécile Militon, Grossi V, et al. Evidence for surfactant production by the, sp. MSNC14 in hydrocarbon-containing media [J]. Extremophiles, 2013,17(4):669- 675.
[12] Zhang M L, Wang L, Xu M Y, et al.Selective antibiotic resistance genes in multiphase samples during biofilm growth in a simulated drinking water distribution system: Occurrence, correlation and low- pressure ultraviolet removal [J].Science of The Total Environment, 2019,649:146-155.
[13] Caporaso J G, Lauber C L, Walters W A, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample [J]. Proceedings of the National Academy of Sciences, 2011,108Suppl 1(Supplement_1):4516-4522.
[14] Yuan Q C, Feng G, Herbert H P, et al. Hydrophobicity of diverse bacterial populations in activated sludge and biofilm revealed by microbial adhesion to hydrocarbons assay and high-throughput sequencing [J]. Colloids & Surfaces B: Biointerfaces, 2014,(114): 379-385.
[15] Busscher H J, Mei H C V D. Implications of microbial adhesion to hydrocarbons for evaluating [J]. Colloids & Surfaces B Biointerfaces, 1995,5(3/4):111-116.
[16] Rosenberg M. Microbial adhesion to hydrocarbons: Twenty-five years of doing MATH [J]. FEMS Microbiology Letters, 2006,262(2):129- 134.
[17] Vaz-Moreira I, Nunes O C, Manaia, et al. Ubiquitous and persistent, Proteobacteria, and other Gram-negative bacteria in drinking water [J]. Science of the Total Environment, 2017,586:1141-1149.
[18] Wu H, Zhang J, Mi Z, et al. Biofilm bacterial communities in urban drinking water distribution systems transporting waters with different purification strategies [J]. Applied Microbiology & Biotechnology, 2015,99(4):1947-1955.
[19] Sun H, Shi B, Bai Y, et al. Bacterial community of biofilms developed under different water supply conditions in a distribution system [J]. Science of The Total Environment, 2014,472:99-107.
[20] Marciano-Cabral F, Jamerson M, Kaneshiro E S. Free-living amoebae,andin tap water supplied by a municipal drinking water utility in the USA [J]. Journal of Water & Health, 2010,8(1):71-82.
[21] Gomez-Smith C K, Lapara T M, Hozalski R M. Sulfate reducing bacteria and Mycobacteria dominate the biofilm communities in a chloraminated drinking water distribution system [J]. Environmental Science & Technology, 2015,49(14):8432-8440.
[22] Narciso-Da-Rocha C, Vaz-Moreira I, Svensson-Stadler L, et al. Diversity and antibiotic resistance ofspp. in water from the source to the tap [J]. Applied Microbiology & Biotechnology, 2013, 97(1):329-340.
[23] Kelly J J, Minalt N, Culotti A, et al. Temporal variations in the abundance and composition of biofilm communities colonizing drinking water distribution pipes [J]. PLoS One, 2014,9(5):1-11.
[24] 张明露,刘文君,李翠萍,等.水源切换对水厂出水细菌群落的影响 [J]. 中国环境科学, 2015,35(8):2517-2522. Zhang M L, Liu W J, Li C P, et al. Effect of water source switching on bacterial community in effluent of waterworks [J]. China Environmental Science, 2015,35(8):2517-2522.
[25] Liao X, Chen C, Wang Z, et al. Bacterial community change through drinking water treatment processes [J]. International Journal of Environmental Science & Technology, 2015,12(6):1867-1874.
[26] Flores Ribeiro A, Bodilis J, Alonso L, et al. Occurrence of multi- antibiotic resistantspp. in drinking water produced from karstic hydrosystems [J]. Science of The Total Environment, 2014, 490:370-378.
[27] 胡子鉴.不动杆菌属感染的研究进展 [J]. 医学综述, 1999,(1):5-7. Hu Z J. Advances in research on Acinetobacter infection [J]. Medical Recapitulate, 1999,(1):5-7.
[28] O'Brien K L, Wolfson L J, Watt J P, et al. Burden of disease caused byin children younger than 5 years: Global estimates [J]. The Lancet, 2009,374(9693):893-902.
Study on microbial surface hydrophobicity under multiphase interface of water distribution network.
ZHANG Ming-lu1, XU Shao-feng1, XU Meng-yao1, WANG Li1, CHAI Shan-shan1, BAI Miao2, ZHANG Can2*
(1.Department of Environmental Science and Engineering, Beijing Technology and Business University, Beijing 100048, China;2.Center for Disease Control and Prevention of Chinese PLA, Beijing 100071, China)., 2019,39(11):4823~4830
The CDC (Centers for Disease Control) biofilm reactor was used to simulate the water distribution system, and two kinds of hanging materials of polyvinyl chloride (PVC) and polycarbonate (PC) were selected. The cell hydrophobicity of different bacterial populations in the water phase, biofilm phase and particulate phase of the two hanging materials was studied by a combination of microbial adhesion hydrocarbon (MATH) experiment and Illumina high-throughput sequencing. The results showed that the dominant bacteria in the reactor of PVC hanging coupon was Firmicutes and the relative abundance was 68.31% ~ 81.00%. While the dominant bacteria in the reactor of PC hanging coupon was Proteobacteria and the relative abundance was 24.39% ~ 64.40%. The predominantbacteria in the reactor of PVC hanging coupon contained three types of pathogenic bacteria, and the PC hanging coupon contained eight pathogens. The hydrophobicity of biofilm phase on the PC hanging coupon was higher than that on PVC, which facilitated the attachment of bacteria and biofilm formation. The ability of PVC material to form biofilm was lower. Hence,it had positive impact on the secondary pollution control during the water transportation. However, other engineering factors should also be considered in the practical applications.
water distribution system;biofilm;cell hydrophobicity;microbial adhesion hydrocarbon (MATH);high-throughput sequencing
X172
A
1000-6923(2019)11-4823-08
张明露(1982-),女,黑龙江哈尔滨人,副教授,博士,主要从事环境微生物研究.发表论文30余篇.
2019-04-29
国家重点研发计划(2016YFD0401202);国家自然科学基金资助项目(51408010,51578008);北京自然科学基金资助项目(8192053)
* 责任作者, 副研究员,zhangcancqu@163.com

