帕金森病病人体位性低血压的发生率及其相关因素分析
帕金森病(Parkinson′s disease, PD)是中老年人常见的神经变性疾病,除了运动迟缓、静止性震颤、肌强直和姿势步态异常等运动症状,还包括很多的非运动症状[1]。PD常见的非运动症状有体位性低血压、嗅觉减退、便秘、认知功能障碍及睡眠障碍等。临床上约有30%以上的PD病人存在体位性低血压[2-3]。体位性低血压的主要表现为头晕、视物模糊、主观虚弱以及其他一些非特异性症状,比如容易疲劳、认知功能障碍和呼吸困难等,严重的病人甚至会出现晕厥和跌倒,但并不是所有存在体位性低血压的PD病人都会出现临床症状[4]。因此,在PD病人中探讨体位性低血压的发生及其相关影响因素具有十分重要的意义。本研究主要探讨PD病人中体位性低血压的发生情况并分析其相关因素。
1 资料与方法
1.1 研究对象 选取2018年6~12月在我院神经内科住院治疗的原发性PD病人130例作为研究对象,所有病人对左旋多巴具有良好的应答。入组标准:(1) 临床诊断依据2016年中国帕金森病诊断标准[5]。(2) 年龄≥30岁;(3) 确诊PD后病程至少1年;(4)病人有能力回答或配合进行研究所涉及到的一系列量表或问卷评估;(5)签署知情同意书。排除标准: (1) 不典型或继发性帕金森综合征的病人;(2)病人合并严重的内外科疾病,包括心血管疾病、呼吸系统疾病、泌尿系统疾病、代谢性疾病、恶性肿瘤等;(3)已接受外科手术治疗的PD病人(包括苍白球毁损术、丘脑毁损术、脑深部电刺激或器官移植)。入组病人中共有男82例,女48例,年龄40~85岁,平均(64.58±8.91)岁,病程1~20年,平均(6.19±4.14)年。研究在取得病人及其家属同意后,签署知情同意书。该研究获得苏州大学附属第二医院医学伦理学委员会批准。
1.2 研究方法
1.2.1 一般资料收集:收集PD病人的性别、年龄、发病年龄、病程、用药情况和HY分期。
1.2.2 问卷评分:所有PD病人需经过详细的病史采集和神经系统专科的查体,符合研究的入组条件,安排签署知情同意书,并进行统一帕金森病评定量表(UPDRS)、汉密尔顿抑郁量表(HAMD)、汉密尔顿焦虑量表(HAMA)、疲劳严重程度量表(FSS)、蒙特利尔认知评估(MoCA)量表、简易精神状态检查(MMSE)量表、帕金森病问卷-39 (PDQ-39)和帕金森病非运动症状量表(NMSQ)等评估。同时记录每例病人的年龄、性别、起病年龄、病程以及左旋多巴日等效剂量(levodopa equivalent dose,LED)。
1.2.3 血压测量:PD病人需停用PD药物12 h,于次日上午进行血压测量,首先仰卧位进行血压测量,然后站立3 min后再次测量血压,若该病人站立位收缩压下降20 mmHg和(或)舒张压下降10 mmHg,则该病人存在体位性低血压[6]。
1.3 统计学分析 所有数据均使用SPSS 18.0软件进行统计分析。计量资料采用均数±标准差表示,计数资料采用构成比(百分比)表示,计量资料的组间比较采用两独立样本t检验;计数资料采用卡方检验,相关分析采用Pearson相关分析。P<0.05 为差异有统计学意义。
2 结果
2.1 PD病人体位性低血压发生率 本研究中,共入组PD病人130例,其中男82例,女48例,体位性低血压的发生率为42.3%。
2.2 合并低血压组(PD-OH组)与不合并体位性低血压(PD-NOH组)的临床资料比较 PD-OH组病人的年龄显著高于PH-NOH组(P<0.05),起病年龄显著高于PD-NOH组的(P<0.05)。PD-OH组病人的LED明显高于PD-NOH组(P<0.05)。见表1。
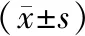
表1 合并与不合并体位性低血压组临床资料比较
2.3 PD病人血压差值的相关因素分析 PD病人的收缩压变化和年龄及起病年龄呈正相关(r=0.279,P=0.001;r=0.281,P=0.001),和性别、病程、HY分期、LED、UPDRS1、UPDRS2、UPDRS3、NMSQ、HAMA、HAMD、FSS、MOCA、MMSE和PDQ39均无明显相关性。见表2。
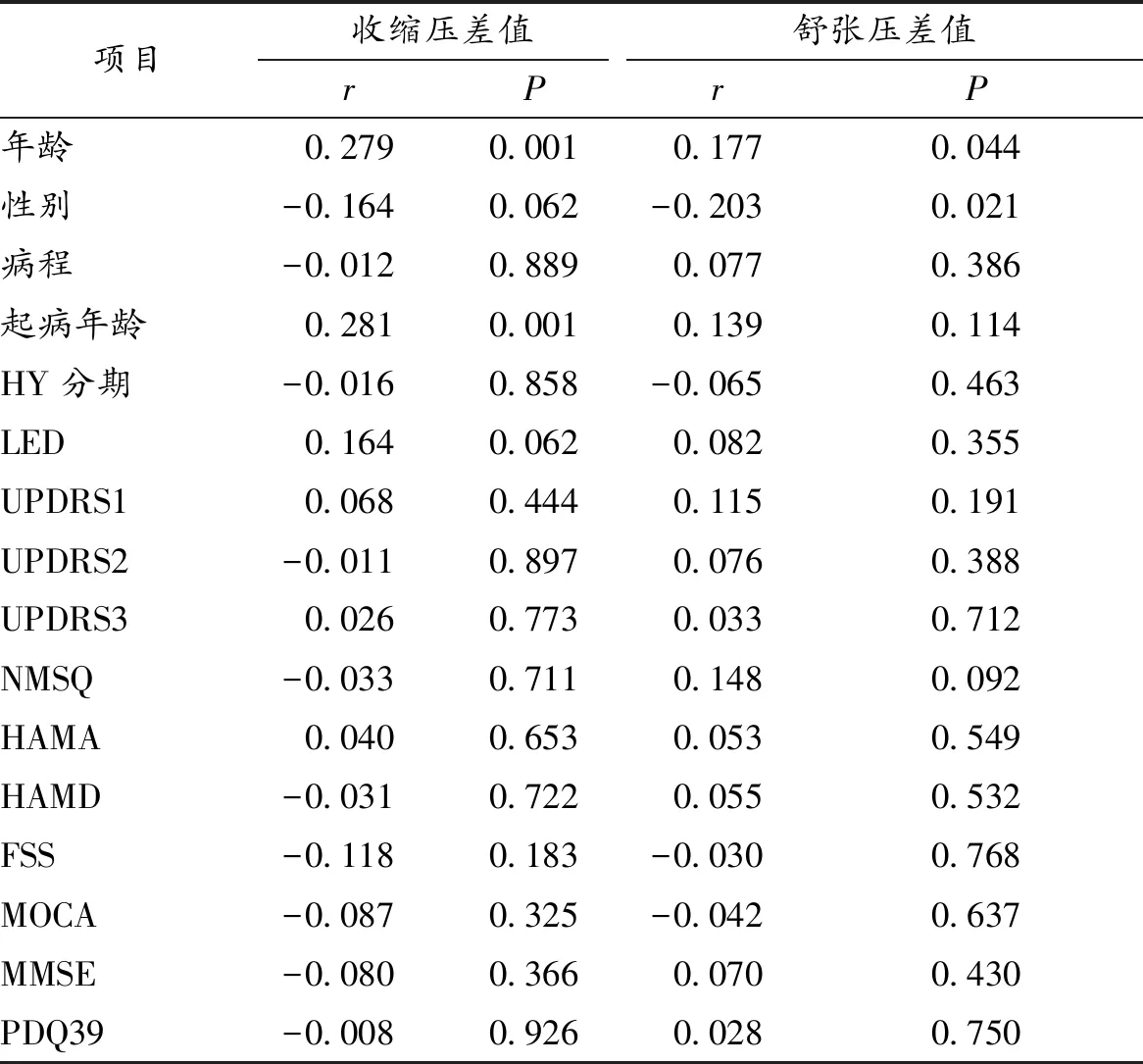
表2 PD病人血压差值的相关因素分析
3 讨论
PD病人中体位性低血压的发生率至少约30%。研究表明,PD病人出现体位性低血压,发病机制可能为调节血压的交感神经被突触核蛋白病变破坏[3]。PD病人在疾病早期有可能出现无症状的体位性低血压,随着疾病逐渐进展到中晚期,发生体位性低血压的比例会明显增高,并出现相应的临床症状[6]。我们研究发现,PD病人的起病年龄越晚,其出现体位性低血压的可能性也更高。而合并体位性低血压的PD病人是否有临床症状,往往取决于卧立位时血压下降的程度和速度。如果是严重的直立性低血压,病人的血压明显下降,会导致脑部组织的严重缺血,出现晕厥,可瞬间出现神志不清、跌倒等,而在病人跌倒后血压又会迅速恢复。
体位性低血压是病人在直立位时血压出现明显的降低,而血压降低会导致脑部供血不足,从而引起脑组织的缺血性损伤。PD病人因存在黑质纹状体的多巴胺能神经元退化,出现体位性低血压时会加重细胞损伤,出现严重的脑损害[3,7]。有些病人因为病程较长,症状严重,需要服用较大剂量的左旋多巴,左旋多巴具有一定的降压作用,再加上PD本身的病变导致的低血压,多种因素混杂在一起,可发生严重的低血压[8]。这些与我们的研究结果中发现的合并体位性低血压的PD病人左旋多巴等效剂量更高的结论也是相符合的。
神经源性体位性低血压治疗的目的并非令立位血压达标,而是缓解体位性低血压症状、改善生活质量、减少并发症及降低死亡率[9]。目前在临床工作中,处理体位性低血压的方法主要包括纠正可能引起或者加重体位性低血压的潜在因素,如避免使用多巴胺或多巴胺受体激动剂,以及利尿药、血管扩张剂等,这些药物可能会加重体位性低血压的症状。非药物治疗的方法包括饮食上的调整,避免咖啡因、酒精和糖类饮料的摄入,保证每日总液体和盐类的摄入。若症状严重影响PD病人生活时,还可以考虑药物治疗,包括米多君、屈昔多巴和氟氢可的松等药物[9-10]。
因此,重视PD合并体位性低血压的发生及对PD病人血压的规范化管理也是非常重要,尤其是对早期发现可能存在体位性低血压而又没有临床症状的PD病人,具有重要意义。如尽量调整左旋多巴药物的使用剂量,提高PD病人的生存质量。

