腹膜透析病人生存分析的单中心回顾性研究
腹膜透析(peritoneal dialysis,PD)是终末期肾脏病(end stage renal disease,ESRD)病人肾脏替代治疗的重要方式之一。相比血液透析(hemodialysis,HD),PD具有病人自主可操作性强、舒适度高,对血流动力学影响小,对饮食限制较少,对工作、学习影响小,以及其独特的残存肾脏功能保护作用等优势[1],得到广泛的推广使用。随着PD技术的不断发展和逐渐成熟,PD病人生存时间显著延长,观察研究PD病人的远期并发症、生活质量及生存预后具有非常重要的意义。本研究旨在通过对PD病人的单中心回顾性分析,探究影响PD病人长期预后的危险因素。
1 对象和方法
1.1 研究对象 收集2012年1月1日至2017年12月31日期间,于江苏省沭阳县人民医院腹膜透析中心首次接受维持性PD治疗病人的临床资料,临床随访截止日期至2018年12月31日。纳入标准为符合K/DOQI关于慢性肾脏病(CKD)诊断标准的病人。排除标准:(1)排除因急性肾脏病、急性肾损伤行PD治疗的病人;(2)PD前已经合并严重心脑血管疾病或恶性肿瘤病人;(3)高龄老年PD病人(年龄>80岁)。共计106例PD病人纳入本研究。
1.2 研究方法
1.2.1 病例资料收集:采用回顾性队列研究设计,数据来源于我院电子病历系统(东软医院信息系统V5.0)和我院腹膜透析中心在全国血液净化病例信息登记系统(Chinese National Renal Data System, CNRDS, http://www. cnrds.net)中登记的PD病人数据。
1.2.2 PD方案:使用广州百特医疗用品有限公司生产的腹膜透析液[乳酸盐-G1.5%和(或)乳酸盐-G2.5%],透析模式分为2种:持续不卧床腹膜透析(continuous ambulatory peritoneal dialysis,CAPD)和日间不卧床腹膜透析(daily ambulatory peritoneal dialysis,DAPD),常规每日交换腹膜透析液3~4次,腹膜透析液用量2 L/次。并定期依据病人透析充分性指标和临床症状及时调整透析方案。
1.3 观察指标
1.3.1 一般资料收集:收集PD病人的基础数据资料,包括人口统计学资料、原发病情况、规律PD起止时间、死亡或退出PD具体原因、是否合并糖尿病、是否合并心血管疾病、随防期间发生腹膜炎频次和住院频次等。
1.3.2 生化指标收集:包括开始透析时的估算肾小球滤过率(estimated glomerular filtration rate,eGFR)及末次随访(距离每例病人生存时间终点最近的一次化验结果)指标:血红蛋白(Hb)、白蛋白(Alb)、总胆固醇(TC)、甘油三酯(TG)、C反应蛋白(CRP)、血钙(Ca)、血磷(P)、全段甲状旁腺激素(iPTH)、透析充分性评估(KT/V)等。eGFR运用适合中国人群的MDRD公式[2]:eGFR[mL/(min·1.73m2)]=186×Cr-1.154×age-0.203×0.742(女性)×1.233(中国人)[其中:Scr代表血肌酐值(单位:mg/dL);age代表年龄(单位:岁)]。校正血钙(Ca)计算公式[3]:校正血钙(mmol/L)=血总钙(mmol/L)+0.02×[40-Alb(g/L)](如Alb<40 g/L)。
1.3.3 腹膜透析相关性腹膜炎(PDAP)诊断标准[4]:依据国际腹膜透析学会(ISPD)腹透相关性感染指南:(1)腹痛、腹膜透析液浑浊,伴或不伴发热;(2)透出液中有核细胞计数>100个/μL,中性粒细胞比例>50%;(3)腹膜透析液病原微生物培养阳性。符合以上3项中2项或以上指标者诊断为腹膜炎。
1.3.4 生存率:终点事件为死亡,其他生存结局为删失(删失原因:转血液透析或肾移植、失访及随访结束仍然存活)。
1.3.5 技术存活率:终点事件为PD治疗方式的终止[5]。导致技术失败的主要因素包括感染、死亡、透析不充分、机械故障和社会原因等。

2 结果
2.1 一般临床资料 共计106例PD病人纳入本次研究,其中男55例(51.89%),女51例(48.11%),初始透析时年龄(50.39±14.09)岁;生存时间29.72(17.95,50.07)月;原发病情况:慢性肾炎53例(50.00%);糖尿病肾病23例(21.70%);高血压肾损害8例(7.55%);多囊肾7例(6.60%);其他15例(14.15%)。
2.2 生存资料分析 使用Kaplan-Meier法计算1、2、3、4、5年生存率分别为:96.11%、85.27%、76.74%、73.12%、60.35%(图1)。106例PD病人中出现死亡事件26例(24.53%),死因构成:脑血管事件7例(26.92%),重症感染7例(26.92%),心血管事件4例(15.38%),其他8例(30.77%)。
1、2、3、4、5年技术生存率分别为:93.34%、78.94%、69.62%、64.54%、48.17%(图1)。106例PD病人中出现技术失败38例(35.85%),技术失败原因构成:死亡23例(60.53%);PDAP 8例(21.05%)(注:含3例因PDAP死亡病例);胸腹瘘2例(5.26%);其他:疝气、腹透导管漂浮、腹透导管被大网膜包裹、腹透导管皮下隧道炎、超滤衰竭各1例(分别占2.63%)。
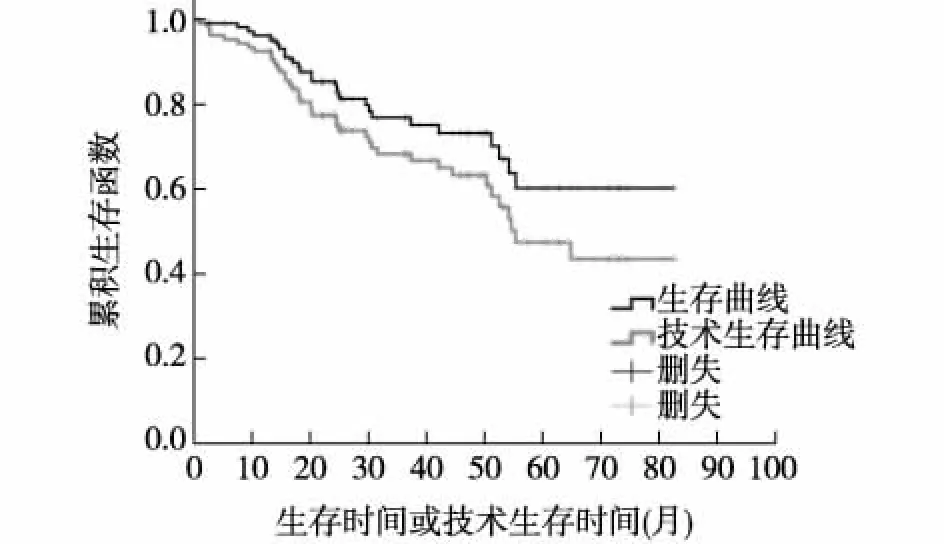
图1 生存曲线与技术生存曲线
2.3 影响预后的单因素分析 将106例PD病人分别按照首次接受透析治疗时的年龄、性别、是否患有糖尿病、是否患有心脑血管疾病、是否发生腹膜炎、血浆Alb水平、Hb水平、血浆CRP水平、血P水平、血Ca水平、iPTH水平、透析前eGFR分组,比较各组间的生存率。结果显示:老年、贫血、低Alb、高CRP、高P、糖尿病和透析前已经患有心血管疾病的PD病人的3年、5年生存率显著降低(P<0.05)。见表1。
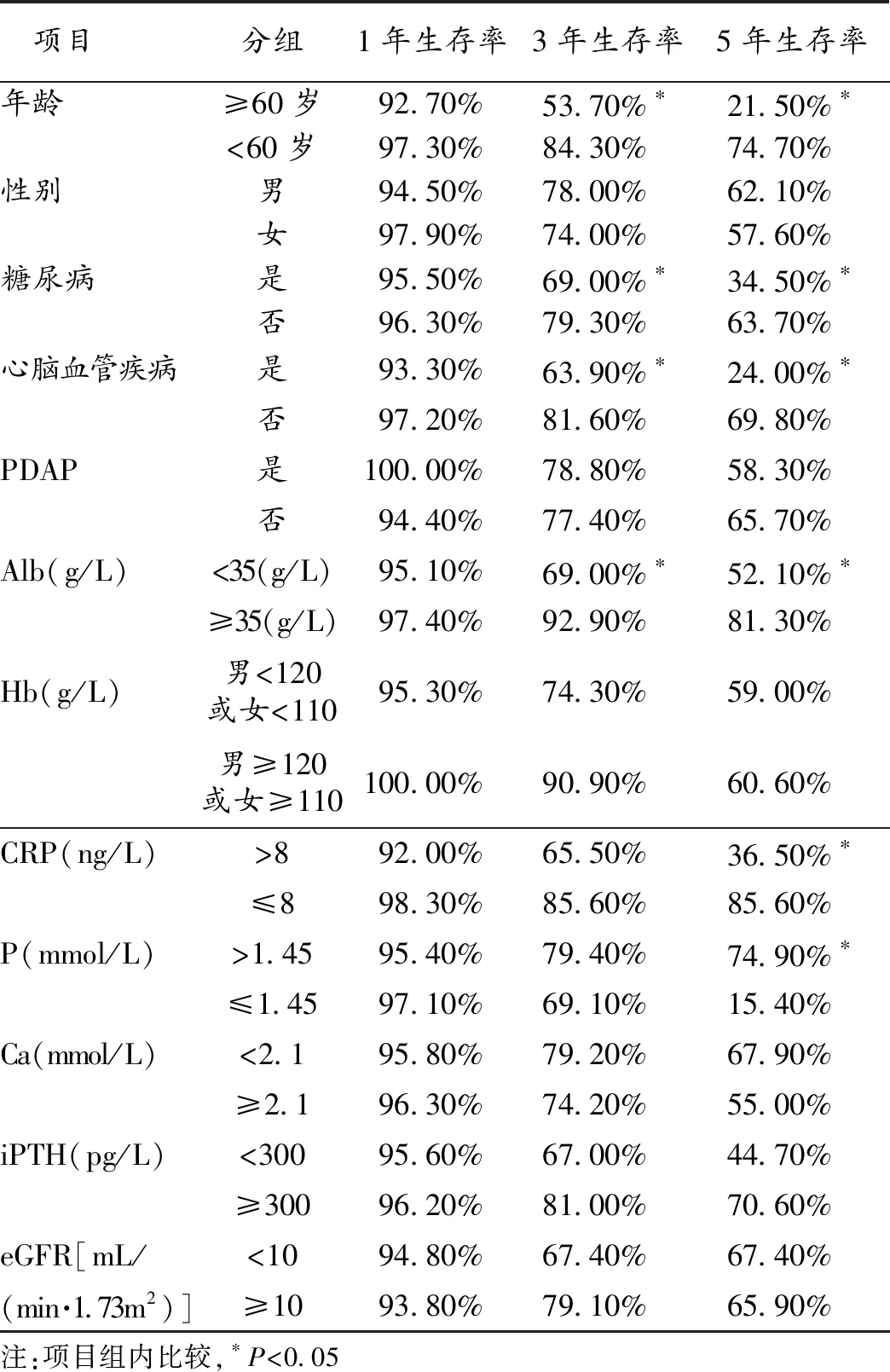
表1 影响PD病人预后的单因素分析结果(%)
2.4 多因素Cox比例风险回归分析 将上述单因素分析有意义的变量和是否发生过腹膜炎纳入多因素Cox回归模型分析,结果显示:老年(HR=4.14,P=0.02)、低Alb血症(HR=3.92,P=0.01)、高CRP水平(HR=3.73,P=0.01)是影响PD病人生存的独立危险因素。见表2。
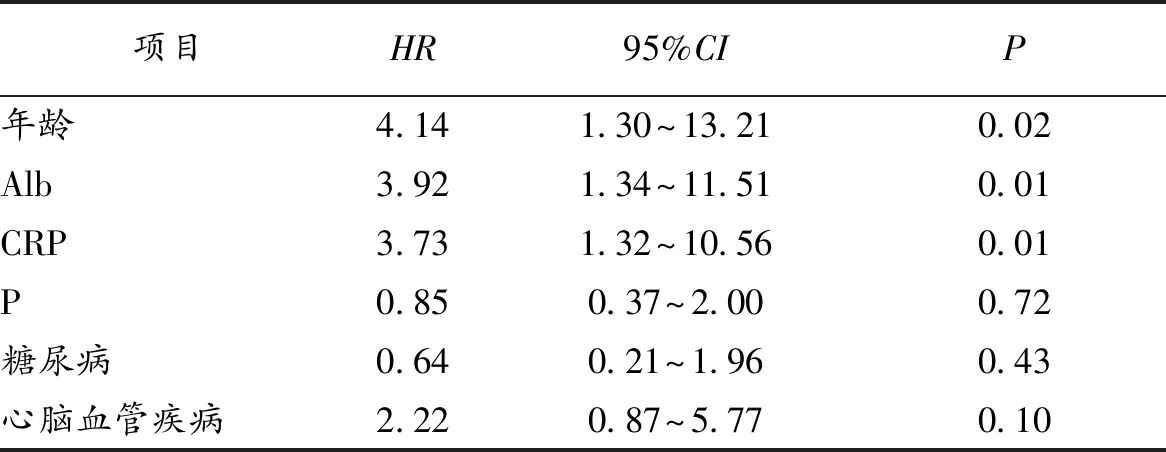
表2 多因素Cox比例风险回归分析
3 讨论
本次研究入选我院近5年内收治的106例规律行PD的病人,慢性肾炎为造成ESRD的首位原因(占50.00%),糖尿病肾病(占21.70%)和高血压肾损害(占7.55%)位居第二、三位,符合我国CKD的流行病学特点。
我院PD中心病人1、3、5年生存率分别为:96.11%、76.74%、60.35%。低于东部战区南京总医院的相关研究报道[6],但与北京协和医院[7]报道的比例基本相符合。PD病人最主要的死亡原因是心脑血管事件(占42.31%)和重症感染(26.92%)。PD病人具有较高的心脑血管事件发生,其传统的危险因素包括年龄、糖尿病、血压、血脂等。骨-矿物质代谢紊乱、慢性微炎症状态、尿毒症等也是PD病人发生心脑血管事件的重要危险因素[8]。PD病人也具有较高的感染发生率,其中最主要的感染事件是PDAP。研究表明,PDAP每增加1次,PD病人死亡风险将增加4%,PD技术失败率将增加18%[9]。PDAP仍是PD技术失败、住院率增加和死亡的最重要原因[10]。导致PDAP最主要原因是胃肠道感染和PD操作不规范[11]。因此,加强PD的技术培训,预防肠道感染,减少PDAP的发生率,显得尤为重要。
多因素Cox回归分析结果显示老年(HR=4.14,P=0.02)、低Alb血症(HR=3.92,P=0.01)和高CRP水平(HR=3.73,P=0.01)是影响PD病人生存预后的独立危险因素。其中,年龄是影响PD病人生存预后的重要因素之一。老年组(年龄≥60岁组)的生存率明显低于非老年组(年龄<60岁组);首先,老年组原发病主要为糖尿病肾病(占50.00%),而非老年组原发病主要为慢性肾炎(62.82%);糖尿病本身可以增加心脑血管事件的发生及死亡率。其次,老年组透析前心血管并发症发病率已经显著高于非老年组,而PD病人最主要的死亡原因又是心脑血管事件。且老年组病人较非老年组病人具有更低的血浆Alb水平,提示老年组病人营养不良更加严重。
PD病人血浆Alb平均水平仅为(31.93±6.10)g/L,低Alb血症在PD病人中普遍存在,血浆Alb水平是反映病人营养状态的重要指标之一,造成透析病人营养不良的主要因素有:(1)PD过程中随PD流失Alb,发生腹膜炎时丢失更为严重;(2)摄入不足和吸收障碍[12]。
PD病人普遍处于“微炎症状态”[13],其产生原因比较复杂,涉及到多种透析与非透析相关因素。微炎症状态通过多种病理生理机制影响心血管系统、营养代谢及内分泌的改变[14],包括:(1)加速动脉粥样硬化;(2)促进心肌肥厚和加重心力衰竭;(3)增加蛋白质-能量消耗;(4)导致胰岛素抵抗(insulin resistance,IR)。总之,微炎症状态是导致PD病人心脑血管事件高发的重要诱因,是增加PD病人并发症和死亡率的重要因素之一。
我院PD中心病人1、3、5年技术生存率分别为93.34%、69.62%、48.17%。技术生存率的终点事件是“技术失败 ”,但目前关于“技术失败”尚无统一定义和诊断标准。PD技术失败伴随着PD的终止,是PD最主要的限制因素。造成技术失败的原因可归纳如下7类[15]:(1)感染原因:急性、复发或持续性腹膜炎;腹透管皮下隧道或出口部位的感染;或腹腔内感染,如憩室炎等;(2)机械原因:腹透导管堵塞致腹透液出入不通畅、破裂致腹透液渗漏,腹透管漂浮致位置不佳;腹腔粘连、腹透管被腹膜包裹或腹膜出血等;疝气和胸-腹瘘;腹部其他疾病需要手术;(3)透析不充分:溶质清除不足、液体超滤不足或液体超滤过度、营养不良等;(4)腹膜功能衰竭;(5)社会原因:如病人个人偏好、病人无法管理或自我护理、地理位置等;(6)死亡;(7)其他原因。
目前争论的焦点是死亡和肾移植是否被视为技术失败的原因[16]。部分学者认为[5]:技术存活率终点事件为PD治疗方式的保留和持续,与病人当时存活与否无关。但也有学者将死亡归类为技术失败的原因[15]。PD病人死亡的同时伴随着PD治疗方式的终止;反之,PD技术失败也会增加病人死亡,两者有时互为因果。所以PD技术失败,不应局限于技术本身,死亡也应是技术失败的原因。学术界应该对PD“技术失败”有一个统一的定义和相同的诊断标准,以方便不同研究之间的相互比较。
综上所述,心脑血管事件和重症感染仍然是PD病人最主要的死亡原因;老年、营养不良和体内“微炎症状态”则是导致死亡的独立危险因素。因此,加强PD病人的监管、规范PD操作流程、预防和积极控制感染、改善营养及微炎症状态将有利于改善PD病人的生存预后。

