PON1基因多态性与吸烟的交互作用对早发冠心病的影响
杨春强 相彬 路俊生 李明 张霞 王均志
(1日照市中心医院心血管内科,山东 日照 276800;2青岛市城阳区人民医院心血管内科)
冠心病(CHD)是一类复杂和多因素促成的疾病。发病年龄男性≤55岁,女性≤65岁,则称为早发CHD(PCAD)。流行病学调查资料表明CHD已经成为发达国家人群发病和死亡原因的主要疾病之一。近年来,我国CHD发病率、患病率、死亡率均呈上升趋势〔1〕。人类血清对氧磷酶(PON)1由肝脏合成,相对分子质量为43 kD,在血清中借助于极端疏水的N端和载脂蛋白A1紧密结合,固定于高密度脂蛋白胆固醇(HDL-C)中,因能水解有机磷酸酯的底物对氧磷而命名〔2〕。研究发现PON1通过抑制低密度脂蛋白胆固醇(LDL-C)的生成和水解氧化型的LDL-C,抑制巨噬细胞的氧化应激,从而发挥抗动脉粥样硬化的作用〔3,4〕。目前PON1基因多态性与CHD的相关性亦是研究的热点。其中rs662位点引起编码区192位的非同义氨基酸置换(谷氨酸→精氨酸)〔5〕,从而导致PON1水解活性的不同。这个192谷氨酸变体水解对氧磷的效率低于精氨酸变体可以有效地抑制LDL-C的氧化〔6〕。而192精氨酸变体的抗氧化能力降低可能与CHD的发病高风险相关〔7,8〕。吸烟是目前已知的可以降低CHD患者PON1活性的影响因素〔9〕,并且烟草提取物抑制PON1活性成剂量及时间依赖性〔10〕。因此,研究CHD患者PON1基因多态性-吸烟的交互作用将会在冠心病的一级预防、高危险人群筛查中发挥重要的理论指导作用,具有广泛的应用前景。然而PON1基因多态性-吸烟交互作用是否与CHD危险性相关目前尚无统一观点。本研究拟探讨PON1基因多态性和吸烟的交互作用与中国汉族人群PCAD的相关性。
1 资料和方法
1.1研究对象 2014年6月至2017年6月日照市中心医院心血管内科住院及门诊PCAD患者688例及体检中心无CHD病史的健康体检者1 226例进行基因分型。所有研究对象要求年龄男性≤55岁,女性≤65岁,并且均采用国际上公认的诊断CHD的方法,并经冠脉增强电子计算机断层扫描或选择性冠状动脉造影检查,由专科医生进行诊断。排除标准:①其他心血管系统相关的疾病;②严重器质性疾病史及严重感染史;③妊娠哺乳及长期服用避孕药者。本研究中的研究对象均为无血缘关系汉族人。研究对象均知情同意,并自愿签署知情同意书。
1.2病史采集及实验室检查 所有研究对象采集以下信息:年龄、性别、既往病史、药物治疗、CHD家族史、行为因素、体格检查等情况。清晨取空腹静脉血送至检验科,常规进行生化检查。
1.3全血细胞基因组DNA的提取与分型 研究对象均抽取2 ml的外周静脉血置于乙二胺四乙酸(EDTA)抗凝管中,采用北京天根科技公司(Tiangen Biotech,Beijing,China)的RelaxGene Blood DNA System提取所有样本的基因组DNA。采用基于连接酶检测反应(LDR)的SNP分型技术(上海翼和应用生物技术有限公司)对所有样本的4个SNP位点进行基因分型。简要流程如下:①通过多重PCR技术(Multiple PCR)获得含有待检测突变位点的基因片段;②通过多重LDR技术(Multiple LDR)进行基因分型检测;③最后通过测序仪电泳读取检测结果。
为了确保实验质量,我们在分型中使用了双重阳性对照(相同DNA样本的重复)和阴性对照(空白,不含DNA 样本)。SNP和样本分型正确率在95%以上时方可进入下一步的实验流程。
1.4统计学分析 采用SPSS18.0软件进行统计分析。计数资料用例(百分率)表示,计量资料用均数±标准差表示。计量资料组间比较时,满足正态性及方差齐性的数据采用完全随机设计两独立样本均数比较的t检验,不满足正态性及方差齐性者则采用非参数检验。所有计数资料的统计使用χ2检验以及基于二分类变量的Logistic回归检验。本研究采用广义多因子降维法(GMDR)分析各种变量间的组合并判读较好的模型。在一次性分析多个SNP是否与疾病相关联时,如果将P值定义在0.05水平,则多重比较会增加假阳性结果,因此需要对此进行校正,以减少假阳性的结果。主要应用Bonferroni Correction法〔11〕进行多重比较的校正。
2 结 果
2.1一般资料分析 两组性别和年龄差异无统计学意义(P>0.05)。PCAD组的高血压病史、糖尿病病史、吸烟史及家族史所占比例均明显高于对照组(P<0.05)。与对照组比较,PCAD组体重指数(BMI)及LDL-C水平明显升高(P<0.05),而HDL-C水平明显降低(P<0.05)。见表1。
2.2对照组和PCAD组rs3735590、rs3917550、rs662、rs3917481等位基因和基因型频率的分布 所有SNP位点均显示出2个等位基因及3个基因型。rs3735590、rs3917550、rs662、rs3917481等位基因和基因型频率分布在PCAD组和对照组间差异无统计学意义(P>0.05)。见表2。
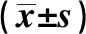
表1 对照组与PCAD组一般资料分析

表2 对照组与CHD组基因型和等位基因频率的分布〔n(%)〕
1)经BonferroniCorrection法多重比较校正,下表同
2.3不同遗传模型下(共显性、显性和隐性和加性模型)rs3735590、rs3917550、rs662,、rs3917481位点与PCAD的关联分析 运用基于二分类变量的Logistic回归在不同遗传模型下进行所研究位点与PCAD的关联分析。结果显示rs3735590位点在隐性模型 (TTvsCT+CC)下与PCAD相关(P=0.007 6,OR=0.23,95%CI=0.07~0.75)。在经过多重校正后依然有统计学意义(P=0.030 4)。而rs3917550、rs662,、rs3917481在不同遗传模型下均与PCAD遗传易感性不相关(P>0.05)。见表3。

表3 不同遗传模型下rs3735590、rs3917550、rs662、rs3917481位点与PCAD的关联分析
共显性模型:CT vs CC;TT vs CC(T);显性模型:TT+CT vs CC(T为最小等位基因);隐性模型:TT vs CT+CC(T为最小等位基因);加性模型:TT vs CT vs CC(T为最小等位基因);P值:经性别、年龄、高血压、糖尿病、吸烟史、家族史、BMI、HDL-C、LDL-C校正,下表同
2.4按照吸烟史分层后rs3735590、rs3917550、rs662、rs3917481与PCAD的关联性分析及基因-吸烟的相乘的交互作用分析 因为rs3735590、rs3917550及rs3917481的风险基因型频率较少,同时,在大部分情况下,显性模型也显示了更好的适应性。因此我们运用基于二分类变量的Logistic回归在显性模型下进行相乘的基因-吸烟交互作用分析。结果显示rs3735590及rs662与吸烟存在相乘的交互作用(均P<0.000 1)。并且在按照吸烟史分层后,我们发现rs662位点的等位基因T(基因型为CT+TT)与吸烟的PCAD患者的发病风险相关(P<0.05)。而rs3735590与有吸烟史及无吸烟史的PCAD患者的发病风险均相关(均P<0.05)。其余两个位点并未发现与PCAD的相关性(P>0.05)。见表4。

表4 按照吸烟史分层后rs3735590、rs3917550、rs662、rs3917481与PCAD的关联性分析及基因-吸烟间的交互作用
2.5rs3735590、rs3917550、rs662、rs3917481与吸烟的相加的基因-吸烟交互作用分析 本研究同样在显性模型下进行相加的基因-基因交互作用分析。我们使用2×2的析因设计来计算相加的基因-基因交互效应。假设A(-)为非风险基因型,则A(-)/A(-)为参照组,RR11为A(+)/A(+)组风险/参照组的风险(OR值),RR10为A(+)/A(-)组风险/参照组的风险,RR01为A(-)/A(+)组风险/参照组的风险。表5为不同位点组合下计算的RR11,RR10和RR01。如rs3735590/吸烟-0/0表示CC-无吸烟史组合;rs3735590/吸烟-0/1表示CC-有吸烟史组合;rs3735590/吸烟-1/0表示CT+TT-无吸烟史组合;rs3735590/吸烟-1/1表示CT+TT-有吸烟史组合。结果显示调整混杂因素后,并未发现有统计学意义的交互作用效应。
2.6rs3735590、rs3917550、rs662、rs3917481基因-吸烟交互作用的GMDR分析 本研究通过GMDR0.9软件进行多因子降维分析2.6rs3735590、rs3917550、rs662、rs3917481基因-吸烟交互作用。表6列出了不同组合的最佳模型,及训练精确度、测试精确度及10次拟合的交叉验证一致性(CV)。结果显示rs3735590-rs3917550-rs662-rs3917481-吸烟构成的组合符号检验有统计学意义(P=0.001),且训练精准度、测试精准度及CV都较高,因此为最佳交互作用模型。

表5 rs3735590、rs3917550、rs662、rs3917481与吸烟交互作用叉生分析(n)
吸烟0/1:无吸烟史/有吸烟史;rs3735590 0/1:CC/CT+TT;rs3917550 0/1:GG/GA+AA;rs662 0/1:CC/CT+TT;rs3917481 0/1:CC/CT+TT

表6 基因-吸烟交互作用和PCAD风险的广义多因素降维模型
3 讨 论
PCAD病理学研究表明其动脉粥样硬化斑块富含脂质泡沫细胞,为软斑块〔12〕,此种软斑块进展迅速易破裂是冠状动脉血栓形成的主要原因,故PCAD多无先兆症状,急性起病多表现为急性冠脉综合征,尤其是急性心肌梗死,病死率极高〔13〕。研究发现,典型的PCAD患者多为超重、重度吸烟、血压升高并且一级亲属多有CHD病史的患者〔14〕。与本研究结果类似。
吸烟是目前公认的可引起过早死亡的最为重要的因素,并且为CHD的关键独立危险因素。本研究结果与其他在东亚裔人群中的研究相似〔15〕,在整体人群中本研究并未发现PON1基因rs662位点的多态性与PCAD相关。然而,在按照吸烟史分层后,我们发现等位基因T(基因型为CT+TT)增加了吸烟PCAD患者的发病风险。有研究发现,HDL-C参与了PONI基因对CHD发病的过程〔16〕,rs662位点的C等位基因与较低的HDL-C水平相关。然而,与他人研究结果一致〔17〕,我们并未发现PON1基因与HDL-C的相关性(数据未显示)。此外,本研究说明PON1的rs662位点与吸烟的交互作用对PCAD的影响并非是由HDL-C等常见的危险因素介导的。
此外,本研究亦发现一个新的位点rs3735590与吸烟的交互作用或许参与了PCAD的发病。rs3735590位点位于PON1基因的3′非翻译区(UTR)。研究显示该位点的等位基因C到T的改变,可以降低miRNA-616对PON1基因3′UTR的亲和力,从而促进该基因的表达,并降低动脉粥样硬化的风险〔18〕。本研究与以上研究相似,本研究结果提示TT基因型或许可以降低PCAD的发病风险。此外,我们发现对于有吸烟史的PCAD患者,携带等位基因T (基因型为CT+TT)或许降低了43%的发病风险。然而,在无吸烟史的PCAD患者中,我们发现了等位基因T似乎增加了PCAD的发病风险。鉴于后者为边界P值,这种现象很难理解,或许可以解释为吸烟与该位点的基因-环境之间的上位性效应弱化了单个位点的等位基因或基因型的效应。因为目前仅有关于烟草提取物通过修饰PON1的自由巯基而改变血浆中该酶活性的生物学研究,却罕见关于吸烟与PON1基因多态性交互作用的分子生物学研究。因此,未来需要更多的体内及体外研究加以证实。
复杂疾病的发生往往涉及到多个基因的交互作用,基因之间、基因与环境之间也存在着复杂的调控机制。因为没有最好的统计学方法来检验基因-基因、基因环境交互作用,本研究结果Logistic回归分析结果说明两个位点rs373559与rs662与吸烟的交互作用是非依赖性的。传统的Logistic回归分析方法可用于基因间交互作用的研究,但是对于多变量的研究对象,交互作用也随之增加,出现所谓的超参数化,从而降低检验效能。因此,多因子降维分析法(MDR)应运而生,在基因交互分析中得到了广泛应用。MDR是一种非参数、无需遗传模式的分析方法,它的主要特点是把高维的位点组合分成高危和低危两类,降低了数据的维数,并通过交叉验证来检验模型。最后得到的结果是一组模型,每一个模型是从一个特定交互级别(l阶、2阶、…交互作用)中选取最优的。该方法不仅适用于病例对照的研究设计,而且可应用于复杂疾病的交互作用分析。以MDR方法为基础,学者发展了GMDR。与MDR相比较,GMDR采用基于广义线性回归的积分的统计方法,代替了MDR中的高危和低危分类,可处理计量和计数资料,同时允许调整协变量。这种方法和MDR丢失大量信息的降维方法不同,从而把握度也得到提高。本研究结果显示rs3735590-rs3917550-rs662-rs3917481-吸烟构成的组合符号检验有统计学意义(P=0.001),且训练精准度、测试精准度以及交叉一致性都较高,因此为最佳交互作用模型,与PCAD发病有关,它们之间的调控机制可能参与了PCAD疾病的发展进程,然而值得注意的是GMDR分析只是产生假说,这些推测都需要得到进一步的证实。
本研究尚存在一些不足之处。①未能将这四个位点与血浆PON1活性做进一步分析。尽管如此,前人的一些研究或许能支持我们的结论。②未能进一步分析PCAD患者PON1基因多态性与吸烟严重程度的交互作用。因为前已述及,烟草提取物抑制PON1活性成剂量及时间依赖性。因此,未来需要进一步的研究,例如按照 “年支”划分吸烟的分严重程度加以证实PON1基因与吸烟在PCAD患者中的交互作用效应。
综上,本研究从表观遗传学的角度分析了PON1基因的4个SNP位点与吸烟的交互作用对PCAD的影响。结果发现两个位点rrs3735590和rs662与吸烟存在交互作用,或许参与了PCAD的发病机制。因此,本研究或为从基因环境交互作用的角度研究若干相关基因与PCAD的关系提供了新的研究方向。

