炎症性肠病与小肠细菌过度生长关系的荟萃分析
阚美佳, 张尤历, 徐 岷
江苏大学附属医院消化科,江苏 镇江 212000
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性特发性肠道炎症性疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)。临床可表现为腹痛、腹胀、腹泻、黏液脓血便等症状。目前其发病机制尚不明确,有研究认为,IBD是肠道微生物与肠道免疫系统相互作用的结果[1-2],肠道微生物群的组成可能影响IBD的易感性[3]。
小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)是指远端肠道内菌群因各种原因移位进入小肠,造成小肠黏膜炎症、通透性破坏及绒毛损伤,主要表现为营养吸收不良、腹痛、腹胀、腹泻和小肠动力异常等症状[4]。最近部分研究表明,SIBO在IBD患者中的阳性率显著高于正常人群[5-11],KLAUS等认为,IBD患者腹痛、腹胀等症状与SIBO相关[12],同时也有部分研究发现,IBD患者与健康对照者相比,SIBO阳性率差异无统计学意义[13]。因此,本系统评价旨在运用循证医学的原理和方法,探讨IBD与SIBO之间的关系,以指导临床。
1 资料与方法
1.1 文献检索以 “IBD”or“inflammatory bowel disease”or“UC”or“ulcerative colitis”or“CD”or“Crohn’s disease”and“SIBO”or “small intestinal bacterial overgrowth”or “bacterial infections”检索PubMed、Web of Science、Cochrane Library、Embase数据库,以“炎症性肠病”or“溃疡性结肠炎”or“克罗恩病”and“小肠细菌过度生长”检索CNKI、CBM、万方、维普数据库,并手工检索相关参考文献。检索时间为建库至2019年3月15日。
1.2 文献纳入和排除标准纳入标准:(1)病例对照研究,语种限制为中英文;(2)纳入对象为成年人,IBD诊断结合了临床表现、影像学、内镜检查及组织病理学检查;(3)所有对象近4周内未使用抗生素、益生菌或PPI制剂;(4)使用葡萄糖呼气试验(GBT)或乳果糖呼气试验(LBT)检测SIBO阳性率,氢气及甲烷阳性标准由各研究自定义;(5)结局指标反映了IBD患者及对照组人群中SIBO阳性率。排除标准:(1)重复发表的文献;(2)综述、会议摘要及无法获得数据或数据不全的文献。
1.3 数据提取和方法学质量评价按照纳入和排除标准,由2名有相关知识背景的研究者独立对文献进行数据提取,内容包括文献的作者、发表年份、国家、SIBO诊断方式及IBD患者与对照组SIBO阳性率等。数据提取完毕后进行交叉核对,如有分歧则由第三方协助解决。按照纽卡斯尔-渥太华量表(newcastle-ottawa scale,NOS),通过人群选择、可比性、暴露评价对研究质量进行评价,满分为9 分,得分≥7分为高质量研究,4~6分为中等质量研究,<4分为低质量研究。
1.4 统计学分析本研究采用Cochrane协作网提供的RevMan 5.3软件进行荟萃分析,结局指标用OR值及95%CI表示。首先对各病例对照研究行随机效应模型统计分析: 若P≥0.1、I2≤50%,说明各研究间无异质性,采用固定效应模型;若P<0.1、I2>50%,说明各研究间存在异质性,采用随机效应模型,并通过亚组分析及敏感性分析来判断异质性来源。最后用漏斗图进行发表偏倚评估。P<0.05为差异有统计学意义。
2 结果
2.1 纳入文献基本情况通过文献检索,查找到1 336篇相关文献,包括157篇中文和1 179篇英文文献。通过Endnote软件剔重、阅读摘要及全文后,最终纳入8篇文献[5-11, 13],包括5篇英文文献,3篇中文文献,累积IBD病例692例,对照组517例。根据NOS量表评估纳入研究质量,所有研究评分均≥7分,被认为是高质量研究。纳入文献的基本信息及方法学质量评价见表1,具体筛选流程见图1。
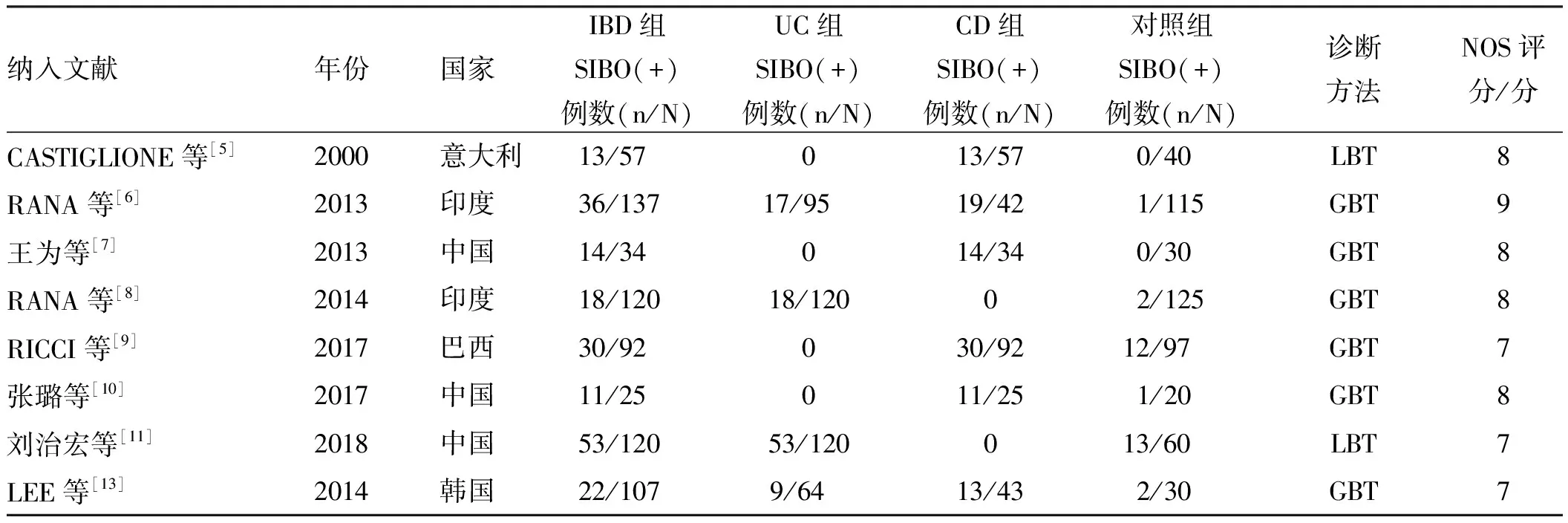
表1 纳入文献的基本信息及方法学质量评价Tab 1 Basic information and methodological quality evaluation of the literature
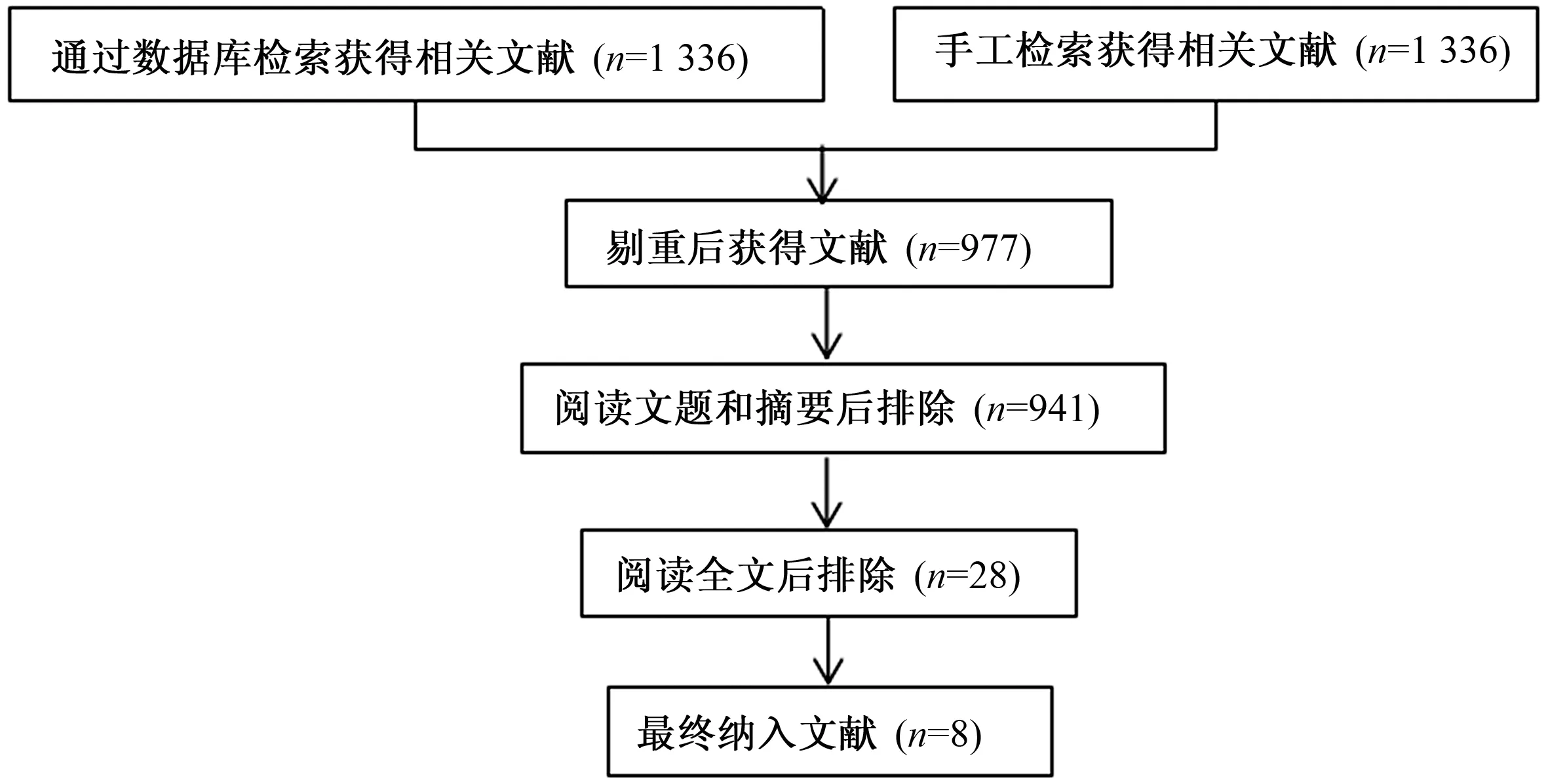
图1 纳入文献筛选流程图
2.2 异质性检验与Meta分析IBD与SIBO的相关性分析:对8项研究进行Meta分析,异质性检验显示,研究之间存在异质性(I2=52%,P=0.04),采用随机效应模型。Meta分析结果显示,IBD增加了发生SIBO的风险(阳性率为28.47%),与对照组相比差异有统计学意义(OR=7.04,95%CI:3.34~14.82,P<0.05)(见图2)。
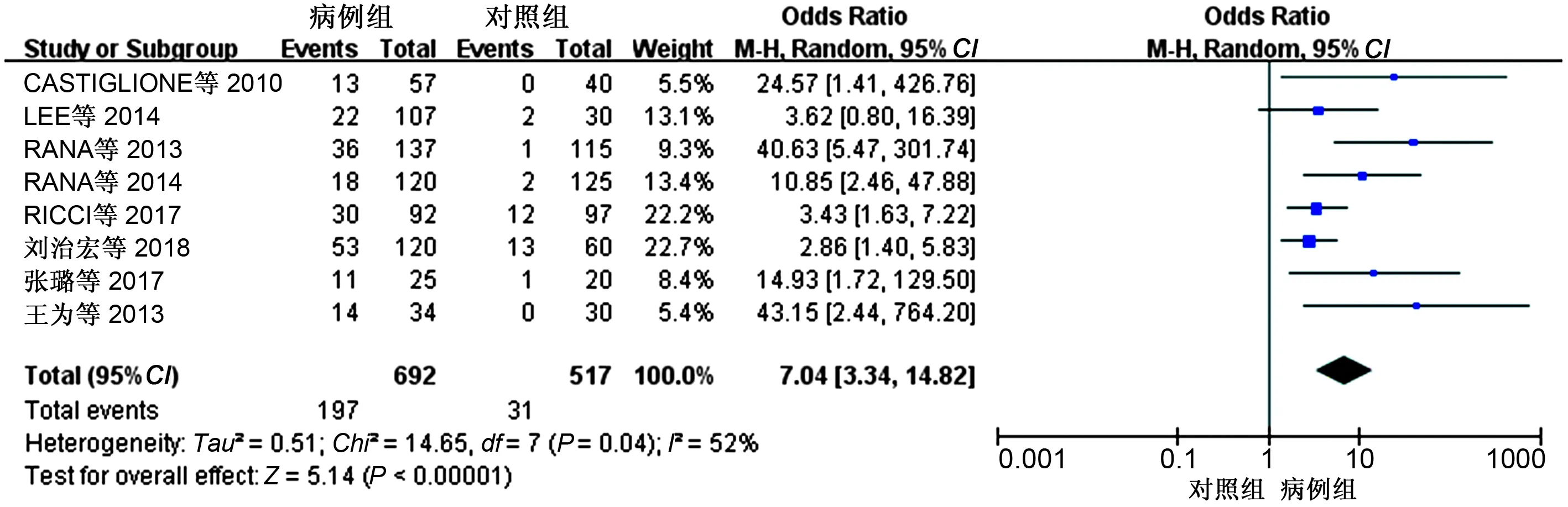
图2 IBD与SIBO相关性Meta分析森林图
2.3 亚组分析结果
2.3.1 地区亚组分析结果:为分析异质性来源,我们将纳入的文献进行了地区亚组分析,其中6项研究涉及亚洲地区IBD患者SIBO阳性率,2项研究涉及欧美地区IBD患者SIBO阳性率。Meta分析结果显示,在亚洲地区,IBD患者中SIBO阳性率较对照组显著增加,差异有统计学意义(亚洲地区:OR=8.77,95%CI:3.18~24.21,P<0.05);而在欧美地区差异无统计学意义(OR=5.85,95%CI:0.96~35.76,P>0.05)(见图3)。
2.3.2 SIBO诊断方法亚组分析结果:不同诊断方法具有不同的灵敏度和准确度,对此我们将纳入文献根据SIBO不同诊断方法进行亚组分析,其中6项研究使用了GBT检测SIBO阳性率,2项研究使用了LBT检测SIBO阳性率。Meta分析结果显示,GBT组中病例组的SIBO阳性率高于对照组,差异有统计学意义(OR=8.84,95%CI:3.46~22.59,P<0.05),而LBT组中差异无统计学意义(P>0.05)(见图4)。
2.3.3 疾病分类亚组分析结果:将纳入研究分为 UC 组和CD 组,对两组进行亚组分析,其中6项研究涉及CD患者的SIBO阳性率,4项研究涉及UC患者的SIBO阳性率,Meta分析结果显示:无论在UC还是CD患者中病例组SIBO阳性率均高于对照组,差异有统计学意义(CD:OR=13.49,, 95%CI:4.01~45.39,P<0.05;UC:OR=5.29, 95%CI:1.93~14.55,P<0.05)(见图5、图6)。其中,有4项研究对CD患者是否行回结肠手术与SIBO阳性率的关系进行了探讨,对此进行Meta分析,结果显示,手术组患者SIBO阳性率高于非手术组,差异有统计学意义(OR=1.96,95%CI:1.04~3.68,P<0.05)(见图7)。
2.4 敏感性分析所有纳入的8项研究均涉及IBD患者SIBO阳性率,运用RevMan 5.3软件行敏感性分析,分别剔除各研究,异质性P值和合并效应量P值均未发生改变,研究结果稳定。
2.5 发表偏倚分析根据《Cochrane手册》,本文纳入研究的文献数目少于10篇,未行漏斗图发表偏倚分析。
3 讨论
IBD是一种发生在消化道的慢性特发性炎症性疾病,包括UC和CD。目前其发病机制尚不完全明确,有研究指出,肠道黏膜免疫功能的失调、肠道微生物群
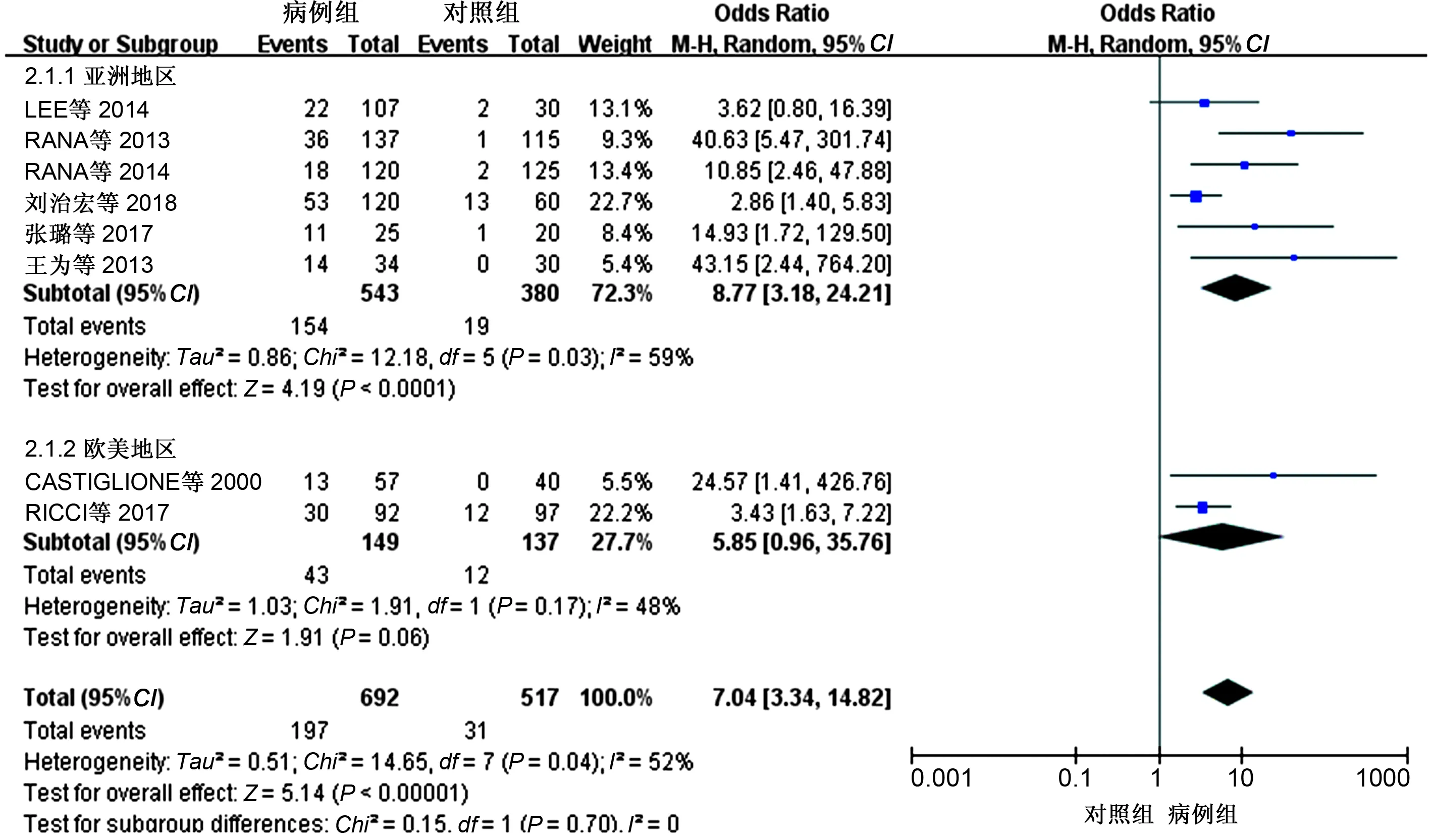
图3 亚洲和欧美地区IBD与SIBO相关性Meta分析森林图
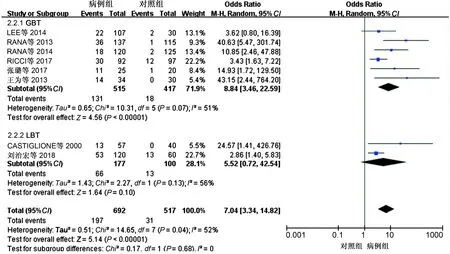
图4 不同诊断方法IBD与SIBO相关性Meta分析森林图
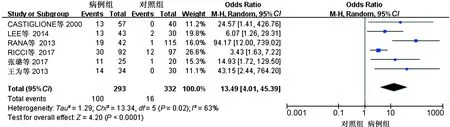
图5 CD与SIBO相关性Meta分析森林图
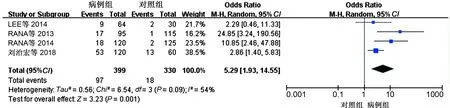
图6 UC与SIBO相关性Meta分析森林图

图7 CD患者中手术和非手术与SIBO相关性Meta分析森林图
的紊乱及基因易感性共同参与了IBD的发生[14]。动物研究发现,缺乏肠道细菌的小鼠不发生严重结肠炎,该研究结果支持了肠道菌群失调引起肠道黏膜免疫反应,从而促进黏膜炎症损伤的假说[3]。同时,有研究表明,肠道菌群种类和数量的改变可能是IBD发生、发展的关键因素。对IBD患者的肠道菌群进行微生物多样性分析发现,变形菌门的种类和数量明显增加,而厚壁菌门的丰度降低,多样性减少。尤其在CD患者中,被认为具有抗炎效应,可明显改善肠道炎症反应的普拉梭菌明显减少[15]。
SIBO是指远端肠道内菌群因各种原因移位进入小肠,造成小肠黏膜炎症、通透性破坏及绒毛损伤,主要表现为营养吸收不良、腹痛、腹胀、腹泻和小肠动力异常等症状[4]。SIBO最佳诊断方法被认为是从近端空肠抽吸肠液,进行定量细菌计数,每毫升空肠抽吸液中存在≥105个菌落形成单位(CFU)可诊断为SIBO阳性[16]。然而,空肠抽吸的侵入性、耗时性及高成本减少了它的实际应用,可能会降低SIBO的检出率[17],因此近几年来呼气试验由于它易于操作和非侵入性被广泛运用于SIBO的检测。目前,最常用的是GBT和LBT,研究表明,GBT的准确性高于LBT(71.7%vs55.1%)[18]。为了减少小肠中细菌的数量,抗生素常被用于治疗SIBO。相关Meta分析纳入了抗生素治疗SIBO的临床研究,以呼气试验的转阴作为结局指标,抗生素治疗SIBO的总体有效率高于对照组,其中有8项研究探讨了利福昔明治疗SIBO的有效率,表明利福昔明治疗SIBO的有效率高于安慰剂组,并且联合使用益生元制剂可提高呼气试验的转阴率。另外探讨甲硝唑疗效的研究有2项,探讨新霉素、氯四环素、环丙沙星疗效的研究各有1项,结果表明抗生素有利于SIBO的治疗,尤其是利福昔明对治疗SIBO有效[19],同时有研究表明,利福昔明根除SIBO的成功率超过了50%[20]。
由于IBD在腹痛、腹胀、腹泻等症状方面与SIBO的表现相似,且IBD患者,尤其是CD患者,可能出现瘘管、肠腔狭窄、运动障碍和回盲瓣破坏,这些可能是SIBO发生的诱因[21]。同时,SIBO引起肠道菌群紊乱,可能产生炎症介质引发肠道黏膜免疫反应,从而促进黏膜炎症损伤,进一步加重IBD或促使缓解期IBD的活动性发作。研究表明,在UC患者中,SIBO阳性患者的促炎细胞因子IL-6、IL-8、TNF-α水平明显高于SIBO阴性患者,而抗炎细胞因子IL-10水平明显低于SIBO阴性患者[8]。因此越来越多的研究致力于探究IBD与SIBO之间的关系。
本研究通过对纳入的8项病例对照研究进行荟萃分析,系统评价了IBD与SIBO之间的关系。结果表明,IBD增加了发生SIBO的风险(阳性率为28.47%),与对照组相比差异有统计学意义。由于各研究之间异质性较高,我们对地区、检测方法及疾病分类进行了亚组分析。结果显示,在亚洲地区,IBD患者中SIBO阳性率显著高于正常人群,而在欧美地区,IBD患者与正常人群SIBO阳性率差异无统计学意义,这可能与欧美地区纳入研究较少,样本量小有关,也可能与不同地区人群肠道环境有差异,易感性不同相关。在不同的检测方法中,GBT组SIBO阳性率显著高于正常人群,而LBT组IBD与SIBO无明显关联,这可能与LBT组样本量较小相关,也可能与LBT检测SIBO灵敏性及准确性低于GBT相关。在不同的疾病分类中,SIBO阳性率与总体结果一致,但CD患者中SIBO阳性率高于UC患者,这可能是由于CD患者更容易出现瘘管、肠腔狭窄、运动障碍和回盲瓣破坏,造成肠道结构破坏及动力紊乱,从而诱发SIBO[21]。同时,对CD患者是否行回结肠手术与SIBO阳性率的关系进行分析,结果显示,手术组患者SIBO阳性率显著高于非手术组,这可能是由于肠腔结构破坏使远端肠道内菌群移位进入小肠,也可能由于术后肠道运输迅速,增加了呼气试验对SIBO诊断的假阳性率[22]。
综上所述,IBD患者中的SIBO阳性率显著高于正常人群,对IBD患者进行SIBO检测在临床诊断和治疗中具有一定价值。由于本研究纳入文献数量较少,并且采用不同检测方法,可能造成一定的偏倚,影响结果准确性,更多高质量大样本的研究有待开展。

