IL-21/STAT3通路在小鼠自身免疫性肝炎发病中的作用及意义
艾 国,张志成,杨 雅,王 鸣
华中科技大学同济医学院附属同济医院 1.儿科;2.消化科;3.感染科,湖北 武汉 430030
自身免疫性肝炎(autoimmune hepatitis,AIH)肝脏病理损伤主要由机体自身免疫反应所介导,但该病的病因和发病机制目前尚未完全阐明[1]。抗炎及促炎因子之间的平衡失调与炎症病理密切相关,白细胞介素21(interleukin-21,IL-21)可介导多种生物学效应的细胞因子,主要由活化的CD4+T辅助细胞等合成和分泌,参与某些自身免疫性疾病及感染等的发病[2]。IL-21与其受体IL-21R结合后可通过信号传导途径如JAK/STAT传递活化信号[3]。在一些自身免疫相关性疾病中发现信号传导和转录激活因子3(signal transducers and activators of transcription 3,STAT3)的信号通路存在异常[4]。目前关于炎症介质及其通路的研究在AIH中较少,本研究建立实验性自身免疫性肝炎(experimental autoimmune hepatitis,EAH)模型,观察炎症因子IL-21、IL-21R和STAT3的表达,探讨IL-21/STAT3通路在小鼠自身免疫性肝损伤中的作用,为探寻新的治疗方法和干预目标提供依据。
1 材料与方法
1.1 实验动物雌性SPF级C57BL/6小鼠30只,4~6周龄,体质量18~20 g,购买并饲养于华中科技大学同济医学院实验动物中心,供给无菌饮水和清洁饲料,适应环境温度和湿度。
1.2 动物分组及处理将小鼠随机分为模型组和正常对照组,每组各15只;按照建立小鼠EAH模型的方法[5]建立EAH模型。造模后第4周,每组取8只小鼠,乙醚吸入麻醉后,摘眼球取外周血,静置离心后取血清,检测ALT、AST等生化指标;采血后处死小鼠,取肝组织,一部分用于肝脏淋巴细胞的分离;一部分予以4%甲醛固定,石蜡包埋切片HE染色,然后在显微镜下阅片观察肝组织的病理改变;另一部分快速冻存于液氮中以提取总RNA。
1.3 主要试剂兔抗IL-21和兔抗STAT3单克隆抗体(武汉赛维尔生物有限公司);IL-21、IL-6酶联免疫吸附试验ELISA试剂盒(达科为生物有限公司);免疫组化SP兔两步法试剂盒(武汉博士德生物技术有限公司);PCR扩增引物(由武汉大风生物技术有限公司设计合成);RT-PCR试剂盒及SYBR GreenⅠ荧光染料(日本东洋纺公司);TRizol试剂(美国Invitrogen公司);CD3-FITC小鼠单抗,CD4-PE小鼠单抗,CD8-APC小鼠单抗,IL-21R-Percp-cy5.5小鼠单抗(美国eBioscience公司)。
1.4 血清IL-21、IL-6含量检测采取外周血后室温静置1 h,3 000×g离心10 min后提取上层清液,用ELISA试剂盒依照说明书步骤检测血清中IL-21和IL-6的含量,酶标仪450 nm检测待测样本,绘制出标准曲线,得到线性回归方程,然后将样本的吸光度值代入回归方程,得到浓度值。
1.5 肝脏淋巴细胞分离及流式细胞分析肝脏取材后,于400目尼龙网研磨过滤,红细胞裂解液裂解红细胞,PBS洗涤后按照淋巴细胞分离液说明书分离出肝脏淋巴细胞,洗涤离心后100 μl/管重悬于2%多聚甲醛-PBS,分别加入抗小鼠CD3-FITC、CD4-PE、APC-CD8及Percp-cy5.5-IL-21R各10 μl行细胞表面染色标记,4 ℃避光孵育45 min;加入流式缓冲液洗涤,最后重悬于2%多聚甲醛-PBS,在BD FACS CantoTMⅡ型流式细胞仪上机检测,以FSC和SSC设门,CD3及CD4双阳性圈定CD4+T淋巴细胞,CD3及CD8双阳性圈定CD8+T淋巴细胞,然后分别测定其中IL-21R+细胞比例。
1.6 肝组织IL-21和STAT3 mRNA表达水平检测采用TRIzol试剂等提取肝组织总RNA,定量逆转录合成cDNA,然后用SYBR GreenⅠ荧光染料技术在25 μl PCR反应体系进行PCR扩增。引物设计:(1)内参GADPH:5′-CCTTCCGTGTTCCTACCC-3′(上游),5′-CCCAAGATGCCCTTCAGT-3′(下游);(2)IL-21:5′- ATTAAAGCTTCTGGTGGCATGGAGAGGAC-3′(上游),5′-TAGGATCCTGTGTTCTAGGAGAGATGCTG-3′(下游);(3)STAT3:5′-CACCTTGGATTGAGAGTCAAGAC-3′(上游),5′-AGGAATCGGCTATATTGCTGGT-3′(下游)。RT-PCR反应条件:95 ℃ 1 min,95 ℃ 15 s,58 ℃ 20 s,72 ℃ 40 s,主循环40个。采用2-△△CT法,通过所获循环阈值(Ct)计算目的基因相对表达水平。
1.7 肝组织IL-21和STAT3蛋白表达检测采用免疫组化方法,将肝组织石蜡切片予以脱蜡脱水后,阻断内源性过氧化酶活性,血清封闭等步骤后,滴加50 μl一抗(兔抗IL-21或兔抗STAT3多克隆抗体;稀释比例均为1∶100),4 ℃孵育过夜,PBS冲洗后滴加羊抗兔二抗溶液,室温孵育30 min,PBS冲洗后用DAB溶液染色,然后以苏木素复染,PBS冲洗干净后脱水、封片,显微镜下阅片。

2 结果
2.1 肝组织病理及生化改变造模后第4周,与正常对照组相比,模型组小鼠观察到明显炎症反应,可见较多淋巴细胞浸润,主要集中在肝小叶区和血管周围等,伴有肝细胞变性和坏死,部分肝组织可见局灶性坏死(见图1)。模型组血清ALT水平较正常对照组明显升高(P=0.0286),血清AST水平也升高(P=0.0159),差异有统计学意义(见图2)。血清生化和病理改变说明此阶段肝组织炎症反应及病理损伤较为明显。
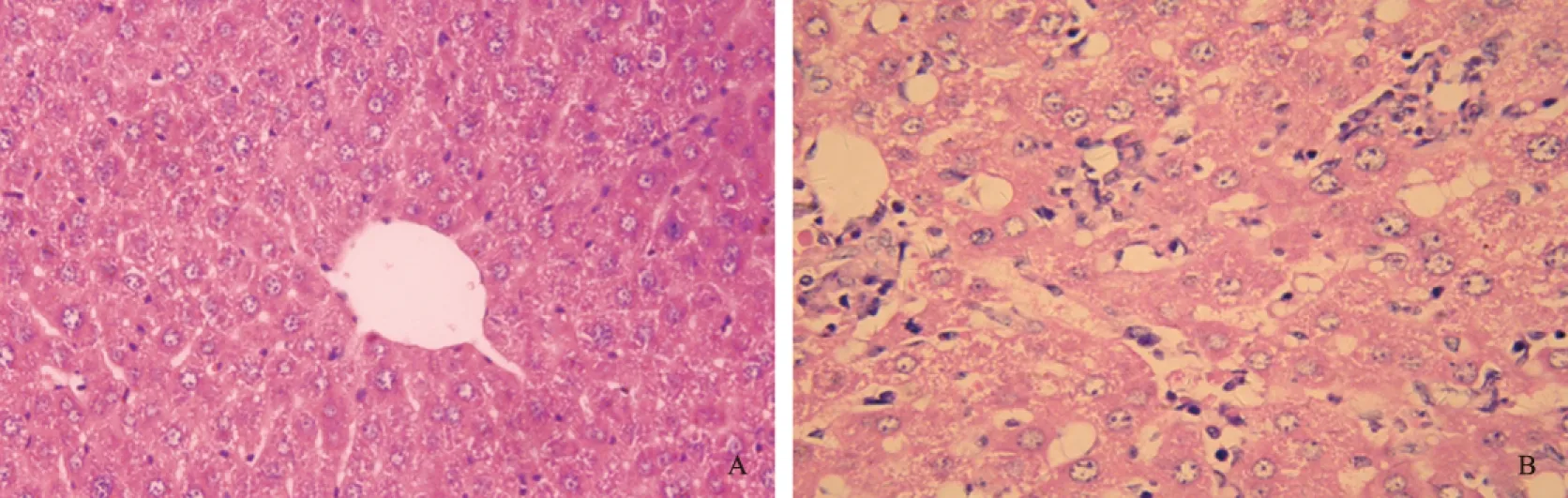
图1 小鼠肝脏病理HE染色(放大400倍) A: 正常对照组; B: 模型组 Fig 1 Liver HE staining of mice A:normal control group; B:EAH group
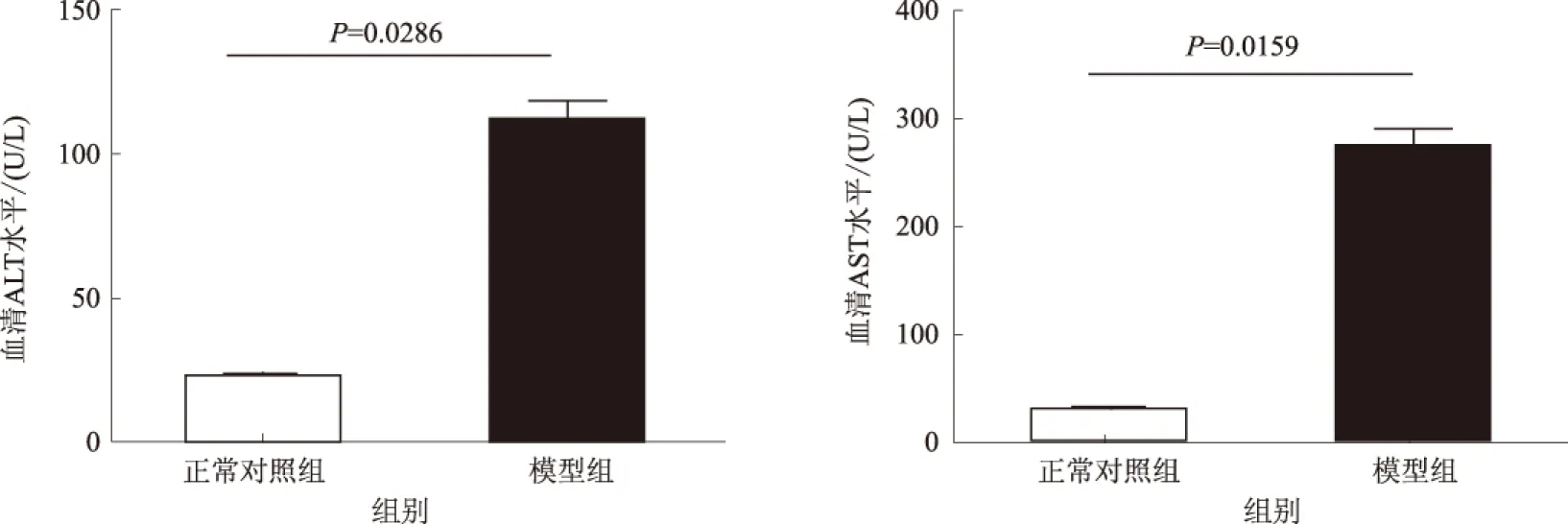
图2 小鼠血清ALT及AST水平Fig 2 Serum levels of ALT and AST in mice
2.2 小鼠血清IL-21、IL-6含量及相关性分析ELISA法检测外周血清炎性介质,与正常对照组相比,模型组血清IL-21水平显著升高(P=0.0079),IL-6水平也升高(P=0.0159,见图3)。IL-21与IL-6相关性分析显示两者呈正相关(r=0.9425,P<0.05)。IL-21与ALT相关性分析显示两者也呈正相关(r=0.9116,P<0.05)。
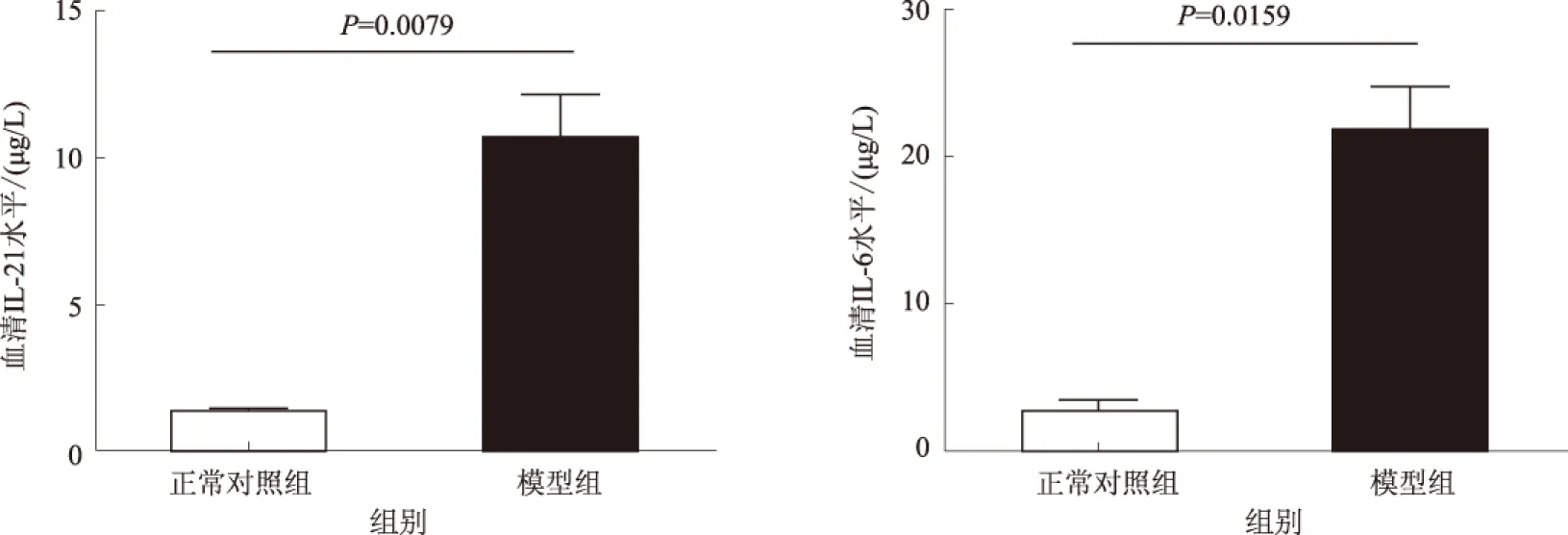
图3 小鼠血清IL-21及IL-6的含量 Fig 3 Serum levels of IL-21 and IL-6 in mice
2.3 小鼠肝脏T淋巴细胞IL-21R表达流式细胞染色分析检测肝脏T淋巴细胞上IL-21R的表达水平,结果显示,模型组小鼠肝脏淋巴细胞CD4+T的IL-21R的表达水平较正常对照组升高,差异有统计学意义(P=0.0051);IL-21R在CD8+T细胞上表达水平较正常对照组也有所升高,差异有统计学意义(P=0.0213)(见图4)。
2.4 小鼠肝组织IL-21及STAT3 mRNA相对表达水平RT-PCR检测肝组织内IL-21 mRNA的相对表达水平,结果显示,模型组小鼠肝组织内IL-21 mRNA相对表达水平较正常对照组明显升高,差异有统计学意义(P=0.0357);STAT3 mRNA相对表达水平较正常对照组也明显升高,差异有统计学意义(P=0.0286)(见图5)。

图4 小鼠肝脏CD4+T及CD8+T细胞IL-21R表达 Fig 4 Expression of IL-21R on CD4+T and CD8+T cells of liver in mice
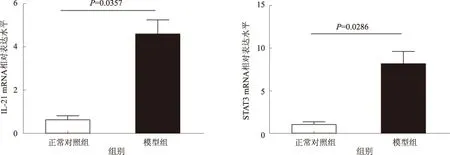
图5 小鼠肝组织IL-21及STAT3 mRNA的相对表达水平 Fig 5 Relative expression levels of IL-21 and STAT3 mRNA in the liver of mice
2.5 小鼠肝组织IL-21及STAT3蛋白水平表达免疫组化检测肝组织IL-21及STAT3的表达,在高倍镜下观察未见明显IL-21及STAT3阳性细胞染色于正常对照组小鼠肝组织中,而模型组小鼠肝脏中有IL-21及STAT3表达,阳性染色部位主要集中在较多淋巴细胞浸润的区域,肝细胞坏死区域及中央静脉周围(见图6)。
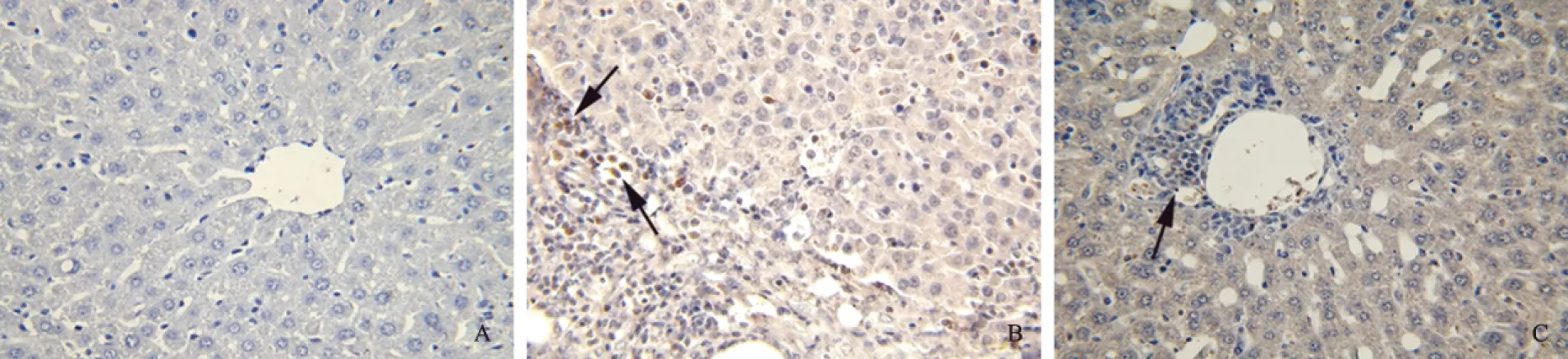
图6 小鼠肝组织IL-21及STAT3蛋白的免疫组化检测(放大400倍) A:正常对照组;B:模型组IL-21;C:模型组STAT3Fig 6 Expressions of IL-21 and STAT3 proteins in the liver of mice A: normal control group; B: IL-21 of EAH group; C: STAT3 of EAH group
3 讨论
CD4+T辅助细胞活化后可分泌细胞因子IL-21,后者属于γ链亚单位细胞因子家族的新成员,IL-21R在诸多免疫细胞(如T细胞、B细胞、NK细胞等)上均有表达。IL-21对于机体的细胞和体液免疫调节也具有一定的作用[6];在一些自身免疫性疾病中如类风湿关节炎、系统性红斑狼疮和原发性干燥综合征等,也发现IL-21与疾病的发生有关[7]。近年有研究发现,IL-21可能是触发或促进炎症反应并导致组织损伤的关键因子,在多种与免疫相关的疾病中可检测出IL-21的高水平表达,并随疾病的控制而表达下降,提示IL-21在炎症的产生和加重、组织病理损伤的介导过程中可能扮演重要角色[8]。STAT蛋白家族属于细胞因子信号蛋白重要的成员,诸多细胞因子如IL-2γc受体家族(IL-2、IL-13、IL-21等)可通过经典信号通路—JAK/STAT将信号传递至细胞内,进而使靶细胞在基因表达水平发生改变;STAT3蛋白是IL-6和IL-21的主要信号传导因子,它与多种自身免疫性疾病的产生和进展密切相关[9]。但目前关于IL-21/STAT3通路在AIH中的报道并不多见,仍有待深入研究。
免疫细胞和细胞因子在AIH肝细胞损伤的过程中起重要作用。研究发现,大量活化的淋巴细胞浸润在AIH患者的肝脏,产生并分泌较多促炎细胞因子,这些激活的淋巴细胞和炎性细胞因子及炎症介质可以破坏肝脏细胞,进而导致肝组织炎症损伤[10]。Th17细胞在促进自身免疫性肝损伤中扮演重要角色,我们前期的研究也发现,Th17细胞比例及IL-17水平在AIH及EAH中表达增加[11]。在本研究中,我们成功地建立了EAH模型,在该模型中,以淋巴细胞为主的炎症细胞浸润至肝脏,肝细胞出现不同程度的坏死,同时也伴随血清转氨酶水平的升高。这种淋巴细胞浸润和肝细胞坏死在肝脏内形成炎症微环境,可能激活某些炎性通路。我们的研究发现,EAH小鼠血清炎性介质IL-6、Th17相关细胞因子IL-21含量明显增加,两者呈正相关,相互促进表达,IL-21又与ALT水平呈正相关,从外周血清学层面上观察到IL-21促进了肝脏的炎症损伤。进而深入体内检测到肝脏的CD4+T及CD8+T细胞上IL-21R表达增加,那么与IL-21相结合发挥作用的空间能力提升;作为IL-6和IL-21的主要信号传导因子STAT3,它与IL-21在mRNA及蛋白水平的表达均明显增强,同时肝组织中出现明显炎性细胞呈散在或局灶性浸润,这种炎症介质及其通路的改变与肝脏病理变化基本相符,提示IL-21/STAT3对肝脏的病理损伤有促进作用。有研究认为,当发生炎症反应并使IL-6分泌增加时,激活了STAT3信号通路,Th17/Treg细胞的前体细胞分化为Th17细胞;Th17细胞又可表达和分泌IL-21,后者与转化生长因子β(TGF-β)结合可通过激活STAT3途径使掌控Th17分化的核心转录因子RORγt(orphan retinoidreceptor)表达增加,这就促进了CD4+T细胞向Th17细胞的分化及IL-17的产生,形成STAT3-Th17-IL-21通路的IL-21自分泌环;当IL-6分泌较少及STAT3信号通路未被活化时,TGF-β可诱导前体细胞分化为Treg细胞[12]。因此,IL-21/STAT3自分泌环在Th17细胞和Treg细胞的分化中也起重要作用,而Th17/Treg细胞失衡也是AIH免疫紊乱的重要特征及发病机制之一。结合以上结果和分析,我们推测在AIH中IL-21/STAT3可形成炎症通路与Th17细胞等发生联系,如促进IL-21和IL-17表达等,从而加重AIH的炎症发展和病理损伤进程。
炎症介质及其通路是免疫及炎症性疾病的热点,IL-21/STAT3通路在AIH的发病进程中具有重要影响和作用,阻断该通路可能成为治疗此类疾病的作用靶点之一。随着对发病机制研究的深入,IL-21/STAT3通路与自身免疫相关疾病的关系将被进一步阐明,也将为研发新的治疗药物和方法提供基础依据。

