高效毛细管电泳测定纳米抗体亲和力
张腾飞,韩雪容,李飞,于建立,宋海鹏
(1.长春理工大学 生命科学技术学院,长春 130022;2.深圳市国创纳米抗体技术有限公司,深圳 518000;3.中国科学院青岛生物能源与过程研究所,青岛 266101)
毛细管电泳(capillary electrophoresis,CE)又常被称为高效毛细管电泳,主要是指在毛细管中,以高压直流电场为驱动实现分离的新型液相分离技术[1]。其主要包括电脑终端控制系统、软件数据分析系统、压力进样检测系统和检测器[2],电泳迁移和电渗流是CE实现分离的主要因素。电泳迁移指在缓冲体系中带电物质电泳速度。电泳迁移率与颗粒所带电荷量成正比,与电泳物质的半径和缓冲液体系浓度成反比。电渗迁移指在毛细管管壁上的硅羟基发生解离,使管壁带有正电离子,使得管壁和缓冲溶液都形成电层,在有电流通过时,带有正电荷的液体会向负极流动,如此就形成了电渗流[2-3]。携带正电离子和电渗流移动方向相同,携带负电离子的移动与之相反,正离子速度快所以最先流出,而负电离子只能依靠电泳速度流出,因此速度较慢。如此,带有正负不同的带电粒子因迁移速率不同,而实现了分离[4]。毛细管电泳容易上手操作,分离效率高,分析速度快,样品损耗少,因此广泛应用于生命科学、细胞生物学等专业领域。
纳米抗体(Nanobody,Nb)由一个重链可变区和两个常规的CH2区与CH3区组成[5]。纳米抗体分子量小,大约10~20 kD之间[4],直径2.5 nm,长4 nm[6]。纳米抗体有非常高的生物活性和亲和力,因此,它和传统抗体在抗原表位在结合上,具有无法比拟的亮点[7-8]。另一方面,纳米抗体在获得上比较容易,可以通过酵母菌上罐发酵的方式,大批量发酵得到[9]。在一定程度上大大减少了抗体制备的科研经费支出,为纳米抗体未来制备进入动物实验和后期的临床奠定了基础[10]。
抗体稳定性重要指标之一就是抗原抗体亲和力。在B淋巴细胞内,受抗原刺激分泌形成抗体。抗原抗体亲和力在一定程度上可以反应出机体对于外界各种有害物质的抵抗能力[11]。纳米抗体抗原的亲和检测以及探究采用毛细管电泳新方法测定亲和力都有重要的意义。
目前,常用的亲和力常数的测定方法,如Biacore检测,平衡透析、竞争结合、硫氰酸盐洗脱法、ELISA和固相放射免疫测定法(SPRIA)等。在日常实验中,Biacore检测和ELISA是较为简易常用的检测方法。此类方法灵敏,客观,是目前国内比较流行的检测方法[12-14]。尚未发现采用高效毛细管电泳的方式测定纳米抗体亲和力的方法,本文旨在采用高效毛细管优势的基础上,对纳米抗体亲和力测定,找到新的测定纳米抗体亲和力的方法。
1 材料与实验
1.1 仪器与试剂
Beckman毛细管电泳仪PA800,32 Karat software色谱工作站(美国Beckman公司);OKD-6501型酸度计(欧克仪表科技有限公司);SPX6201电子天平(美国OHAUS);未涂层石英毛细管(河北永年锐沣色谱器件有限公司);0.22 μm滤膜(天津市津腾实验设备有限公司);BNX-1200超声波清洗器(济南比能信电气有限公司)。
聚乙烯六甲基溴(分析纯,sigma-aldrich)、乙烯基磺酸(分析纯,sigma-aldrich)、氢氧化钠(分析纯,sigma-aldrich)磷酸二氢钠、磷酸一氢钠(分析纯,天津市化学试剂三厂);抗体、抗原(深圳市国创纳米抗体有限公司)。
1.2 溶液的配置
精确量取聚乙烯1.0 g用纯水配成10 ml溶液;精确量取乙烯基磺酸1.0 g用纯水配成100 ml溶液;精确量取氢氧化钠2.0 g用纯水配成50 ml溶液;精确量取磷酸二氢钠4.68 g、磷酸一氢钠16.39 g分别用纯水配成100 ml溶液。使用时,只需将二者按照不同比例混合可得pH6.7~9.1范围的缓冲液。将一定浓度的抗原抗体混合,在37℃条件下孵育30 min,达到一个稳定平衡状态备用,以上溶液配制完成后过0.22 μm滤膜并经过超声除气泡处理,并在4℃储存。
1.3 实验操作
为了提高迁移时间和峰面积的重现性,裸管在使用前需要经过清洗和活化过程。每次在使用仪器前,为保证毛细管管路的通畅,纯水、缓冲液按照活化冲洗顺序各冲洗10 min。
2 结果与讨论
2.1 紫外吸收光谱
将配制好的标准溶液用超纯水稀释到一定的浓度,在波长为200~400 nm的紫外下进行扫描,最后发现标准品在220 nm附近有较强的吸收,并将其作为最佳检测波长。
2.2 电泳操作条件
本实验的石英毛细管为未涂层的裸管,首先必须经过进行活化处理过程,在20 p条件下,按照活化过程,分别用1M Na0H冲洗管道30 min,去离子水冲洗管道15 min,电解质溶液冲洗管道20 min,完成裸管活化过程。实验操作在压力为0.5 psi,电压为25 kV,温度为25℃的条件进行。
2.2.1 缓冲溶液浓度的选择
缓冲盐的浓度直接影响到电泳介质的离子强度,是关系电泳实验成败的关键因素之一。本实验采用pH=7中性的条件下,考察不同浓度缓冲液对和测定效果的影响,结果如图1所示。图中缓冲溶液的浓度分别为:A为30 mM;B为50 mM;C为70 mM;D为100 mM。由图可以看出,在50 mM条件之后,随着缓冲液浓度的增加,迁移时间也在不断延长,这主要是因为随着缓冲液浓度的不断增加,电渗流减小,迁移时间也在不断延长。并且峰形随浓度升高逐渐变宽,峰高而降低,主要由于缓冲液浓度过高,产生了较大的电流,提高了缓冲液体系的温度,使蛋白质稳定性降低,峰形发生变化。在浓度为50 mM的条件下,时间较短且峰形较佳。因此,本文选择最佳的缓冲溶液浓度为50 mM。

图1 缓冲溶液浓度影响变化图
2.2.2 缓冲溶液pH的选择
电渗流和迁移时间都受pH的影响,因此不同样品需要不同的pH电泳条件。本实验是在背景电解质浓度为50 mM条件下,分别考察了缓冲液pH为6、7和8时,分析不同pH条件下对实验结果的影响,结果如图2所示。

图2 缓冲溶液pH影响变化图
图中缓冲溶液的pH值分别为:A的pH值为6、B的pH值为7、C的pH值为8。随着pH的不断增加,迁移时间也在逐渐延长。当pH=8时,峰形逐渐变宽,峰高也明显降低,说明在碱性条件下,结合物的稳定性降低,容易发生解离现象,峰形明显变差。当pH=6时,检测时间太短,两个峰会发生重合,这是因为在酸性条件下抗体带负电,容易和管壁发生吸附,从而无法达到理想的效果。因此,本实验采用pH为7的结果。中性缓冲液条件下,有利于抗原抗体的结合,结合物较多,处于游离态的抗原少。
2.2.3 运行电压的选择
在毛细管检测中,分离电压也是影响电渗流的重要因素之一,因此也将其为优化的目标。本实验在固定浓度为50 mM的条件下,实验分析电压分别为25 V、20 V、15 V时对抗原抗体迁移时间的影响,结果如图3所示。图中的分离电压分别为:A为25 KV、B为20 KV、C为15 KV。在25 KV条件下,由于电压较高,迁移时间较短,抗原抗体分离效果较差。在15 KV条件下,电压较低,明显可以观察到分析的时间延长。时间的增加,使样品管壁吸附的可能性增加。分析时间的延长,同样会使缓冲液温度和pH发生变化,温度较高条件下蛋白质的结构发生变化,稳定性变差,峰形变差。在电压为20 KV时,迁移时间较短,峰形也较窄,清晰可辨。因此,本文选择最佳的电压是20 KV。

图3 缓冲溶液电压影响变化图
2.3 标准曲线及检出限
配置浓度为0.1 nM、0.2 nM、0.3 nM、0.4 nM、0.5 nM的抗原溶液,在最佳缓冲液条件下进行电泳,记录峰面积,绘制标准曲线,如图4所示,曲线方程为y=85 110x+8 375(R2=0.990 3)。

图4 抗原标准曲线
配置浓度为0 nM、2 nM、4 nM、6 nM、8 nM、10 nM的抗体,分别和0.1 nM的抗原等体积混合,过滤震荡进样。结果如图5所示,显而易见,抗体的峰面积在加样抗体浓度的不断增加情况下不断增大,抗原峰面积明显减小。

图5 纳米抗体抗原结合电泳图
将游离抗原峰面积的变化记录备用,根据标准曲线,求得游离抗原浓度。配体分离法公式为:
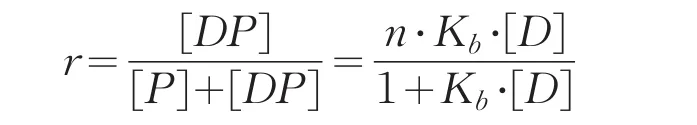
式中,[DP]表示结合物浓度;[P]表示游离蛋白浓度;[D]为游离抗原的浓度;r表示结合物相对于抗体的总量的比例;n为结合位点;Kb为抗原抗体结合常数[15]。求得Scatchard方程式为:

以r/[D]对r作图,绘制抗原抗体Scatchard的结合曲线,如图6,所得曲线方程为y=-4.874 7x+1×109,由斜率的到抗原抗体的结合常数4.87×109M-1。

图6 抗原抗体Scatchard的结合曲线
2.4 亲和力分析(SPR法)
采用成熟的SPR亲和力测试方法在Biacore T100仪器上对上述结果进行验证,检测流程为:
(1)抗原偶联至CM5芯片;
(2)优化样品浓度及再生条件;
(3)设置浓度梯度。
使用Biacore T100仪器自带的模板方法,设置一下参数:浓度梯度/(μg/mL)分别为0,2.5,5,10,20,40,进样时间为60 s,解离时间为600 s;再生条件为:pH1.5的甘氨酸盐酸,30 μL/min,30 s。对高效毛细管电泳测试的亲和力结果进行验证。图7为亲和力测试数据的拟合曲线图,通过仪器自带的拟合方法可得到纳米抗体的亲和力常数为4.512×109M-1。

图7 Biacore测亲和力
3 结论
本实验用Biacore对高效毛细管电泳测纳米抗体进行了亲和力验证,Biacore测得亲和力常数为4.512×109M-1、毛细管电泳测得亲和力常数为4.87×109M-1,相对误差为7.93%,结果相近,说明利用毛细管电泳测定纳米抗体亲和力方法可行。采用毛细管电泳方法分析纳米抗体抗原亲和力具有两点优势。
(1)时间周期较短,毛细管测定样品周期大约为5~10 min左右,同样的样品,采用Biacore T100仪器测定亲和力时间大约为2.5 h。
(2)样品损耗少,节约成本。毛细管由于自身管道较窄(75 μm×65 cm),测定较短时间短,这使得毛细管在测定亲和力时样品用量较少,样品损耗在20 μL/次左右;Biacore在测定时样品损耗为300 μL/次左右,由于抗原抗体价格昂贵,较低的使用量会减少费用,控制试验成本。
综上所述,毛细管电泳测定纳米抗体亲和力,在较短的时间和较少的成本下,与实验室常用精准的Biacore测定结果相近,为纳米抗体测定亲和力提供新的研究方法。

