SWI及1H-MRS在鉴别WHO II~IV级脑胶质瘤中的应用
杜常月,苗娜,齐旭红,温智勇
首都医科大学电力教学医院 放射科,北京 100073
引言
胶质瘤占所有原发性脑肿瘤的27.5%左右,同时占所有恶性原发脑肿瘤的80%[1]。因为磁共振增强扫描对胶质瘤分级的准确评估有一定的局限性[2],所以,本研究探讨另外两种序列扫描。
磁敏感加权成像技术(Susceptibility Weighted Imaging,SWI)是一种功能成像,可以通过显示脱氧血红蛋白,进而显示微小血管和微出血,用于评价肿瘤内血管的发生及出血情况[3]。肿瘤生长过程中伴随着血管的生长,因而理论上,SWI 对脑胶质瘤的鉴别有一定的价值。同时,也有研究表明,SWI 半定量评估肿瘤内敏感性信号(Intratumoral Susceptibility Signal,ITSS)强度对胶质瘤分级有重要的临床意义[4]。
磁 共 振 氢 质 子 波 谱(1H Magnetic Resonance Spectroscopy,1H-MRS)是一种可以反映细胞代谢的功能成像。通过量化光谱中的胆碱(Cho)、肌酸(Cr)、N-乙酰天冬氨酸(NAA)、脂质(Lip)和乳酸(Lac)等物质来反映细胞代谢物的改变[5],进而推测肿瘤的发生、发展过程。目前,1H-MRS 已经用于研究许多神经疾病的代谢变化,如脑肿瘤、癫痫、放射性损伤等[6]。
由于II、III、IV 级胶质瘤在临床表现、遗传学特征和临床管理等方面有显著差异[7],所以,针对胶质瘤各级之间的鉴别有很大的研究价值。本研究采用3.0T 磁共振扫描仪,进一步探讨SWI 及1H-MRS 两种技术对鉴别各级胶质瘤的诊断价值。
1 材料与方法
1.1 病例资料
本研究为前瞻性研究。选取2016 年4 月至2018 年3月期间到我院就诊,并经术后病理证实的脑胶质瘤患者81例。按照WHO 分级方法将上述患者分为3 组:II 级共30例,男性18 例,女性12 例,平均年龄(41.0±12.5)岁;III 级共13 例,男性6 例,女性7 例,平均年龄(43.2±12.7)岁;IV 级共38 例,男性21 例,女性17 例,平均年龄(53.5±10.9)岁。所有患者均未接受过任何放化疗,于术前完成了头颅MRI 平扫、SWI 和1H-MRS 序列扫描以及头颅MRI 增强扫描,所得图像清晰,其中运动伪影太重、波谱曲线失真的病例未纳入其中。
1.2 仪器与方法
采用GE Discovery 750W 3.0T MR 扫描仪及24 通道头颅表面线圈进行成像。扫描序列包括:① 头颅MRI平扫:轴位T1WI(TR 2087.4 ms,TE 24.0 ms),轴位T2WI(TR 5281.0 ms,TE 104.0 ms),轴位T2 FLAIR(TR 9000.0 ms,TE 95.0 ms),视野 24 cm×24 cm,层厚5.0 mm,层间距1.5 mm;② SWI 采用Ax SWAN 序列(TR 38.3 ms,TE 22.9 ms),FA 15°,视野 24 cm×21.6 cm,矩阵352×288,层厚2.0 mm,无层间距,NEX 0.69;③ 二维多体素1H-MRS检查:采用点分辨波谱(PRESS)技术(TR 1000 ms,TE 144 ms,NEX 1 次,扫描时间5′28″),选取肿瘤实质区最大层面进行定位,并涵盖肿瘤实质区、瘤周区及健侧脑组织区,定位时尽量避开了骨骼、脂肪、含气结构等,尽量避免影响结果;④ 头颅T1WI 序列的增强扫描(轴位、矢状位及冠状位)。
1.3 数据分析
将图像载入GE ADW 4.6 工作站,进行后处理重建,分别计数和测量肿瘤实质区的ITSS 评分值和1H-MRS 参数值(图1~3)。

图1 WHO II级胶质瘤图像

图2 WHO III级胶质瘤图像

图3 WHO IV级胶质瘤图像
通过后处理,获得SWI 的SWI MinIP 图和相位图。在SWI MinIP 图上对肿瘤内可见的低信号线性或点状的易感性病灶进行计数评分。ITSS 评分的程度分为以下几个等级[4]:0 分为没有ITSS;1 分为1~5 个点状或细线性ITSS;2 分为6~10 个点状或细线性的ITSS;3 分为11 个或更多的点状或细线性的ITSS。由于钙化在校正的相位图上表现为高信号,而微血管和微出血表现为低信号,故可以利用校正的相位图剔除钙化。
经过后处理,获得1H-MRS 代谢物与解剖图的叠加图、代谢物比率图和分布图。在定位图上,于肿瘤最大层面,选取实性部分和健侧脑组织区分别放置1~3 个感兴趣区(Region of Interest,ROI)进行测量,ROI 的大小约为56 mm2。记录病灶区的Cho、Cr、NAA、Cho/Cr、Cho/NAA 以及NAA/Cr 值,并分别计算其与健侧脑组织区代谢物的比值(相对参考值),即r Cho、r Cr、r NAA、r Cho/Cr、r Cho/NAA以及r NAA/Cr;每组数据取平均值以减少误差。
为进一步减少误差,所有数据均由三位医师重复测量取平均值得出。
1.4 统计学分析
应用SPSS 24.0 统计软件包进行分析,ITSS 采用非参数 Mann-Whitney U 检验,对1H-MRS 参数值采用单因素方差ANOVA 分析进行组间比较,表示差异有统计学意义。利用受试者工作特性(Receiver Operator Characteristic,ROC)曲线评估两种技术对胶质瘤分级的诊断效能。
2 结果
经过统计学分析,1H-MRS 各参数的统计分析均值及P值,见表1。ITSS 值在不同级别胶质瘤中的分布情况,见表2。利用ROC 曲线分析SWI 及1H-MRS,得到曲线下面积(AUC),根据Youden 指数最大,确定敏感性和特异性(表3 和图4)。
表1 1H-MRS各参数值统计结果表
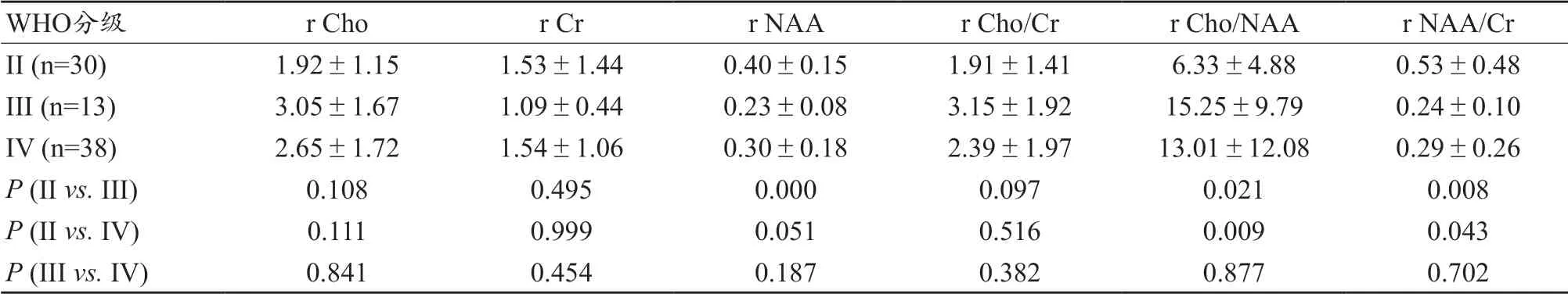
表1 1H-MRS各参数值统计结果表
WHO分级 r Cho r Cr r NAA r Cho/Cr r Cho/NAA r NAA/Cr II (n=30) 1.92±1.15 1.53±1.44 0.40±0.15 1.91±1.41 6.33±4.88 0.53±0.48 III (n=13) 3.05±1.67 1.09±0.44 0.23±0.08 3.15±1.92 15.25±9.79 0.24±0.10 IV (n=38) 2.65±1.72 1.54±1.06 0.30±0.18 2.39±1.97 13.01±12.08 0.29±0.26 P (II vs. III) 0.108 0.495 0.000 0.097 0.021 0.008 P (II vs. IV) 0.111 0.999 0.051 0.516 0.009 0.043 P (III vs. IV) 0.841 0.454 0.187 0.382 0.877 0.702

表2 胶质瘤的ITSS值分布表(例)
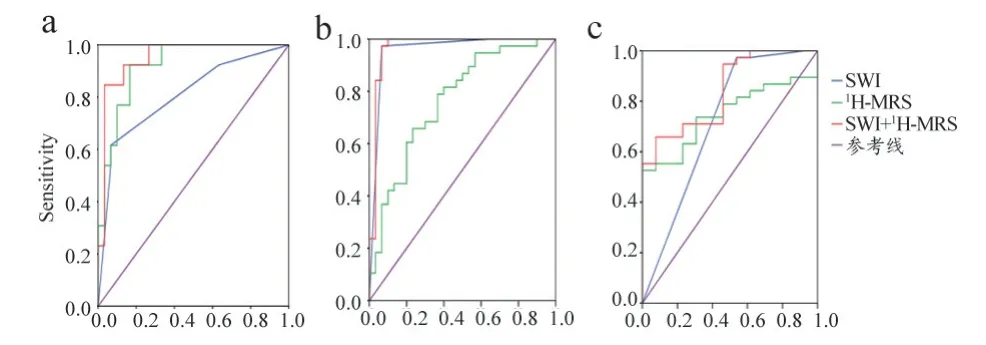
图4 ROC曲线
3 讨论
SWI 采用高分辨率、三维完全流动补偿的梯度回波序列进行扫描,经过后处理将幅值图和相位图融合,形成图像对比[8]。脱氧血红蛋白及出血的代谢产物由于快速自旋回波失相位,导致信号缺失,在SWI 图像上表现为显著的低信号[9]。
1H-MRS 作为诊断胶质瘤的补充工具[10],可以反映不同级别胶质瘤中代谢物的改变。其中胆碱(Cho)是反映细胞膜的标记,肌酸(Cr)是能量代谢的标志物,N-乙酰天冬氨酸(NAA)是神经元状态和完整性的标记。通过反映胶质细胞的神经元功能障碍、神经元丢失和反应性神经胶质增生[11],进而推测肿瘤的病理类型。
本研究数据显示:ITSS 值在区分II 级与III 级、II 级与IV 级以及III 级与IV 级中均有意义(),表现为级别越高,ITSS 评分值越高。这提示胶质瘤级别越高,瘤内新生血管越丰富、越容易出血。分析原因可能是:① 肿瘤新生血管大多是不成熟的血管,通透性比较高且缺乏淋巴管回流,导致肿瘤血管内血液黏滞度、血流阻力明显增加[12]。所以血液停留时间过长,导致脱氧血红蛋白的产生,SWI 表现为低信号;② 胶质瘤级别越高,瘤内微小血管的病变可能越显著;③ 随肿瘤级别增高,瘤血管的生长供不应求。所以,瘤细胞分泌大量的血管内皮生长因子,极大地促进内皮细胞的增殖和血管形成[13],且由于缺氧容易导致血管内脱氧血红蛋白增多及出血,所以SWI 低信号越多,形成恶性循环。
1H-MRS 参数r NAA 在鉴别II 级与III 级有统计学意义(),r Cho/NAA、r NAA/Cr 在鉴别II 级与III 级、II 级与IV 级中有统计学意义(),表现为肿瘤级别越高,NAA 含量相对越少。这与以往的研究部分类似[14-15]。NAA 含量低,表明正常神经元受侵犯,原因可能是随胶质瘤级别增高,侵袭性随之明显,肿瘤细胞侵犯正常神经元结构。有研究表明,Cr 相对恒定,且不受病理改变的影响,通常用作计算代谢物水平的内部参考[16],本研究结果Cr 变化不显著,进一步支持了这一观点。同时,本研究中r Cho值也无统计学意义,分析原因可能是,不同级别胶质瘤虽然瘤细胞增殖不同,但是总体的膜数量或面积差别不大。
另外,有研究显示,Cho/NAA、NAA/Cr 可用于胶质瘤分级,而Cho/Cr 无分级价值[17]。也有文献报道,高、低级别胶质瘤之间的NAA/Cho、NAA/Cr、Cho/Cr 均有统计学差异[18]。而本研究中,r Cho/Cr 在胶质瘤分级中无意义,与前者结果类似。这至少说明,Cho/Cr 相关参数在胶质瘤分级中是不稳定的。分析其原因,可能是各级胶质瘤中Cho 及Cr 变化不显著,导致Cho/Cr 相关参数相对不准确。而在肿瘤生长活跃区NAA 破坏是明显的[19],所以NAA 相关参数(包括r NAA、r Cho/NAA、r NAA/Cr)对胶质瘤的分级意义更大。通过对1H-MRS 各个参数分别进行ROC曲线分析,发现r NAA 在鉴别II 级与III 级、II 级与IV 级中的AUC 值也最大(分别为0.828 和0.697),进一步证实了这一推论。
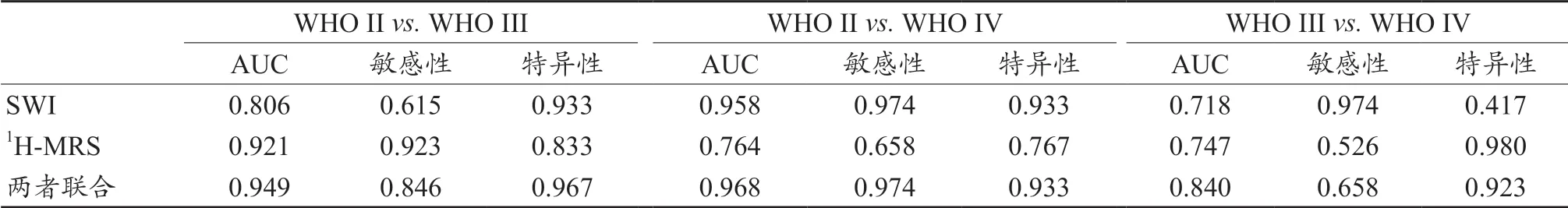
表3 各参数的AUC值、敏感性和特异性
SWI 在鉴别II 级与IV 级中AUC 值最大(0.958),敏感性和特异性分别为97.4%、93.3%。1H-MRS 在鉴别II 级与III 级中AUC 值最大(0.921),敏感性和特异性分别为92.3%、83.3%。在鉴别III 级和IV 级的差别中,仅SWI 有统计学意义,而且两种技术的AUC、敏感性和特异性均相对比较低。分析原因可能是,III 级和IV 级同属于高级别胶质瘤,在代谢改变的情况上,二者差异不够显著。而在血管生成程度方面虽然有差异,但是敏感性和特异性不如鉴别II 级与IV 级、II 级与III 级。此外,综合两种技术获得的AUC 值,在各组中均为最大,敏感性和特异性也较高,尤其对II 级和IV 级的鉴别更为显著。
综上,1H-MRS 仅对鉴别II 级和III 级、II 级和IV 级有临床意义,SWI 对鉴别各级胶质瘤都有临床意义;并且SWI 的AUC、敏感性和特异性相对较高。联合两种技术,具有最高的敏感性和特异性,有更高的临床价值。
本研究的局限性:本研究主要探讨肿瘤实质内1H-MRS及SWI 的信息,所以并未涉及瘤周水肿区的生化信息;后续的研究将进一步对瘤周区域展开探讨。

