内皮祖细胞CXC趋化因子受体7对脑缺血再灌注后血管新生的作用
范加维,杨拯,王近吴,范道贵,蒋仕秋,曾江华,易红梅,戴小珍,刘海荣
1.成都医学院基础医学院,四川成都市 610500;2.成都医学院生物科学与技术学院,四川成都市 610500;3.成都医学院第一附属医院,四川成都市 610500;4.遂宁市第一人民医院,四川遂宁市629000
脑卒中是全球导致死亡和残疾的大血管疾病之一。缺血性脑卒中是最常见的脑卒中类型[1]。干细胞治疗已成为治疗缺血性损伤的主要策略之一[2]。内皮祖细胞(endothelial progenitor cells,EPCs)是一种形成新生血管的前体细胞,能定向分化为内皮细胞[3-4]。组织缺血或内皮损伤后,EPCs 从骨髓动员到外周循环[5-6],归巢到血管损伤部位,促进新血管形成和内皮损伤修复[7]。外周血中EPCs数量是内皮功能和心血管疾病风险的标志之一[8-9],在高胆固醇血症、高血压、糖尿病患者和吸烟者的外周血中,EPCs 数量明显减少[9]。心血管疾病患者常伴随高脂、高糖血症[10-11],导致外周血EPCs 数量明显减少。外源性EPCs 移植是治疗心脑缺血损伤的重要策略之一。EPCs 移植能缩小脑梗死体积,减轻血管内皮细胞损伤,改善神经功能[12-13]。EPCs 移植也存在许多问题,如移植后EPCs靶向归巢到缺血组织的能力较差,存活能力低,导致EPCs利用率低,限制了EPCs的临床应用。
基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)也称CXCL12,是在中枢神经系统广泛表达的趋化因子[14]。CXCL12 与其受体趋化因子受体(CXCchemokine receptor,CXCR)4、CXCR7相互作用,在脑缺血损伤修复中发挥重要作用[15-17]。Li等[17]发现,CXCL12 基因治疗可显著改善脑缺血所致白质损伤,促进少突胶质祖细胞向小鼠脑缺血部位迁移,并发现CXCL12/CXCR4的作用主要是促进少突胶质祖细胞的增殖和迁移,而CXCL12/CXCR7 的主要作用是促进少突胶质细胞的成熟。我们前期研究发现[7,18],EPCs同时表达CXCR4 和CXCR7 两种受体,两种受体的作用不尽相同。糖尿病小鼠骨髓来源的EPCs 中,CXCR7 表达明显下调;上调CXCR7 表达能明显改善糖尿病下肢缺血[7]。
难以获得大量自体EPCs 是EPCs 治疗缺血性疾病临床应用面临的主要困难之一。人脐带血和脐带组织可成为EPCs 来源[19-20];脐带血和脐带来源的EPCs 免疫源性较低,异种移植也不会引起免疫排斥反应,能有效改善缺血组织的血管新生[19,21]。我们前期研究发现,CXCR7 在脐带血来源EPCs 的存活中扮演重要角色,抑制CXCR7 活性将显著增加EPCs 凋亡。本研究探讨上调CXCR7 表达对脐带血来源EPCs 的存活和血管新生的影响,为脐带血EPCs 治疗缺血性疾病提供更好策略。
1 材料与方法
1.1 材料
1.1.1 主要仪器和设备
细胞培养箱、低温高速离心机、冰冻切片机:美国THERMO 公司。流式细胞仪:美国BD 公司。酶标仪:美国BIOTEK 公司。化学发光仪、梯度PCR 仪、实时定量PCR (real time-PCR,RT-PCR)仪:美国BIORAD 公司。倒置荧光显微镜:日本NIKON 公司。正置荧光显微镜:德国LEIKA公司。低速多管自动平衡离心机:安徽中科中佳科学仪器公司。
1.1.2 主要试剂
人淋巴细胞分离液Histopaque 1077、人纤维连接蛋白、氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)、SDF-1、FITC-UEA-1:日本SIGMA 公司。EBM-2:美国LONZA 公司。胎牛血清、胰酶:美国GIBCO公司。血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)、CD133、CD31抗体:美国CELL SIGNALING TECHNOLOGY 公司。CXCR7:美国ABCAM 公司。Dil-标记的乙酰化低密度脂蛋白(Dil-Ac-LDL):美国BIOMEDICAL TECHNOLOGIES 公司。化学发光底物:美国MILLIPORE 公 司。iScript cDNA Synthesis Kit、SsoAdvanced Universal SYBR Green Supermix:美国BIO-RAD 公司。基质胶:美国BD 公司。兔抗Actin、山羊抗兔IgG:北京博奥森生物技术有限公司。Cy3标记山羊抗兔IgG(H+L)、Alexa Fluor 488标记山羊抗小鼠IgG (H+L)、DAPI、BCA 蛋白浓度测定试剂盒:上海碧云天生物技术有限公司。总RNA 提取试剂盒、高效RIPA 组织细胞快速裂解液:北京索莱宝科技有限公司。Annexin v-FITC/PI 细胞凋亡试剂盒:江苏凯基生物技术股份有限公司。pLVX-EGFP-3FLAG-Puro载体:上海升博生物技术有限公司。CXCR7、GAPDH 引物:上海生工生物有限公司。水合氯醛:成都市科龙化工试剂厂。氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC):斯百全化学上海有限公司。
1.2 方法
1.2.1 EPCs的分离和培养
采取人脐带血20 ml,PBS 等体积稀释;贴壁缓慢加入盛有等体积Histopaque 1077 的上层,室温2000 r/min 离心20 min 后,管内液体分为4 层;取中间白膜层细胞,PBS 重悬洗涤2 次,1200 r/min 离心10 min。用添加含多种生长因子的SingleQuots 并加入含10%胎牛血清的内皮细胞基础培养基EGM-2MV 重悬,将细胞接种于预先用人纤维连接蛋白包被的6 孔板中,37 ℃、5% CO2、饱和湿度培养箱内培养。观察细胞形态并拍照。待细胞长到80%~90%融合,传代培养[7,22]。
1.2.2 EPCs的鉴定
1.2.2.1 Dil-ac-LDL摄取和FITC-UEA-1结合实验
取培养14 d 的细胞,吸弃细胞板内培养液,PBS轻轻洗涤3 次,去除未贴壁细胞。每孔加入10 µg/ml Dil-ac-LDL 200 μl,37 ℃、5%CO2、饱和湿度恒温孵育4 h;吸弃细胞板中液体,用PBS轻轻洗涤3次,每次5 min;预冷的4%多聚甲醛固定10 min;弃固定液,PBS 洗2 次,每次5 min;加入10 µg/ml FITCUEA-1 200 μl,孵育1 h 后,弃液体;PBS 轻轻洗涤3次,每次5 min;50%缓冲甘油封片,荧光显微镜下拍照观察[7]。
1.2.2.2 表面标志物
取培养14 d 细胞,PBS 洗涤,胰酶消化,离心,收集细胞;弃上清,细胞计数,5×104/孔接种至24 孔板。细胞贴壁稳定生长后,PBS洗涤2次,PBS 500 μl中分别加入VEGFR2 和CD133单克隆抗体10 μl,混匀后加入24 孔板中,37 ℃孵育60 min;PBS 洗涤3 次。PBS 500 μl 中分别加入Cy3 和Alexa Fluor 488 荧光二抗5 μl,37 ℃孵育60 min;PBS 洗涤3 次,DAPI 复染;PBS 洗涤3 次,50%缓冲甘油封片,荧光显微镜下拍照观察。
1.2.3 慢病毒载体的构建及转染
利用基因重组技术,将人源CXCR7 基因克隆到pLVX-EGFP-3FLAG-Puro 载体,构建CXCR7 过表达载体(pLVX-CXCR7-EGFP-3FLAG-Puro);采用慢病毒包装体系,将三质粒系统(pLVX-CXCR7-EGFP-3FLAG-Puro 1.5 μg、pCMV-dR8.9 0.5 μg、pCMVVSV-G 1 μg)共转染至293T 细胞中,包装成慢病毒颗粒。转染36~48 h 后,收集培养液上清,超速离心法浓缩和纯化,检测病毒滴度。
取第4 代EPCs,5×104/孔接种到24 孔板,次日用于病毒感染。细胞分为正常C 组(不感染病毒)、对照C 组(感染pLVX-EGFP-3FLAG-Puro 病毒)和感染C 组(感染pLVX-CXCR7-EGFP-3FLAG-Puro 病毒)。按照MOI=50 加入相应病毒颗粒孵育24 h,更换新鲜培养基。感染72 h后,倒置荧光显微镜观察GFP表达,将感染率70%以上的细胞用于后续实验。
1.2.4 CXCR7在EPCs中的表达
1.2.4.1 RT-PCR
转染72 h 后,收集正常C 组、对照C 组和感染C组EPCs各1×106个,按说明书提取总RNA,采用反转录试剂盒合成cDNA,以cDNA 为模版,RT-PCR 检测各组细胞中CXCR7 mRNA 表达水平(以GAPDH 为内参),目的基因表达水平用2-ΔΔCt表示。
CXCR7 上游引物序列5'-CGC CTC AGA ACG ATG GAT C-3',下游引物序列5'-AAC AAG TAA ACC CGT CCC AGA-3'。GAPDH 上游引物序列5'-CAG GAG GCA TTG CTG ATG AT-3',下游引物序列5'-GAA GGC TGG GGC TCA TTT-3'。
1.2.4.2 Western blotting
转染72 h后,各组加裂解液抽提蛋白,BCA法蛋白定量。每个样品取蛋白20 µg,转膜、封闭,加CXCR7一抗(1∶200)4 ℃孵育过夜;洗膜,加二抗(1∶1000),37 ℃孵育60 min;洗膜,ECL 试剂盒曝光显色,Image J 软件分析各条带灰度值,以β-actin 为内参计算相对灰度。
1.2.5 基质胶成管试验
将基质胶用不含生长因子的基础培养基1∶1 稀释,100 µl/孔包被48 孔板。4×104/孔分别接种对照C组和感染C 组EPC,每种细胞各分3 组:空白组不添加其他试剂,ox-LDL 组加ox-LDL 50 µg/ml,处理组加ox-LDL 50 µg/ml 和SDF-1 50 µg/ml。37 ℃、5%CO2条件下培养6 h,显微镜下观察管样结构形成并拍照。Image J软件计算管样结构长度[7]。
1.2.6 Annexin v-FITC/PI染色
对照C 组和感染C 组EPCs 分别接种于6 孔板中,每孔1×105个细胞。细胞贴壁后,同前法分为3 组。24 h 后,PBS 洗去未贴壁细胞,不含EDTA 0.25%胰蛋白酶消化收集细胞。根据Annexin v-FITC/PI细胞凋亡试剂盒说明书染色,流式细胞仪检测AnnexinV+/PI-细胞(早期凋亡细胞)[7]。
1.3 脑缺血再灌注损伤模型的制备
成年Sprague-Dawley 大鼠36 只,体质量(220±20)g,由四川省医学科学院/四川省人民医院实验动物研究所提供,许可证号SCXK(川)2013-15。Longa 线栓法制备大鼠右侧脑缺血再灌注损伤模型[23]。
1.4 神经功能评分
再灌注24 h 后,采用Longa 评分标准对大鼠进行神经功能评分。0分,无神经损伤症状;1分,不能完全伸展对侧前爪;2 分,向对侧转圈,损伤侧出现Horner综合征;3分,向对侧倾倒;4分,不能自发行走,丧失意识;5 分,死亡。0、4、5 分的大鼠舍弃,并补充大鼠[23-24]。于再灌注后7 d和14 d再次评分。
1.5 细胞移植
再灌注24 h 后,造模成功的大鼠等分为PBS 组(n=12)、对照组(n=12)和移植组(n=12)。对照C 组和感染C 组EPCs 重悬于PBS 溶液中,对照组和移植组大鼠尾静脉输注对照C 组和感染C 组EPCs 2×106个,体积1 ml,PBS组输注等体积PBS。
1.6 脑梗死体积检测
再灌注后14 d,各组取6 只大鼠麻醉,迅速取出脑组织,-20 ℃速冻,均匀切开,2%TTC 37 ℃染色20 min,Image J计算梗死体积[24]。
1.7 GFP阳性细胞计数
其余6 只大鼠取脑组织包埋于OCT 中,制作冰冻切片。各组取一套切片正置荧光显微镜下拍照观察,计算GFP阳性EPCs数。
1.8 免疫荧光染色
各组另取一套冰冻切片,PBS浸洗3次,4%多聚甲醛固定20 min,PBS 浸洗,山羊血清室温封闭30 min;加CD31一抗(1∶200) 4 ℃孵育过夜;PBS 浸洗,加荧光标记二抗(1∶500) 37 ℃孵育1 h;PBS 浸洗,含抗荧光淬灭剂的封片液封片,荧光显微镜下观察,计数区域中毛细血管数。
1.9 统计学分析
采用Origin 7.5 完成实验数据分析和作图。结果以()表示,各组间比较采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 EPCs的分离培养及鉴定
细胞培养3 d,出现典型的克隆集落样结构;7 d时集落样结构逐渐消失,大部分细胞铺展,呈“铺路石”样结构(图1)。
细胞培养14 d 时,与Dil-ac-LDL、FITC-UEA-1孵育,在荧光显微镜下观察可见红色和绿色荧光(图2),并表达EPCs 表面标志物VEGFR2 和CD133(图3)。既能摄取Dil-ac-LDL 又能结合FITC-UEA-1 的棕黄色双荧光细胞,VEGFR2和CD133双阳性细胞定义为分化期EPCs。
2.2 EPCs中CXCR7的表达
转染72 h 后,感染C 组见大量GFP 阳性细胞(图4),感染率达70%以上;GFP 蛋白主要分布在细胞膜周边。
Western-blotting 和RT-PCR 均显示,感染C 组CXCR7 蛋白和mRNA 表达量明显高于正常C 组和对照C组(P<0.01),后两组间无显著性差异(P>0.05)。见表1、表2。

图1 不同时间EPCs形态变化(倒置显微镜,×100)

图2 Dil-ac-LDL摄取和FITC-UEA-1结合实验(×200)
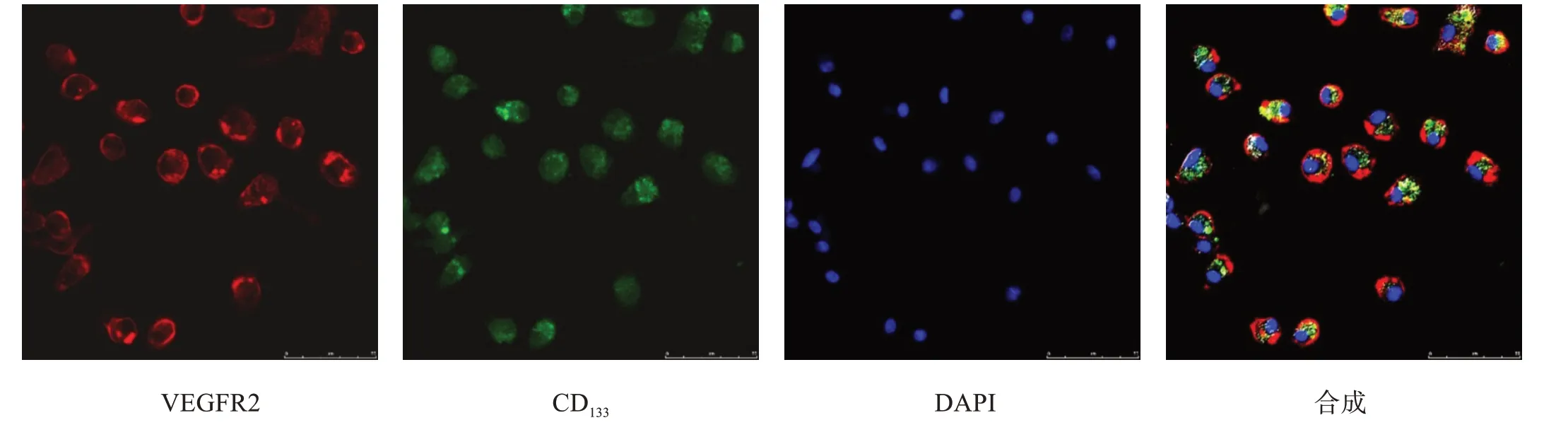
图3 细胞表面标志物VEGFR2和CD133(免疫荧光染色,×400)

图4 对照C组和感染C组CXCR7表达(倒置荧光显微镜,×100)

表1 各组CXCR7蛋白表达(/β-actin)
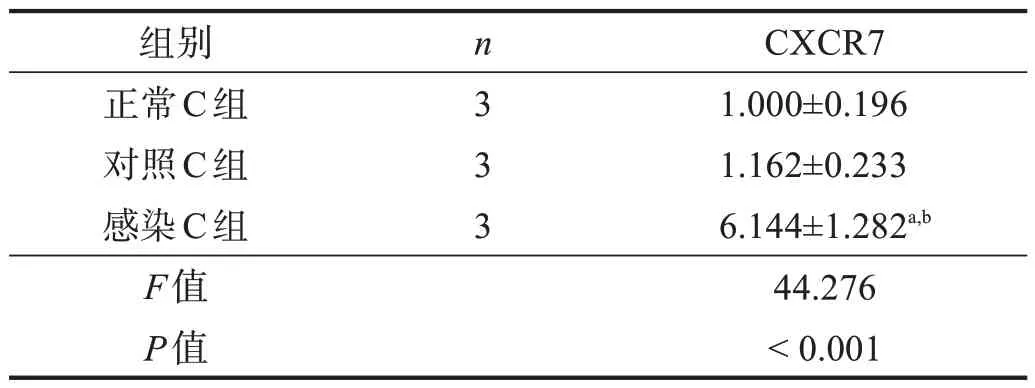
表2 各组CXCR7 mRNA的表达(2-ΔΔCt)
2.3 基质胶成管试验和Annexin v-FITC/PI染色
与各自空白组相比,各组ox-LDL 组管样结构相对长度均明显下降(P<0.01);感染-处理组管样结构相对长度较对照-处理组显著延长(P<0.001)。见图5、表3。
与各自空白组相比,各组ox-LDL 组EPCs 凋亡率明显增加(P<0.01);感染组显著低于对照组(P<0.001)。见图6、表4。
2.4 脑缺血后神经功能恢复和微血管新生
再灌注后7 d,移植组大鼠Longa评分低于对照组和PBS 组(P<0.05);再灌注后14 d,对照组Longa 评分低于PBS 组(P<0.05),移植组低于对照组(P<0.05)。见表5。
再灌注后14 d,对照组脑梗死体积低于PBS 组(P<0.05),移植组低于对照组(P<0.05)。见图7、表6。
移植组GFP阳性细胞数高于对照组(P<0.05),毛细血管数高于对照组(P<0.05)。见图8、图9、表7。
3 讨论
本研究显示,EPCs 转染CXCR7 后,可显著增强EPCs 在ox-LDL 作用下管样结构形成能力和抗凋亡能力;移植转染CXCR7的EPCs,可促进EPCs归巢至缺血部位,并促进缺血组织微血管新生。这在一定程度上解决了移植后EPCs 靶向归巢能力差、存活能力低和利用率低的难题,为干细胞治疗缺血性疾病提供了新的方法。
EPCs 是一种新生血管形成的前体细胞,能定向分化为内皮细胞,主要存在于骨髓、外周血和脐带血中,EPCs 介导的血管新生是治疗缺血性疾病的重要策略之一[22,25-27]。由于外周血中EPCs 含量较低,骨髓采集量少,脐带血成为获取EPCs 的主要来源。前期研究发现[22],移植人脐带血来源的单核细胞到大鼠心肌组织,未出现移植排斥反应。本研究移植人脐带血来源的EPCs至大鼠体内,也未出现移植排斥反应。
脑中卒患者常伴有高血脂血症,导致外源性EPCs 存活能力较低,归巢到缺血部位能力差。SDF-1通过与其受体CXCR4 和CXCR7 结合,在EPCs 的存活、动员和归巢中发挥重要作用;在应激状态下,CXCR7 起主导作用[7]。本研究采用ox-LDL 模拟体内高脂血症环境,发现上调EPCs 中CXCR7 表达能抑制ox-LDL 对EPCs 的损伤,与我们前期研究结果一致[7]。本研究还显示,移植转染CXCR7 的EPC 能改善大鼠神经功能,增加缺血部位EPCs数量和毛细血管密度。
Qiu 等[28]发现,骨髓源性EPCs 移植可以减轻脑缺血再灌注损伤,与EPCs 的抗氧化和抗凋亡能力有关。Bai 等[29]发现,EPCs 治疗可增加缺血脑组织中脑源性神经营养因子的分泌,从而改善神经功能。本研究进一步证实,移植EPCs 能改善大鼠脑缺血再灌注后神经功能,移植转染CXCR7的EPCs效果更显著。
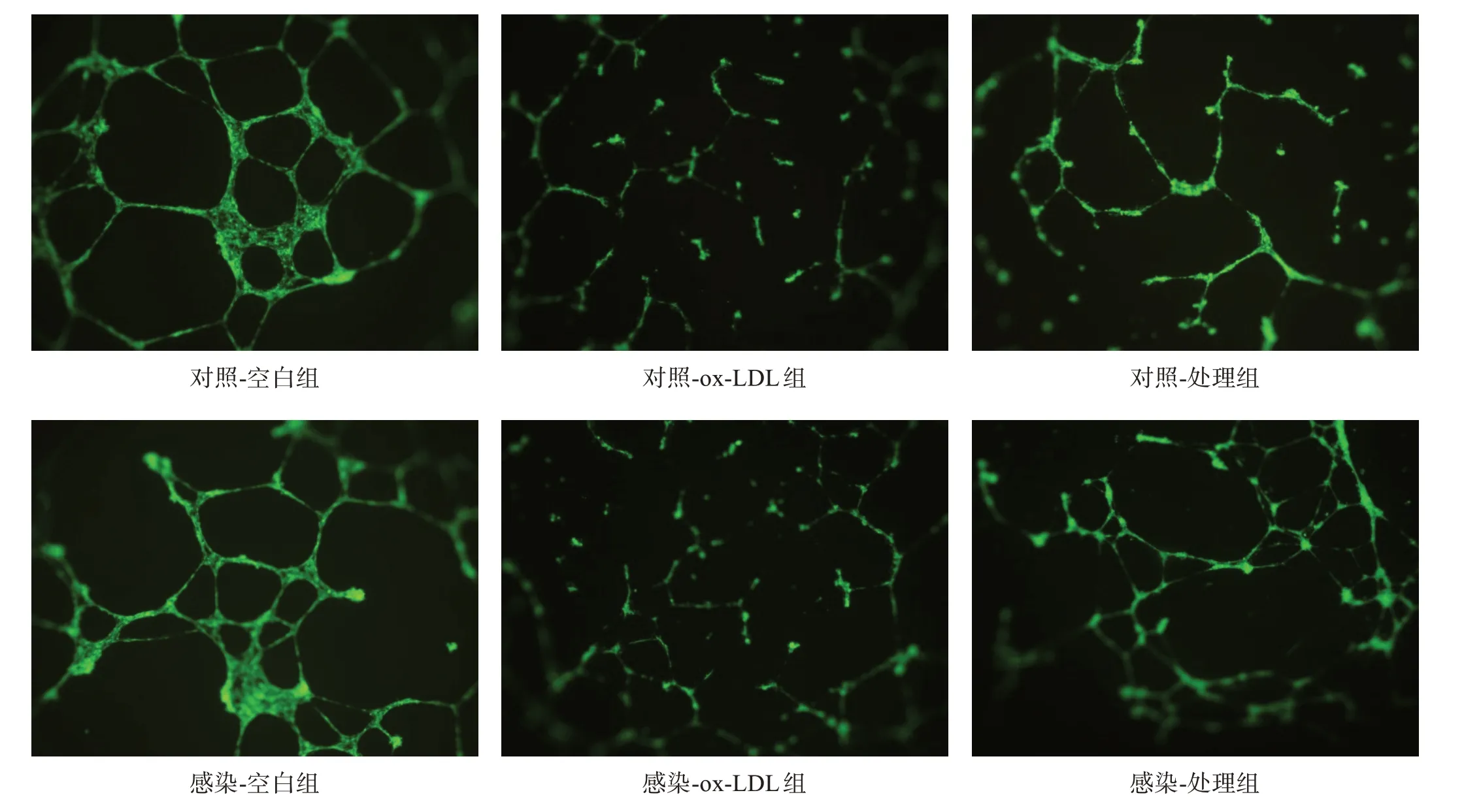
图5 各组管样结构形成实验结果(×100)
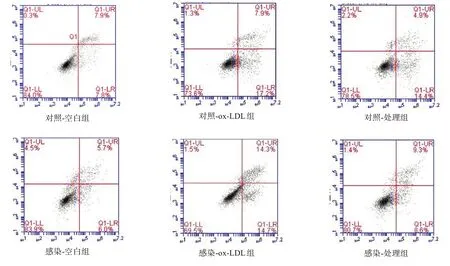
图6 细胞凋亡流式分析结果
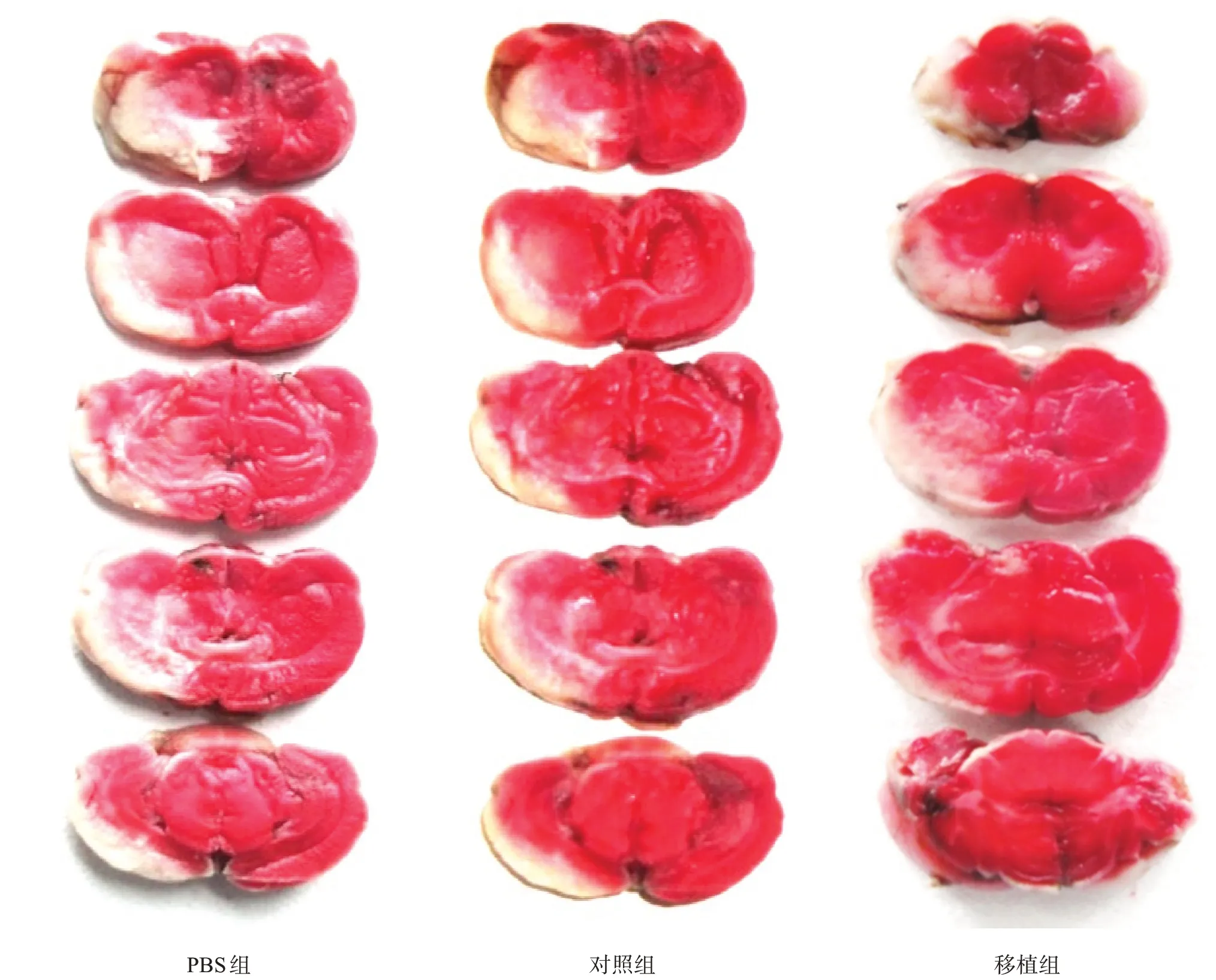
图7 各组脑梗死灶体积(TTC染色)
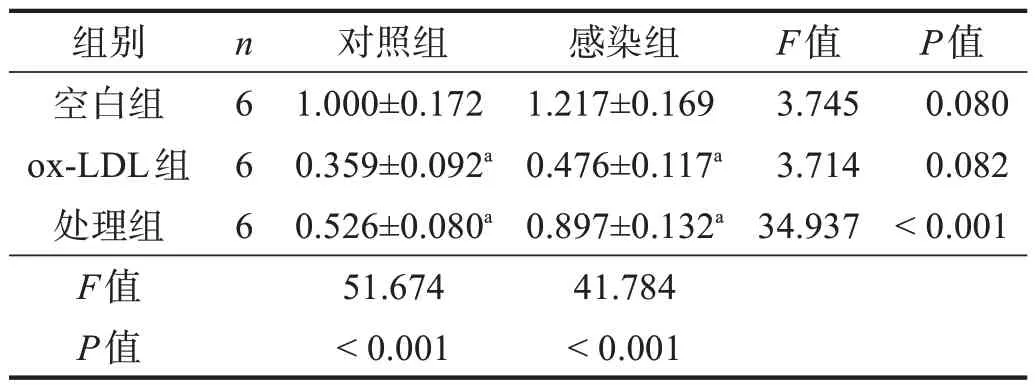
表3 各组细胞管样结构的相对长度(/空白组)
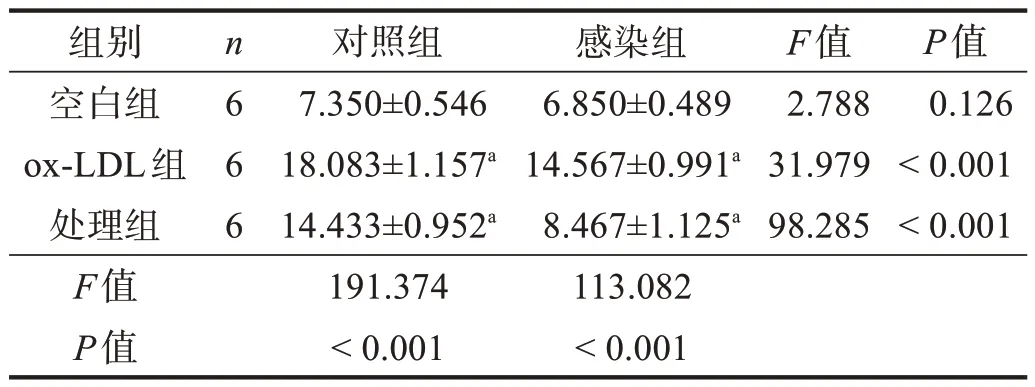
表4 各组细胞凋亡率比较(%)

表5 各组Longa评分的比较

表6 各组脑梗死体积比较(%)

图8 各组GFP阳性细胞分布(正置荧光显微镜,×100)

图9 各组毛细血管分布(免疫荧光染色,×100)
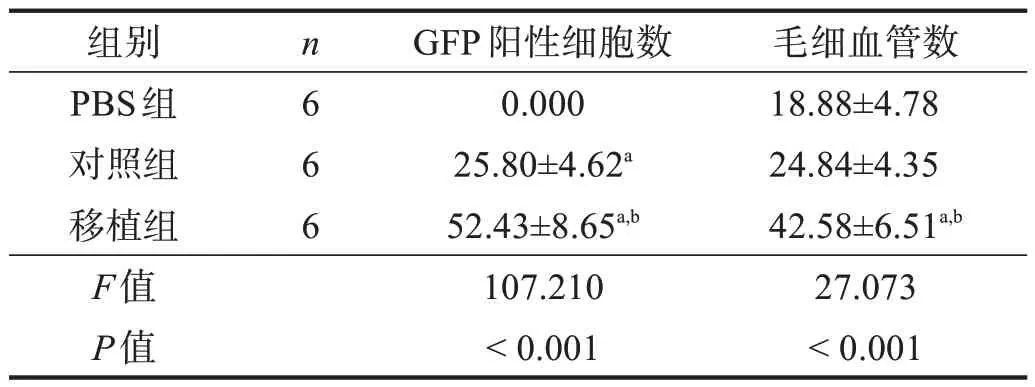
表7 各组GFP阳性和毛细血管数比较
综上所述,上调SDF-1/CXCR7 信号轴明显改善EPCs 在高脂环境下的存活能力,还能有效促进其靶向归巢至缺血组织并促进血管新生,为EPCs 移植治疗缺血性疾病的临床应用提供了新的实验依据。

