肠易激综合征患者肠道菌群特征和NOX1表达的研究*
盛淑婷 魏子白 王云峰 杨长青
长治医学院附属和平医院消化科(046000)
背景:研究表明肠道菌群、烟酰胺腺嘌呤二核苷酸磷酸氧化酶1(NOX1)在慢性内脏痛形成中起有重要作用,但其在肠易激综合征(IBS)中的作用尚不明确。目的:探讨IBS患者肠道黏膜菌群特征与NOX1表达的相关性。方法:收集2017年7月—2017年12月长治医学院附属和平医院收治的符合罗马Ⅳ标准的IBS患者和健康受试者结肠黏膜标本,利用高通量测序方法检测肠道黏膜菌群,并分析菌群物种多样性和丰度。采用免疫组化法测定结肠黏膜NOX1表达。结果:IBS组和对照组肠道黏膜菌群以拟杆菌门、变形菌门和厚壁菌门为主。IBS-D组、IBS-U组和对照组之间菌群多样性相比差异无统计学意义(P>0.05)。与对照组相比,IBS组Tissierella丰度明显增加(H=6.688,P<0.05),Granulicatella丰度明显降低(H=6.212,P<0.05)。与对照组和IBS-U组相比,IBS-D组Porphyromonas、Marmoricola、Cardiobacterium丰度明显增加(P均<0.05)。与对照组相比,IBS-U组、IBS-D组NOX1表达增加(P<0.01)。肠黏膜NOX1表达与Tissierella丰度存在正相关性(r=0.611,P<0.05),但与Granulicatella丰度无明显相关性(r=0.253,P=0.376)。Tissierella、Granulicatella丰度、NOX1表达与IBS严重程度无明显相关性(P>0.05)。结论:IBS患者与健康受试者的肠道黏膜菌群多样性无明显变化,部分菌群丰度发生改变,且不同亚型的菌群丰度变化不同。IBS患者结肠黏膜NOX1表达上调,且与Tissierella丰度存在一定的相关性。
肠易激综合征(irritable bowel syndrome, IBS)是常见的胃肠道疾病之一,主要症状为腹痛,可伴有排便习惯和粪便性状的改变[1]。其发病率高,约占胃肠病门诊患者的40%。目前IBS的具体发病机制仍不清楚,且无有效的治疗方法。
活性氧簇(reactive oxygen species, ROS)是由烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH oxidase, NOX)家族产生的代谢中间产物,主要包括一些小分子物质,如超氧阴离子(O2-)、过氧化氢(H2O2)、羟基自由基(·OH)、次氯酸(CHClO)等。NOX1是NOX家族成员之一,主要表达于肠上皮细胞,参与宿主防御、蛋白质的翻译、细胞信号转导、基因表达调控、细胞分化等过程。NOX1作为一种生物氧化酶,可催化ROS分子如O2-和H2O2的形成[2-3]。研究表明,ROS与疼痛形成关系紧密。ROS可通过激活GTP酶Rab7介导炎性疼痛过程;通过激活钙调素依赖性蛋白激酶Ⅱ介导神经病性疼痛;ROS在癌性骨痛中亦起重要作用,且自由基清除剂对其治疗有效[4-6]。但ROS是否可介导IBS患者内脏痛的形成,目前尚不明确。
肠道菌群紊乱是IBS发生、发展的重要机制之一。动物实验发现,小鼠肠上皮细胞可通过NOX1介导ROS的产生,并维持肠道菌群稳态,但在IBS患者中的作用尚不明确。本实验通过分析IBS不同亚型患者肠黏膜相关菌群特征、评估IBS症状严重程度量表并检测肠黏膜NOX1表达,旨在探讨肠道菌群、NOX1表达与IBS之间的相关性,从而为IBS的治疗提供一种新思路。
材料与方法
一、资料来源
收集2017年7月—2017年12月长治医学院附属和平医院收治的IBS患者,IBS诊断标准[7]:最近3个月内每月≥3 d具有反复发作的腹痛或腹部不适,且伴有≥2个下列症状:①排便后症状改善;②排便频率改变;③粪便性状改变。在诊断前6个月出现症状,近3个月症状发作符合上述诊断标准,且经结肠镜检查无异常者。根据罗马Ⅳ标准将IBS分为四种亚型:便秘型IBS(IBS-C)、腹泻型IBS(IBS-D)、混合型IBS(IBS-M)、不定型IBS(IBS-U)。纳入标准:①年龄18~65岁;②血尿便常规检查无明显异常;③腹部超声、结肠镜检查无异常。排除标准:①合并有其他疾病;②有腹部手术史;③近1个月内曾连续使用抗菌药物超过3 d;④近2周内连续服用益生菌、通便药、止泻药、促动力药超过3 d;⑤年龄<18岁或>65岁;⑥处于经期、妊娠期或哺乳期妇女。同时以同期性别、年龄、生活环境等基本情况与IBS患者均匹配的健康体检者作为对照。本研究方案由长治医学院附属和平医院伦理委员会审核批准,所有研究对象均签署知情同意书。
二、研究方法
1. IBS患者症状严重程度评估:由IBS患者根据自身情况填写IBS症状严重程度量表(IBS-SSS),完成后由分发量表者进行检查并补充完整,然后计算评分。
2. 标本收集和保存:所有入选者于检查前晚晚餐后禁食,检查前5 h,将聚乙二醇电解质散(购自江西恒康药业有限公司)139.12 g溶于2 L温开水中,每10 min服用250 mL,于2 h内服完。在距肛门近端25~35 cm处取黏膜组织2块,1块立即保存于-80 ℃液氮中,用于肠道黏膜菌群多样性和丰度的检测;另一块置于90%乙醇中固定,石蜡包埋、保存,用于肠道黏膜NOX1表达的检测。
3. 菌群测序:利用细菌基因组DNA提取试剂盒(德国QIAGEN公司),提取肠道黏膜菌群DNA,具体步骤严格按照说明书进行操作。由上海锐翌生物科技有限公司行16S rDNA扩增子测序。
4. 免疫组化法测定肠黏膜NOX1表达:采用两步法进行免疫组化染色。脱蜡、水化,PBS清洗5 min×3次;3% H2O2封闭10 min;高压抗原修复,PBS清洗5 min×3次;胎牛血清封闭10 min;加入一抗(Abcam公司,工作浓度1∶250)4 ℃过夜;37 ℃复温30 min,PBS清洗5 min×3次;加入二抗,37 ℃孵育20 min,PBS清洗5 min×3次;DAB显色,苏木素复染,脱水、透明、封片。在显微镜下观察并摄片。结果判定:细胞质内出现黄褐色颗粒沉淀为细胞阳性。每张切片选取视野清晰的5个不重复的高倍镜视野(×400),利用Image-Pro Plus 6.0图像分析软件,计算积分光密度值并取均值。
三、统计学分析

结 果
一、一般情况
共25例IBS患者纳入研究,其中男11例,女14例,平均年龄(47.16±11.01)岁。IBS-U患者10例,其中男2例,女8例,平均年龄(48.40±12.01)岁。IBS-D患者15例,其中男9例,女6例,平均年龄(46.33±10.64)岁。健康对照组13名,其中男6名,女7名,平均年龄(48.62±11.94)岁。IBS患者与健康对照组性别(χ2=0.016,P>0.05)、年龄(t=0.376,P>0.05)相比差异无统计学意义,IBS-D组与IBS-U组性别(χ2=2.442,P>0.05)、年龄(t=-4.52,P>0.05)相比差异亦无统计学意义。
二、肠黏膜菌群组成分析
IBS-D组、IBS-U组和对照组肠道黏膜相关菌群在所有菌属水平组成见图1,其中门水平上组成以变形菌门(分别为37.8%、43.2%、46.6%)、厚壁菌门(分别为29.5%、26.4%、29.1%)、拟杆菌门(分别为25.4%、23.7%、16.7%)为主(图2)。
三、肠黏膜菌群多样性分析
Alpha多样性分析显示,IBS-D组、IBS-U组和对照组Chao1指数、Shannon指数、Simpson指数相比差异无统计学意义(P>0.05)(表1)。
四、肠黏膜菌群丰度差异分析
与对照组相比,IBS组Granulicatella丰度明显降低(H=6.212,P<0.05),Tissierella丰度明显升高(H=6.688,P<0.05)。IBS-D组Porphyromonas、Marmoricola、Cardiobacterium丰度较IBS-U组和对照组明显增加(P均<0.05)(表2)。
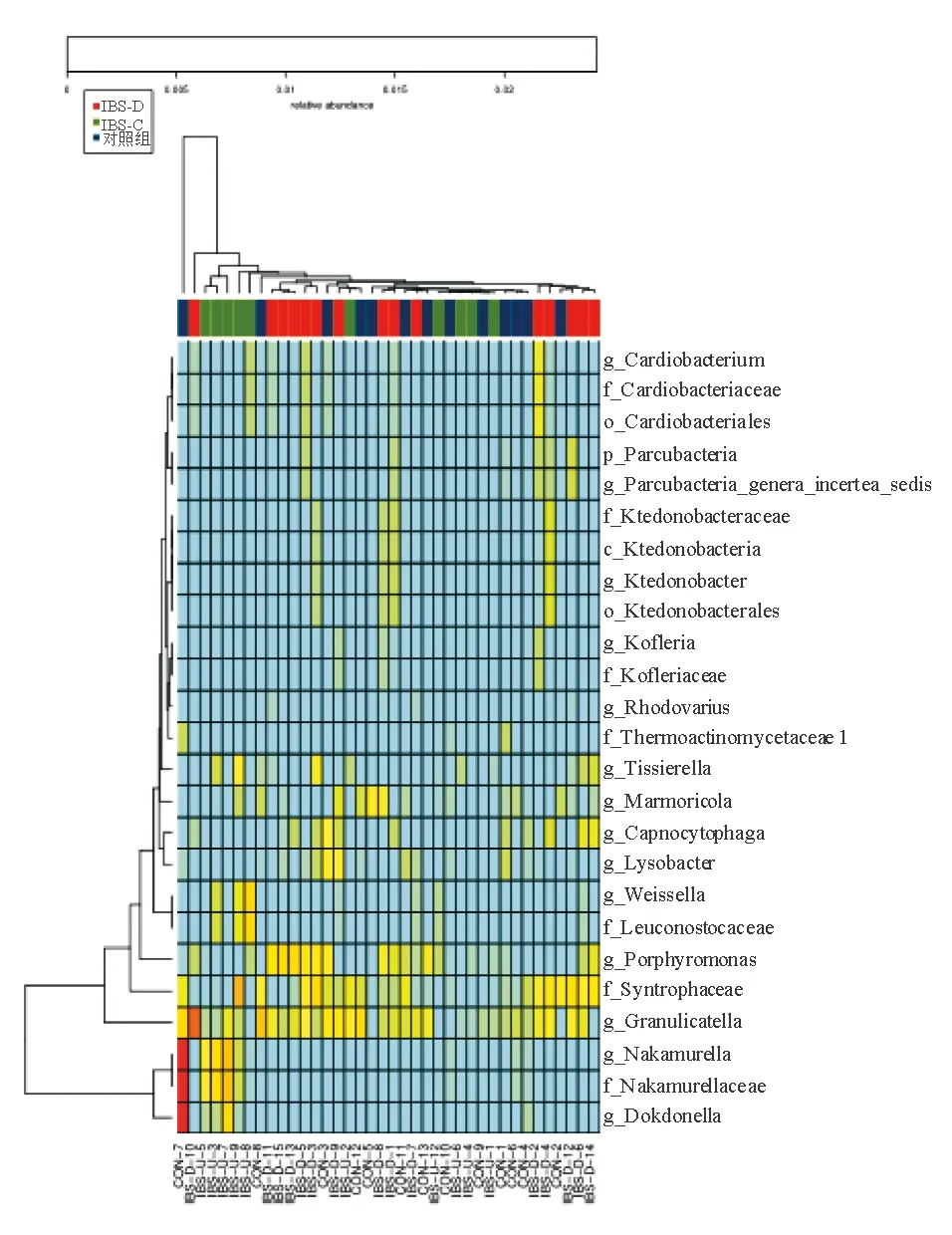
图1 三组患者所有水平差异物种的Heatmap图

图2 肠黏膜菌群在门水平上的相对丰度图
五、肠黏膜NOX1表达分析
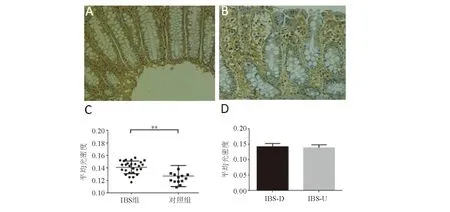
免疫组化结果显示,IBS和对照组中均可见NOX1表达阳性着色细胞,IBS组NOX1表达明显高于对照组,差异有统计学意义(0.140 8±0.002 0对0.126 9±0.004 5,P<0.05),而IBS-D组和IBS-U组相比差异无统计学意义(0.141 2±0.002 3对0.139 3±0.003 5,P>0.05)(图3)。
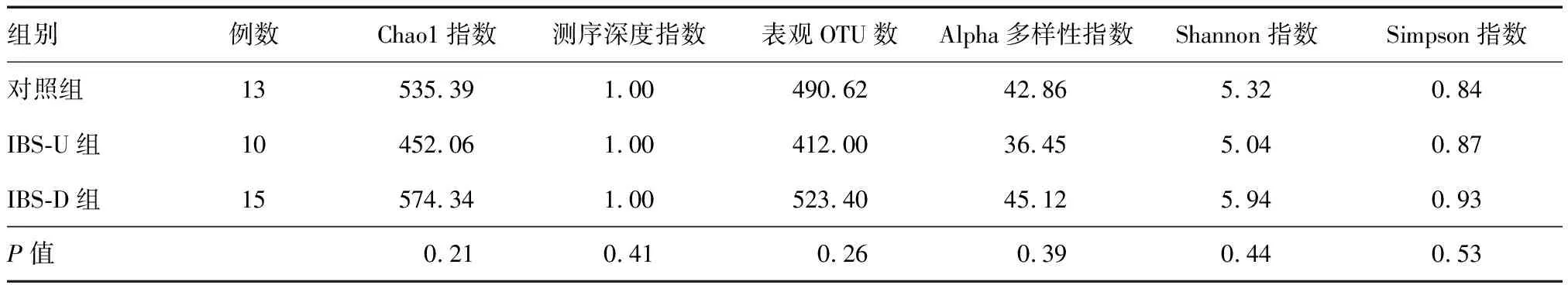
表1 各组肠黏膜菌群Alpha多样性分析

表2 各组肠黏膜菌群丰度差异分析
**P<0.05
A:IBS组(免疫组化法,×400);B:对照组(免疫组化法,×400);C:IBS组、对照组NOX1表达比较;D:IBS-D组、IBS-U组NOX1表达比较
图3 各组肠黏膜NOX1表达
六、相关性分析
1. 肠黏膜NOX1表达与菌群的相关性:Pearson相关分析发现,NOX1表达与Tissierella丰度存在正相关性(r=0.611,P<0.05),但与Granulicatella丰度无明显相关性(r=0.253,P=0.376)。
2. 菌群、NOX1表达与IBS-SSS的相关性:Pearson相关分析发现,Granulicatella、Tissierella丰度、NOX1表达与IBS-SSS评分均无相关性(r=-0.153,P=0.459;r=-0.149,P=0.512;r=0.611,P=0.763)。
讨 论
有证据表明,涉及内脏痛觉的中枢或外周机制可能受到肠道菌群的影响,如乳酸杆菌和双歧杆菌属可减轻应激和IBS引起的内脏疼痛[8];大鼠摄入婴儿双歧杆菌35624会增加疼痛阈值并减少结直张扩张(CRD)后的疼痛行为[9]。本实验发现,IBS患者肠道菌群以变形菌门、厚壁菌门、拟杆菌门为主,IBS组和对照组菌群多样性相比无明显差异,IBS亚型间相比亦无明显差异。与对照组相比,IBS组Granulicatella丰度明显降低,Tissierella丰度明显升高。此外,IBS-D组Porphyromonas、Marmoricola、Cardiobacterium丰度较对照组和IBS-U组明显增加(P均<0.05)。但Ait-Belgnaoui等[8]的研究发现,与健康对照组相比,IBS患者肠道差异菌群主要为嗜酸乳杆菌、双歧杆菌、柠檬酸杆菌等。各项研究结果的不一致可能与研究对象种族、饮食、生活习惯和地理环境以及取样差异、检测方法等因素有关。
腹痛是IBS患者的常见症状之一。研究表明,肠道菌群可通过其代谢产物5-羟吲哚乙酸来增加血浆色氨酸浓度,影响中枢神经系统中5-羟色胺(HT)的传递[10],使下丘脑对内脏疼痛的反应增强,加重IBS症状。目前关于肠道细菌Tissierella的研究较少。研究发现,在急性心肌梗塞小鼠模型中Tissierella数量明显升高,但具体机制尚不清楚[11],可能与IBS组Tissierella丰度升高原因一致。此外,本实验发现IBS-D组Syntrophaceae丰度明显高于对照组和IBS-U组,而有研究表明Syntrophaceae可分解代谢产生甲烷[12],这可能与IBS-D患者腹胀、腹部不适有关。
目前,关于NOX1的研究多集中于氧化还原、细胞分裂和分化、伤口愈合等,其在稳定肠道微生态中的作用尚不清楚[13]。研究[14]发现,在敲除NOX1基因的小鼠中,鼠沙门杆菌对盲肠细菌浓度和整体组成无明显影响。但另一项感染柠檬酸杆菌的小鼠模型发现,敲除NOX1基因的小鼠盲肠内球菌数量较较正常小鼠减少,疾病状态改善[15]。说明肠道微生态与NOX1表达有关。
由NOX催化产生的ROS如H2O2为多种细胞内信号通路的关键调节因子。ROS调节细胞信号转导的机制是通过氧化特定的活性半胱氨酸残基而实现的,这些基团位于控制细胞信号通路激活的酶中。因此,含有活性半胱氨酸残基的蛋白质具有氧化还原感受器的功能,并转导由ROS介导的信号。ROS氧化活性半胱氨酸残基这一性质,对于内脏疼痛的发生具有重要意义。
ROS是痛觉过敏的介质[16]。研究[4]发现ROS通过氧化Rab7来介导炎症性疼痛过程;Kogure等[17]的研究发现,H2O2可通过激活瞬时受体电位阳离子通道A1(transient receptor potential ankyrin 1 cation channel, TRPA1)来介导内脏疼痛;乳酸杆菌可刺激小鼠远端小肠和结肠中FPR1受体,并通过NOX1迅速产生生理浓度的ROS,并刺激结肠中ROS依赖性细胞增殖[18]。Matziouridou等[19]的研究发现,肠道细菌数量、组成和移位可能受ROS产生的调节;Pircalabioru等[15]的研究表明NOX1对腔细菌具有调节作用。故推测肠道菌群可通过肠上皮细胞中NOX1表达来介导ROS的产生,从而影响IBS的形成与发展,但目前关于此方面的研究较少。本研究发现,与对照组相比,IBS组肠黏膜上皮细胞中NOX1表达明显增高(P<0.05),而IBS-U与IBS-D患者之间无明显差异(P>0.05)。但由于条件限制,本实验未能进一步研究IBS肠道差异菌群与NOX1表达间的作用机制。
总之,本研究发现,IBS患者和健康志愿者间肠道菌群在种类数目上并无明显差异,但特定菌群的相对丰度发生改变,且不同亚型的菌群丰度变化不同。结肠黏膜NOX1表达与Tissierella丰度存在正相关性,与Granulicatella丰度无明显相关性,但现有研究并未发现差异菌群Granulicatella、Tissierella与NOX1表达间的联系,这或许是研究IBS发生、发展机制的一个新方向。

