大黄酸通过抑制NF-κB通路促进DLBCL细胞OCI-LY8凋亡*
胡施炜, 楼恩哲, 王 瑜, 应佳豪, 柯瑞君, 陈佳玉
(绍兴文理学院医学院, 浙江 绍兴 312000)
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)为好发于中老年男性的非霍奇金淋巴肿瘤(non-Hodgkin lymphoma,NHL)亚型之一,约占NHL的30%~40%[1]。近年来我国DLBCL的发病率呈上升趋势,在城市和农村的肿瘤发病率中分别位居第8位和第10位。目前,经典的一代CHOP和二代R-CHOP治疗方案使DLBCL的治愈率可达60%,但仍有1/3的患者因药物副作用等原因而未实现真正意义上的治疗[2]。近期所研究的新型药物的联合靶向治疗虽有一定疗效,但预后不稳定且易引发“细胞因子风暴”,其中趋化因子介导的中性粒细胞更因分泌促肿瘤因子而参与了DLBCL的进展过程[3]。因此发现新的DLBCL辅助或替代药物对实现DLBCL的完全治疗十分重要。
大黄酸(1, 8-二羟基-3-羧基蒽醌,rhein)为来源于大黄的蒽醌类化合物[4],它是保健品制备原料之一,在临床上具有通便排毒、降脂减肥和延缓衰老的功效。研究显示,大黄酸具有抗卵巢癌、肺癌和乳腺癌的作用[5-6],且可与其它中药成分联合,通过影响核因子κB(nuclear factor-κB,NF-κB)信号通路在炎症疾病中发挥作用[7-8]。 NF-κB的持续活化与肿瘤的发生发展有一定的相关性[9],而影响NF-κB信号通路的活化有可能影响DLBCL细胞生长。大黄酸对DLBCL细胞NF-κB信号通路的影响及其对DLBCL发生发展的具体作用目前尚未见详细报道。 因此,本研究将大黄酸作用于DLBCL细胞株OCI-LY8和DLBCL荷瘤小鼠,并通过检测细胞活力、细胞凋亡和周期分布的流式细胞术分析、qPCR、Hoechst染色、Western blot和抑瘤实验等方法,探讨了大黄酸对DLBCL细胞生长和凋亡的作用及其作用的相关分子机制,以期为临床治疗DLBCL新药的发现提供实验依据。
材 料 和 方 法
1 实验材料
4~5周龄雄性BALB/c裸鼠购自浙江省实验动物中心,动物合格证号为SCXK(沪)2013-0016。人源DLBCL细胞株OCI-LY8来源于DSMZ;EB病毒转化的人B淋巴细胞CGM1购自ATCC。大黄酸购自北京索莱宝科技有限公司(用5%的碳酸氢钠配制贮备液);胰蛋白酶、胎牛血清、PBS和RPMI-1640细胞培养液购自Gibco;AnnexinV-FITC/PI试剂盒和脱脂奶粉购自BD;PCR引物由上海Sangon Biotech公司合成;DEPC水和TRIzol购自Invitrogen;Hoechst 33342染色液、RIPA裂解液(强)和BCA蛋白浓度测定试剂盒购自Beyotime;CellTiter 96®AQueous Non-Radioactive Cell Proliferation Assay购自Promega;ECL化学发光液购自Sigma;dNTP混合物、逆转录酶、I 抗和酶标 II 抗购自Boster Biotech;其它化学试剂均为国产分析纯。
2 主要方法
2.1MTS法检测细胞活力 将DLBCL细胞OCI-LY8和EB病毒转化的人B淋巴细胞CGM1分别置于含10%胎牛血清的RPMI-1640培养液中,在37 ℃、5% CO2培养箱中培养至对数生长期,取细胞经1 000 r/min离心5 min后去上清,分别用含有0、2、10、50和250 μg/L大黄酸的RPMI-1640完全培养液调整细胞浓度至1×109/L,并接种至96孔细胞培养板,每孔100 μL,设3复孔。将细胞置于37 ℃、5% CO2培养箱中培养,于培养0、24、48和72 h取出培养板,分别加入MTS试剂10 μL,混匀后,将培养板继续置于细胞培养箱中培养20 min。取出培养板,并利用酶标仪测量490 nm时各孔的吸光度(A)值,绘制细胞生长曲线,分析大黄酸对细胞活力的影响,并根据结果筛选后续实验的最佳剂量。
2.2流式细胞术检测细胞凋亡水平 取分别经0、10和50 μg/L大黄酸作用24 h的OCI-LY8和CGM1细胞各5×106个,1 000 r/min离心5 min,弃上清,用PBS洗涤细胞2次,每次均经1 000 r/min离心5 min回收细胞。用100 μL 1× Binding Buffer重悬细胞,加入5 μL Annexin V-FITC和5 μL PI,混匀后避光染色30 min,PBS洗2次,经1 000 r/min离心5 min回收细胞。用200 μL PBS悬浮细胞,流式细胞术检测检细胞凋亡水平,分析大黄酸对OCI-LY8细胞凋亡的影响。
2.3Hoechst染色观察细胞核型的变化 取处于对数生长期的OCI-LY8细胞,分别用含0、10和50 μg/L大黄酸的RPMI-1640完全培养液于37 ℃、5% CO2条件下培养24 h,1 000 r/min离心5 min,弃上清,PBS清洗细胞2次,每次均经1 000 r/min离心5min回收细胞。于细胞沉淀中加入10 μg/L的Hoechst 33342染色液100 μL,轻轻混匀,于4 ℃避光染色20 min。离心弃染液,用PBS洗细胞2次,1 000 r/min离心5 min回收细胞。于细胞沉淀中加入PBS 1滴,混匀细胞,并将细胞滴加到载玻片上,在荧光显微镜下观察细胞的核型,并计数凋亡核型细胞所占的百分比。
2.4qPCR法分析细胞内基因的mRNA水平 取处于对数生长期的OCI-LY8细胞,用分别含0 μg/L或50 μg/L大黄酸的RPMI-1640完全培养液于37 ℃、5% CO2条件下培养24 h,1 000 r/min离心细胞5 min,弃上清,PBS清洗细胞2次,每次均经1 000 r/min离心5 min回收细胞。用TRIzol提取细胞RNA(试剂用量和方法按说明书),Nano Drop定量后逆转录成cDNA。设计并合成Rip2、β-actin、Bcl-xL、NIK、NF-κB和caspase-3的引物(引物序列见表1),qPCR法检测各基因mRNA的Ct值,利用公式2-ΔΔCt计算各基因的mRNA相对含量,分析大黄酸对OCI-LY8细胞基因转录水平的影响。
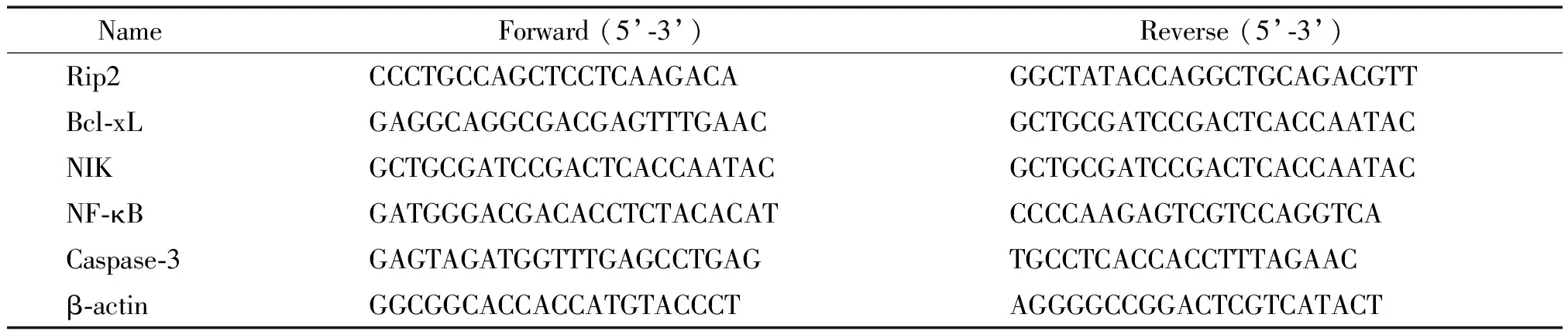
表1 qPCR引物序列
2.5Western blot分析细胞内的蛋白水平 取分别经含有终浓度为0、10和50 μg/L大黄酸的RPMI-1640培养24 h后的OCI-LY8细胞,离心弃上清,用PBS洗涤细胞2次,每次均于4 ℃、1 000 r/min条件下离心5 min以回收细胞,完全弃上清后,用RIPA裂解液(强)裂解各组细胞10 s,12 000 r/min离心20 min,回收上清。各上清中的细胞总蛋白用BCA蛋白浓度测定试剂盒定量后,以GAPDH为内参照,进行Bcl-xL、NIK、p52、RIP2、IκBα、p65和caspase-3蛋白的Western blot检测。用ImageJ软件进行各蛋白条带的灰度检测。
2.6抑瘤实验 取4周龄BALB/c小鼠,并将其随机分为6小组,每组10只。待其适应环境 1 周后,在每只BALB/c裸鼠腹肌沟皮下接种1×107的OCI-LY8细胞0.1 mL,于肿瘤细胞接种2 d 后,分别尾静脉注射0、1、5、25和125 μg/kg大黄酸,其后每2 d 用药1次,在用药15 d 后处死小鼠,解剖剥离肿瘤组织,称瘤重并记录,分析大黄酸的抑瘤效果。
3 统计学处理
所有数据均经SPSS 17.0软件统计分析。实验数据以均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 细胞活力的检测结果
MTS实验的检测结果表明,OCI-LY8细胞经2、10、50和250 μg/L的大黄酸作用后,其活力均受到明显的抑制(P<0.01),且其受抑程度随着大黄酸用药浓度和作用时间的增加越显著,见图1A。B淋巴细胞CGM1的活力在大黄酸用药浓度低于50 μg/L时未受影响,但当药物剂量达到250 μg/L时,CGM1细胞的活力亦受到显著抑制(P<0.01),见图1B。因此后续实验选择10 μg/L和50 μg/L为药物作用剂量来分析药物作用的分子机制。
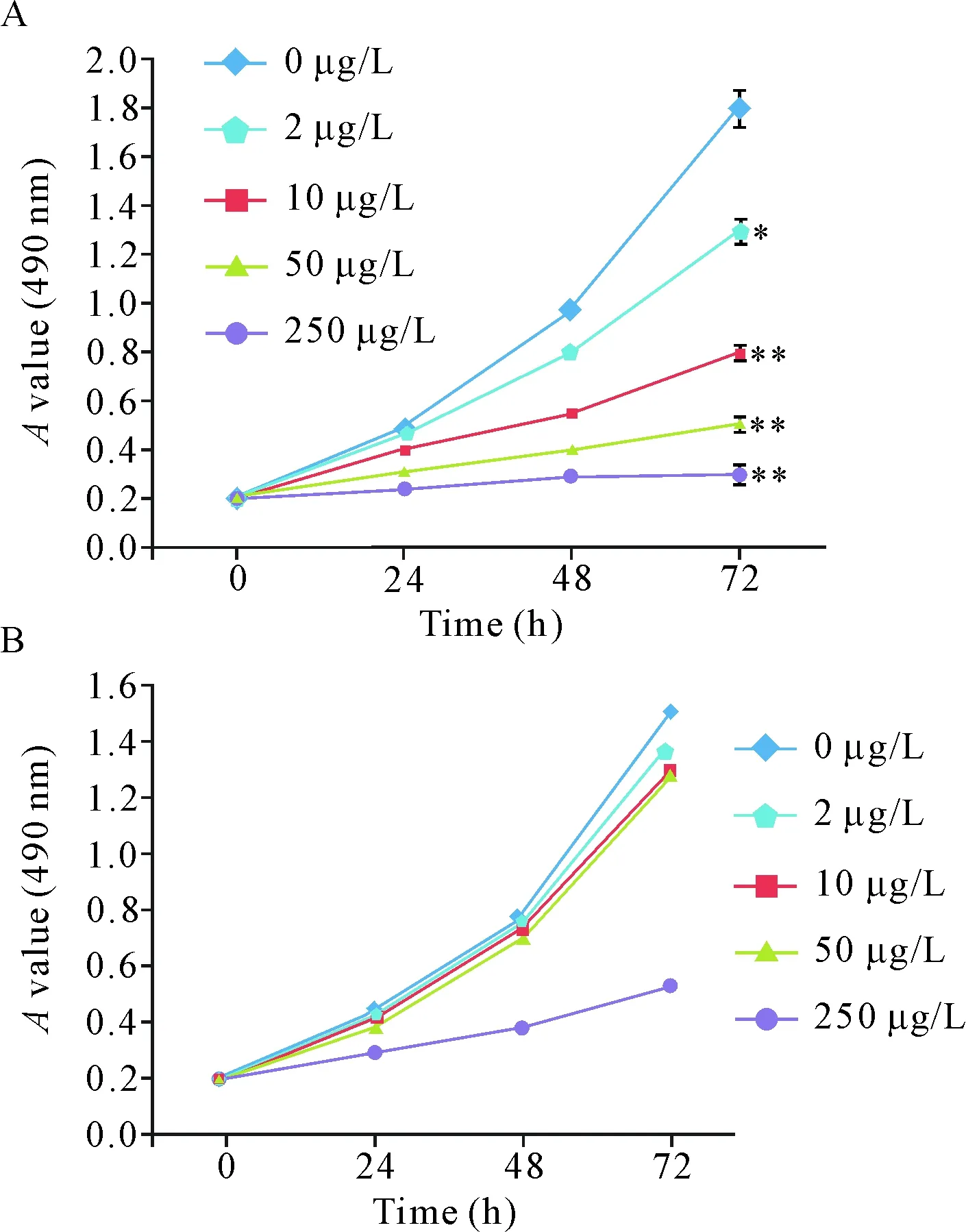
Figure 1.The results of cell viability by MTS assay. OCI-LY8 (A) and CGM1 (B) cells were treated with 0~250 μg/L rhein. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μg/L group.
图1 MTS法检测细胞活力
2 流式细胞术检测细胞凋亡的结果
OCI-LY8细胞分别经10 μg/L和50 μg/L大黄酸作用24 h后,流式细胞术检测发现细胞凋亡率由0 μg/L组的0.13%±0.05%增加到16.72%±1.03%和28.24%±1.14%,其凋亡水平随用药剂量增加而增加(P<0.01);而CGM1细胞的凋亡水平未受明显影响(P>0.05),见图2。
3 Hoechst 33342染色的结果观察
Hoechst 33342染色结果显示,在10 μg/L和50 μg/L大黄酸作用下,部分OCI-LY8细胞的核染色质浓缩,核碎裂,出现凋亡小体,且发生凋亡核型改变的细胞随用药剂量的增加而增加(P<0.01),见图3。该结果与流式细胞术检测细胞凋亡的结果基本相符。
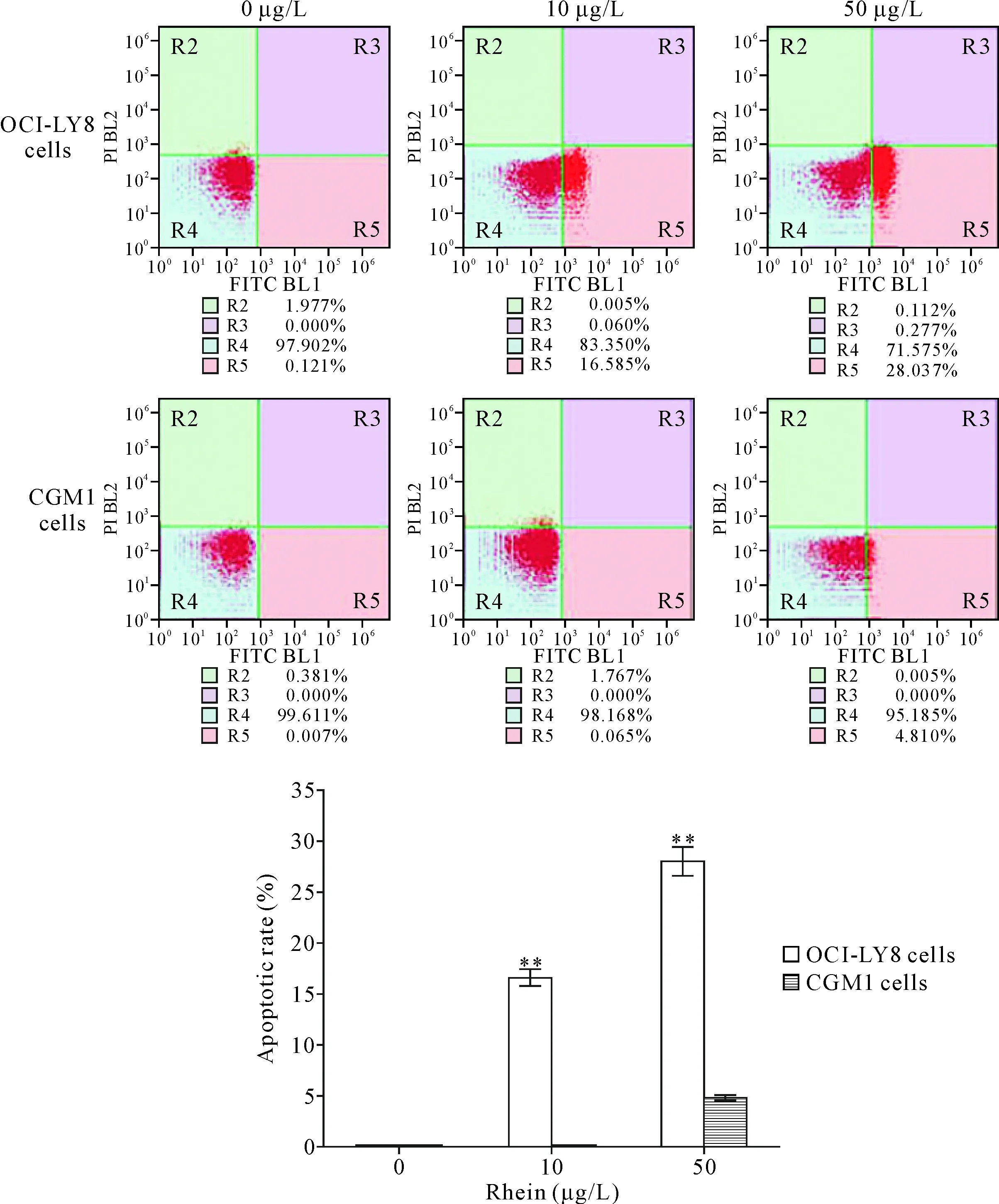
Figure 2.The results of apoptotic rate examined by flow cytometry. Mean±SD.n=3.**P<0.01vs0 μg/L group.
图2 流式细胞术检测细胞凋亡率的结果
4 qPCR检测结果
qPCR检测结果显示,50 μg/L大黄酸作用OCI-LY8细胞24 h后,Rip2、Bcl-xL、NIK和NF-κB的mRNA水平均显著下降(P<0.01),而caspase-3的mRNA水平增长了近2倍(P<0.01),见图4。
5 Western blot检测结果
Western blot检测结果显示,与0 μg/L对照组相比,10 μg/L和50 μg/L大黄酸用药组OCI-LY8细胞内RIP2、NIK、p52、Bcl-xL、p-p65和p-IκBα蛋白水平显著降低,而cleaved caspase-3的蛋白水平显著上升(P<0.01),且蛋白含量的改变与用药剂量相关,见图5。
6 抑瘤实验的结果
大黄酸显著抑制了荷DLBCL小鼠肿瘤组织的生长(P<0.01),且其抑制作用随大黄酸浓度的增加而加强,见图6。但当用药剂量达到125 μg/kg时,于用药3 d 后,动物开始出现死亡,当用药15 d处死时,虽然肿瘤组织显著减小,甚至有1只小鼠未发现瘤组织,但小鼠死亡量已达到7只。因此,该药物25 μg/kg剂量以下低浓度长期给药的方式适宜用于抗DLBCL治疗。
Figure 3.The results of Hoechst 33342 μg/L staining (×200). Mean±SD.n=3.**P<0.01vs0 μg/L group.
图3 Hoechst 33342染色结果
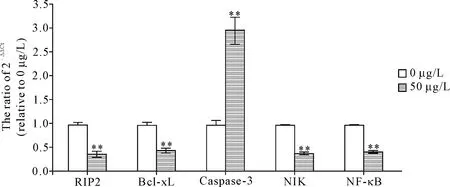
Figure 4.The results of qPCR. Mean±SD.n=3.**P<0.01vs0 μg/L group.
图4 qPCR检测结果
讨 论
蒽醌类化合物对多种肿瘤细胞的生长和增殖有抑制作用,而大黄酸作为醌类化合物重要成员,它可抑制恶性胶质瘤细胞侵入正常脑组织,我们推测该药物可能对DLBCL有一定的治疗作用,而本研究中的MST实验也证实了此点。当DLBCL细胞株OCI-LY8经2~50 μg/L大黄酸作用后,细胞活力明显受抑制,且当大黄酸浓度越大、作用时间越长,其抑制作用越明显。同时Hoechst染色和流式细胞术检测证实,大黄酸可诱导OCI-LY8细胞凋亡,而抑瘤实验也表明大黄酸可在体内抑制DLBCL肿瘤组织的生长,这些均与Blacher等[10]报道的大黄酸对多形性胶质母细胞瘤抑制作用的研究结果相一致。此外,qPCR和Western blot检测结果证实,OCI-LY8细胞经大黄酸作用24 h后,细胞内NF-κB通路相关蛋白及其通路下游的线粒体途径相关分子NIK、Rip2、p52、p65和Bcl-xL的mRNA和蛋白水平显著下调,IκBα蛋白磷酸化水平显著降低,同时,凋亡的线粒体内源途径相关蛋白caspase-3水平增加,Bcl-xL下降,由此猜测大黄酸通过NF-κB信号通路发挥作用。

Figure 5.The results of Western blot. Mean±SD.n=3.**P<0.01vs0 μg/L group.
图5 Western blot检测结果
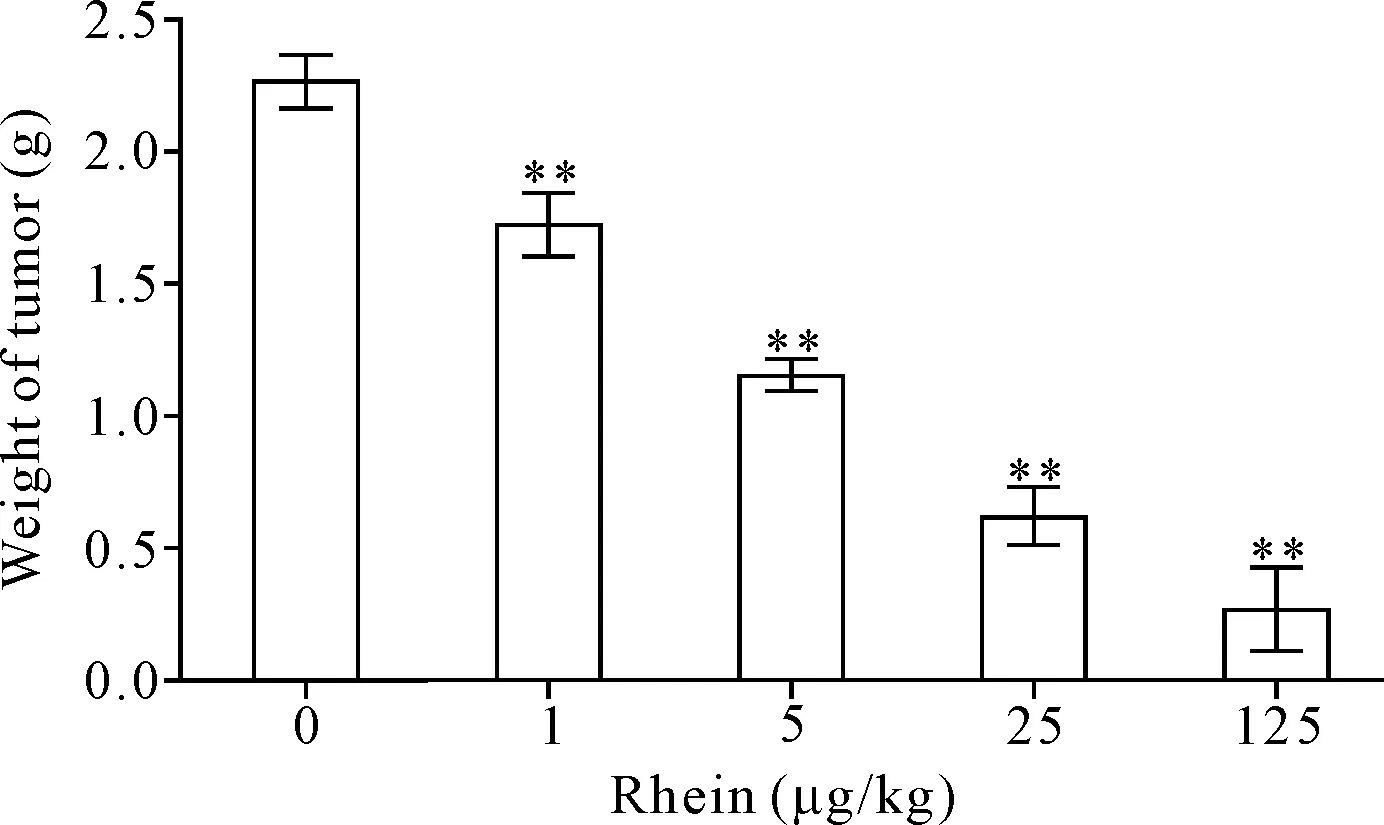
Figure 6.The results of tumor inhibiting experiment. Mean±SD.n=10.**P<0.01vs0 μg/kg group.
图6 荷瘤小鼠抑瘤实验检测结果
NF-κB为一个转录因子蛋白家族,其成员包括p50(NF-κB1)、p52(NF-κB2)、p65(NF-κB3)、Rel(cRel)和RelB。在静息细胞中,这些蛋白质二聚化形成的NF-κB常常与细胞质中的抑制因子(IκBα、IκBβ和IκBε)结合而失去活性。而IκB激酶复合体(IKK)及其激活剂NIK则可激活NF-κB,为肿瘤的增殖提供生长环境,对肿瘤的发生和发展起促进作用[11]。 当细胞受到细胞外信号刺激后,IKK复合体活化,促使IκB磷酸化,使NF-κB暴露核定位位点。游离的NF-κB迅速移位到细胞核,与特异性κB序列结合,促进Bcl-xL和IL-1等基因的表达。Bcl-xL表达上调后将抑制促凋亡因子Bax移位插入线粒体外膜的功能。而Bax/Bcl-2为细胞凋亡信号的分子开关,其比值的下降将使线粒体膜的通透性降低,抑制了细胞色素C的释放和caspase-3的活化[12],细胞得以生存。而当IL-1的表达水平增加后,IL-1将与细胞膜IL-1R结合,并将通过经典途径调控NF-κB,从而进一步抑制细胞凋亡的发生[13]。
在NF-κB信号通路中,RIP2是决定细胞生存或死亡的双向功能适配器分子,为激发经典NF-κB信号通路的重要成员,RIP2泛素化后可促进下游IKK复合体形成和NF-κB转录。因此,当大黄酸诱使RIP2表达下调后,IKK复合体的形成和促IκBα磷酸化作用减弱,IκBα降解量减少,从而最终游离入核的p65/p52二聚体数量也相应减少,最终OCI-LY8细胞凋亡水平增加[14]。NIK为非经典NF-κB信号通路启动分子,并被认为是套细胞淋巴瘤治疗的新靶点[15]。当大黄酸促使NIK表达下降后,p52前体(p100)被加工降解的比例也随之降低,转移到细胞核中的p52和p65异二聚也相应减少[16],进而下调了抗凋亡蛋白Bcl-xL和IL-1的水平,进一步诱导了OCI-LY8细胞凋亡。由此可以肯定,抑制NF-κB信号通路活化是大黄酸诱导DLBCL细胞OCI-LY8凋亡的重要机制。
综上所述,适当剂量的大黄酸可通过抑制OCI-LY8细胞NF-κB经典和非经典信号通路来抑制该细胞的增殖活性,并激活细胞线粒体相关的内源凋亡通路,引起该细胞的凋亡。本实验为DLBCL发病机制的探索、疾病的早期诊断和治疗新药的研发提供了实验依据。

