不同铵态氮/硝态氮配比对2种开唇兰属植物组培苗生长的影响
罗剑飘,谭嘉娜,官锦燕,黄海英,陈月桂,杨俊贤,罗青文
(1.广东省生物工程研究所 广东省甘蔗改良与生物炼制重点实验室,广东 广州 510316;2.广东省生物工程研究所 湛江甘蔗研究中心,广东 湛江 524000)
开唇兰属(Anoectochilus)为多年生地生兰,约有40余种,分布于亚洲热带地区至大洋洲,我国有20种,2个变种,产于西南部至南部,该属植物的部分种可全草药用[1],如金线兰(A.roxburghii)、台湾银线兰(A.formosanus)、恒春银线兰(A.koshunensis)等,是我国传统珍稀药材[2],其提取物已被证明具有抑菌、抗病毒[3]、抗癌细胞[4]、抗氧化性[5]、降血压[6]等功效。除药用价值外,开唇兰属植物许多种类的叶片上有着美丽的斑纹及天鹅绒般的光泽,加之花型精巧奇特,也是观赏价值较高的室内花卉珍品。由于该属植物的部分种具有较高的经济价值,野生资源急剧减少,其资源的保护和可持续利用研究显得尤为重要。目前,对开唇兰属植物的研究主要集中于资源分布[7-8]、基因鉴定[9-10]、营养体结构[11-12]、组培快繁体系[13-14]、栽培基质和栽培模式[15-16]、肥料需求[17-18]、化学成分和药理学作用[6, 19-20]等方面。然而关于开唇兰属植物的肥料需求研究多注重肥料整体对植株生长的影响[17-18],对于其中矿质元素的形态研究甚少,尤其是关于需求量较大的氮素形态对开唇兰属植物生长的影响报道较少。
氮素是植物体内许多重要有机化合物的组成成分,对植物生命活动以及作物产量和品质均有极其重要的影响[21]。高等植物不能利用空气中的氮气,仅能吸收化合态的氮。植物可以吸收氨基酸、天冬酰胺和尿素等有机氮化物,但是植物的氮源主要是无机氮化物,而无机氮化物中又以铵盐和硝酸盐为主[22],由于二者形态不同,会对同一作物的生长产生不同的效应,同时,不同作物对同一形态氮素的吸收利用也存在差异。目前关于不同形态氮素对农作物生长的影响已有不少报道[21,23-32],而对开唇兰属植物生长的影响报道较少,仅朱美瑛[33]研究发现,较高浓度的硝态氮有利于台湾银线兰株高的增长、根的生长、可溶性蛋白和干物质的积累,但不利于叶片的生长。鉴于此,以金线兰和云南野生开唇兰属植物(简称云南开唇兰)组培苗为材料,研究不同硝态氮和铵态氮配比对其生长的影响,为开唇兰属植物组培扩繁基本培养基的优化及生产上合理施用氮肥提供理论依据。
1 材料和方法
1.1 材料
供试材料分别为金线兰和云南开唇兰的组培苗,由广东省生物工程研究所湛江甘蔗研究中心提供。其中,云南开唇兰组培苗由2012年于云南芒市野外发现的植株经组培扩繁得到,经过形态特征比对,初步确认为开唇兰属植物,其与金线兰组培苗的不同在于:株高较高(在10~16 cm不等,金线兰为8~12 cm),叶片具网状脉,同样带有天鹅绒光泽,但较为稀疏,生长速度较金线兰快。
1.2 试验方法
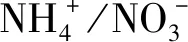
各处理大量元素配制方法详见表1。每个处理分别设顶芽培养基和茎段培养基,顶芽培养基中加入NAA 0.2 mg/L,茎段培养基中加入6-BA 0.5 mg/L、NAA 0.2 mg/L。此外,各处理均加入蔗糖30 g/L、卡拉胶6.8 g/L,控制pH值在5.4。
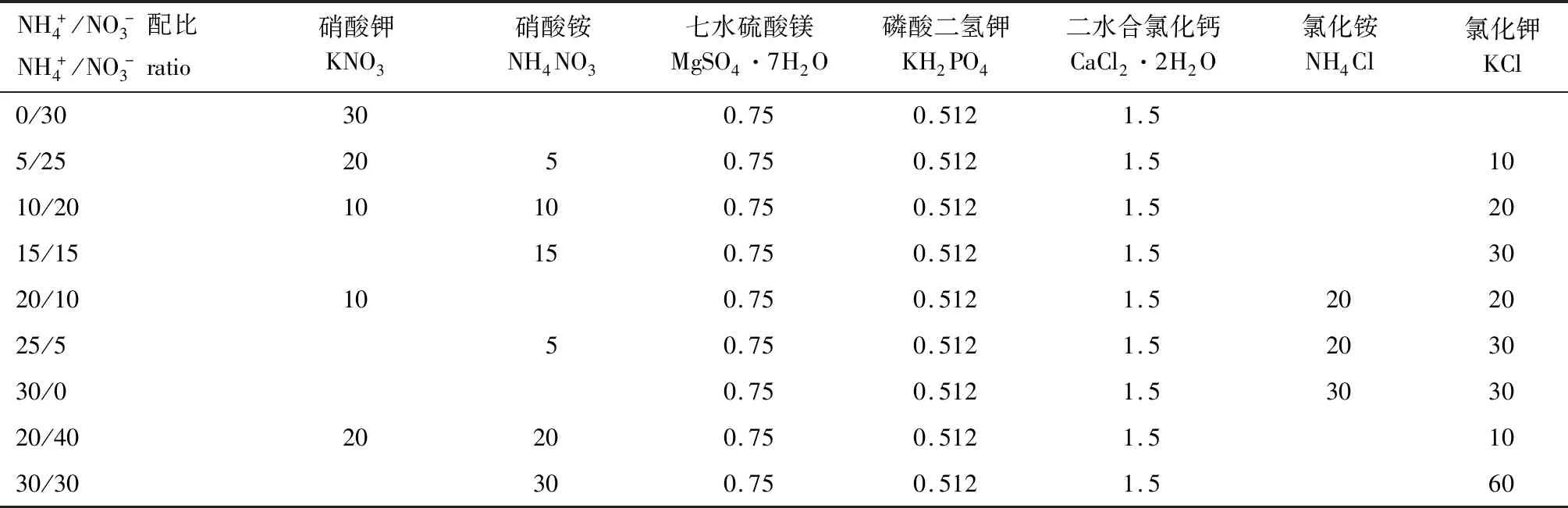
表1 大量元素配制方法Tab.1 Preparation method of major element solution mL/L
注:1.各化合物均先配制成1.0 mol/L溶液,再按照表中要求进行添加; 2.“空白”表示不需要添加。
Note: 1.All the chemical compounds in the table are first dissolved in water to prepare a solution with 1.0 mol/L concentration, and then be added base on the table’s requires.2.The blanks in the table mean that this chemical compound is on need to be added.
1.2.2 接种方法及培养条件 选取处于壮苗阶段、生长良好、长势均一的组培苗为接种材料。顶芽取材:截取组培苗从顶端开始往下带有1个节的截段,金线兰顶芽截段约为2.5 cm,云南开唇兰顶芽截段约为3.5 cm。茎段取材:将组培苗的顶芽、叶片及根部去除,以茎上的节为单位,截成单个茎段,每个茎段长度约为1.0 cm。
将顶芽垂直接入各处理顶芽培养基中,将茎段均匀平铺于各处理茎段培养基中。每瓶培养基接入8个外植体,每处理接种5瓶,重复3次。由于2种开唇兰属植物生长速度不同,接种90 d后记录云南开唇兰各处理植株的生长指标,接种120 d后记录金线兰各处理植株的生长指标。每处理随机选取15个(每重复选取5个)植株(或茎段)进行测量和记录。
培养条件:温度(25±2)℃,光照强度800~1 300 lx。
1.3 测量指标及方法
顶芽测量指标:植株死亡率(该处理死亡植株数/该处理总植株数×100%)、茎高、节数、展叶数(指完全展开的叶片数,下同)、倒数第2节叶片(简称倒二叶)及近茎尖第1片开展叶叶长和叶宽(叶片基部离层至叶尖的距离为叶长,叶片最大宽幅为叶宽,用直尺测量,下同)、茎粗(选取植株中间部位的茎段用分度值为0.02 mm的游标卡尺测量,下同)、枯叶数、枯茎数(指一株植株中已经枯萎的茎节数,下同)、基内生根率(该处理在培养基内生根的植株数/该处理总植株数×100%)、基内根根数及基内根根长、气生根数及气生根根长。
茎段测量指标:萌芽率(该处理已经萌发新芽的茎段数/该处理总茎段数×100%)、萌芽数(单个茎段上萌发的芽的个数)、芽高、芽节数(萌发的新芽具有的茎节数)、展叶数、倒二叶叶长和叶宽、茎粗、生根率(该处理中生根的植株数/该处理总植株数×100%,包含气生根及基内根)、根数及根长(包含气生根及基内根)。
1.4 数据处理
试验数据用平均值±标准误表示,采用SPSS 20.0进行方差分析,Duncan’s法进行多重比较,方差非齐性时采用非参数的Kruskal-Wallis秩和检验(多重比较选择“逐步降低”)。
2 结果与分析
2.1 不同配比对金线兰和云南开唇兰顶芽生长的影响
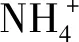
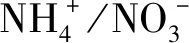
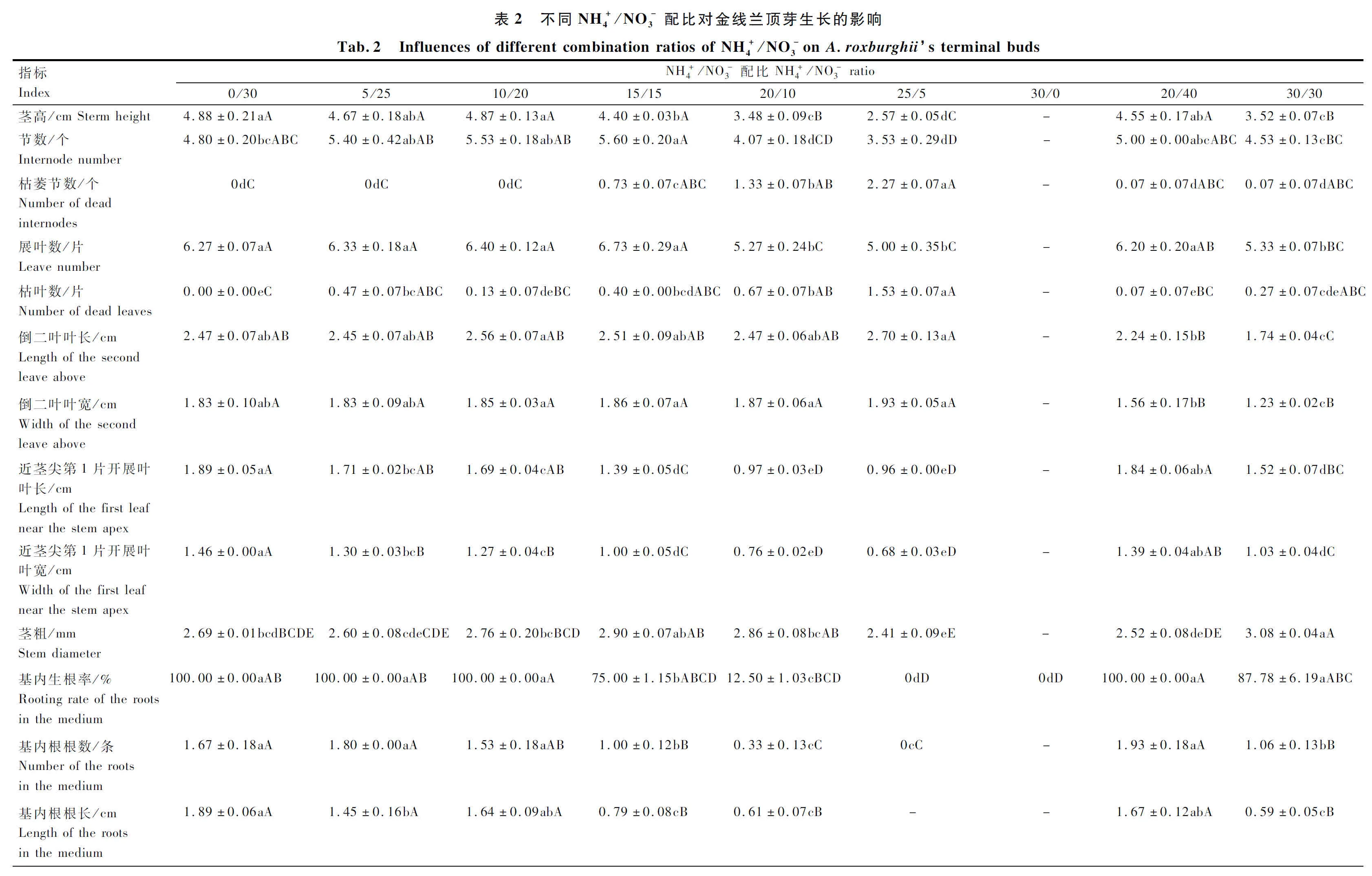
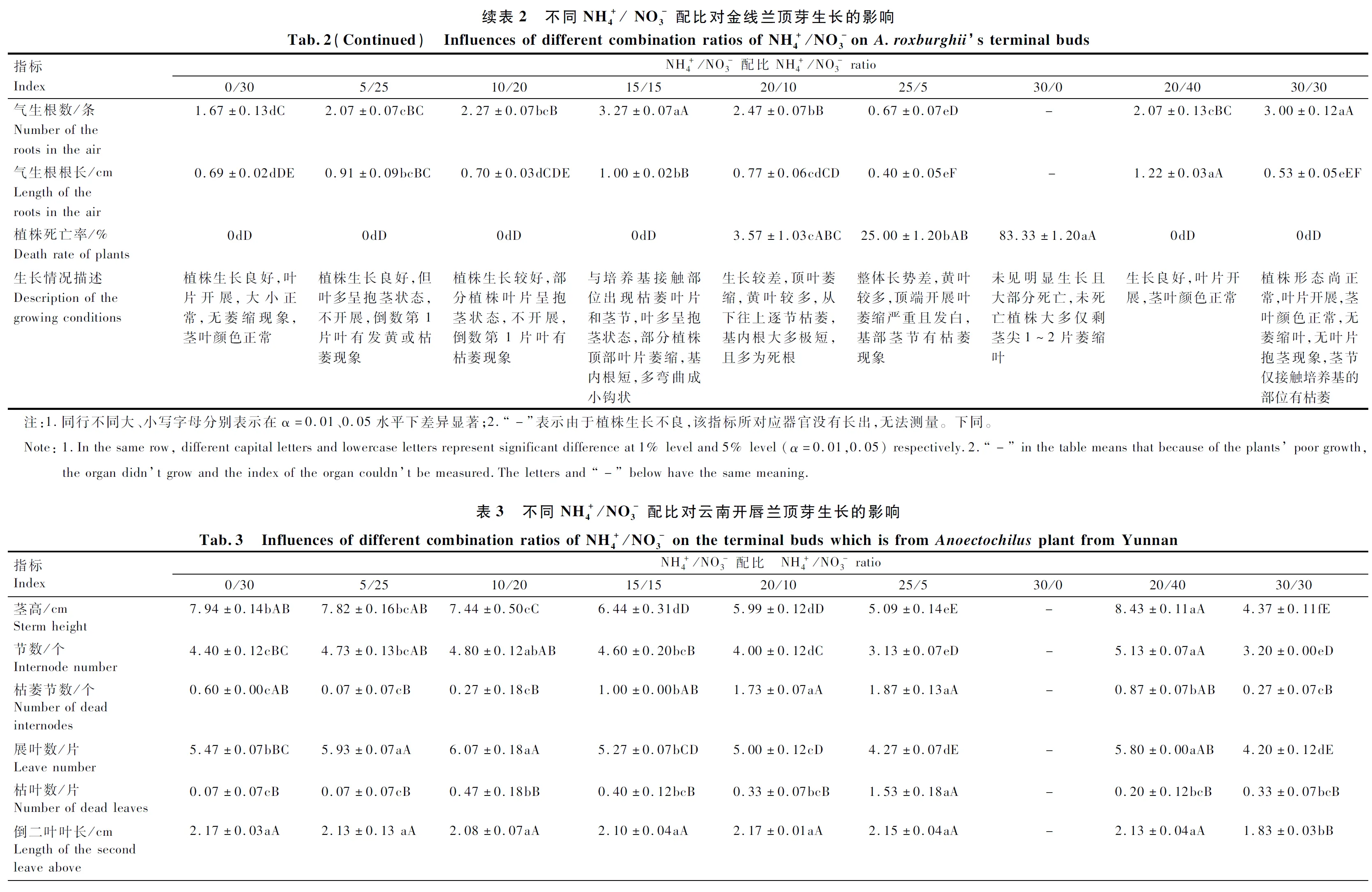

图1 金线兰顶芽生长情况Fig.1 Growing conditions of Anoectochilus roxburghii’s apical buds

图2 云南开唇兰顶芽生长情况Fig.2 Growing conditions of the apical buds which is from Anoectochilus plant from Yunnan

从左到右分别为金线兰顶芽、金线兰茎段、云南开唇兰顶芽、云南开唇兰茎段The materials form left to right are A.roxburghii’s apical buds, and stem segments, apical buds and stem segments of Anoectochilus plant from Yunnan图3 高浓度氯离子对照金线兰及云南开唇兰生长情况Fig.3 Growing conditions of A.roxburghii and Anoectochilus plant from Yunnan under the control treatment of high content chlorine 30/30)
2.2 不同配比对金线兰和云南开唇兰茎段萌芽的影响
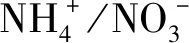

图4 金线兰茎段萌芽及生长情况Fig.4 Budding and its growing conditions of A.roxburghii’s stem segments

图5 云南开唇兰茎段萌芽及生长情况Fig.5 Budding and its growing conditions of the stem segments which is from Anoectochilus plant from Yunnan
3 结论与讨论
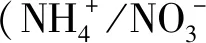
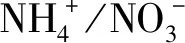
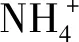
本研究发现,硝态氮和铵态氮的比例对金线兰和云南开唇兰的植株形态和叶型有较大影响,随着铵态氮浓度的增加,植株的近茎尖第1片开展叶萎缩,株高、根数及根长均有递减趋势,这可能是由于铵态氮削弱了渗透压调节功能,伴随着也降低了叶细胞膨胀率或者是根和芽的激素调节功能所导致,而小的叶面积和叶面积比可能导致铵态氮中的植物碳积累减少,因而植物长势变弱;其次,相较于硝态氮而言,处于铵态氮中的植物根和叶的呼吸作用消耗的碳源更多,用于铵态氮的吸收和同化,进而减少了植物的干物质积累,可能因此也抑制了植物的生长;第三,植物同化铵态氮所需能量比同化硝态氮所需的光合能量要少[43],这可能也是导致铵态氮中植株株型变小的原因。此外,不同氮素形态对植物生长的影响还与光照强度、培养基的温度、氮素浓度、pH值以及钾离子浓度相关[43],本研究中除氮素浓度外,其余因素在各试验组均基本相同,如果在固定的氮素浓度下,其他因素发生改变,可能得到的结果不同。

