青春双歧杆菌的耐氧驯化及不同低聚糖对其增殖效果的影响
黎雁泽 陈夏菁 张士昂 徐 磊
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
目前,多数人群处于亚健康状态,主要原因是膳食、肠道菌群失衡的共同影响[1-4],如菌群多样性降低、单一化等,便会使有害菌数量增加[5-6],菌群结构改变同样可导致机体发生免疫抑制,对环境应激能力下降,进而引发代谢问题,如便秘、过度肥胖、糖尿病、肿瘤、心血管疾病、结肠癌等[7-8]。
青春双歧杆菌作为一种益生菌,可治疗慢性腹泻、便秘,还具有抗衰老作用。可以使人体肠道内酸性增强,减少有害菌群数量,调节肠道菌群向良性方向发展[9]。青春双歧杆菌在肠道中起到了生物屏障的作用,供给营养,促进代谢[10-11];代谢产物主要是乙酸和乳酸,还可产生多种有机酸,如丙酸、异丁酸和丁酸等短链脂肪酸[12],青春双歧杆菌的代谢物和抗菌物质对致病菌有着很强的拮抗作用[13]。肠道菌群在正常情况下可以保持相对平衡,在失衡情况下功能性低聚糖可以改善肠道菌群。有研究[14]证明,持续摄入低聚糖短期内可大量繁殖益生菌并抑制有害菌,帮助肠道恢复原有平衡状态。近年来国内外学者向无害、无毒的益生菌制剂方向展开研究,目的就是为了获得能够维持肠道内菌群平衡的益生菌产品[15-16]。
青春双歧杆菌是一种严格厌氧菌,这使其在益生菌发酵产品的应用方面存在局限。目前有关青春双歧杆菌的研究主要集中在青春双歧杆菌生长条件的优化、青春双歧杆菌抑菌机理等方面,而对青春双歧杆菌耐氧驯化前后生理特性的变化及其对青春双歧杆菌增殖因子的影响等方面的研究还未见报道。试验拟以青春双歧杆菌(ATCC 15703)为出发菌种,通过对驯化前后青春双歧杆菌各项指标的测定和不同低聚糖对青春双歧杆菌增殖效果的影响,探讨青春双歧杆菌在耐氧驯化前后的变化情况,旨在为青春双歧杆菌的进一步开发利用提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种来源
青春双歧杆菌(ATCC15703):中国微生物菌种保藏管理委员会普通微生物中心。
1.1.2 试剂及培养基
蛋白胨、牛肉浸粉、酵母浸粉、MRS培养基:青岛海博生物技术公司;
低聚木糖、木聚糖、D-木糖、半胱氨酸盐酸盐:北京陆桥生物技术公司;
葡萄糖、磷酸氢二钾、柠檬酸氢二胺、乙酸钠、硫酸镁、硫酸锰、吐温80、NaOH、HCl等:分析纯,天津大茂化学试剂厂;
CMRS培养基:在MRS培养基中加入0.01%的半胱氨酸盐酸盐制得;
改良MRS培养基:基于MRS培养基用大豆低聚糖、低聚麦芽糖、低聚木糖分别等量代替MRS培养基中的葡萄糖而制得。
1.1.3 仪器设备
紫外—可见光分光光度计:A360型,上海翱艺仪器有限公司;
立式压力蒸汽灭菌器:LDZM-80KCS型,上海甲安医疗器械厂;
电热恒温培养箱:DNP-9052型,上海精宏实验设备有限公司;
电热恒温培养箱:DHG-9145A型,上海一恒科学仪器有限公司;
离心机:H1650-W型,长沙湘仪离心机仪器有限公司;
厌氧培养箱:YQX-Ⅱ型,上海新苗仪器有限公司;
厌氧培养盒:2.5 L,日本三菱气体化工有限公司;
pH计:PHS-C型,上海仪电科学仪器股份有限公司;
高效液相色谱:U3000型,赛默飞世尔科技(中国)有限公司。
1.2 试验方法
1.2.1 青春双歧杆菌的活化 将厌氧青春双歧杆菌在MRS培养基中活化,37 ℃厌氧培养48 h,之后继续在厌氧条件下连续传3代,活化后的青春双歧杆菌进行耐氧驯化。
1.2.2 青春双歧杆菌的驯化 将活化后的青春双歧杆菌先在厌氧条件下连续传代,而后通过逐步增加液体培养基中的氧分压,使青春双歧杆菌渐渐适应有氧环境。具体操作:取存于螺口试管液深10 cm的CMRS培养基,接种10 μL青春双歧杆菌菌液,37 ℃下厌氧培养24 h;取菌液10 μL接种于液深16 cm的MRS培养基,37 ℃下有氧培养24 h;之后取菌液10 μL接种于液深10 cm的CMRS培养基,37 ℃下厌氧培养24 h;再取菌液10 μL接种于液深13 cm的MRS培养基,37 ℃下有氧培养24 h;之后取菌液10 μL接种于液深10 cm的CMRS培养基,37 ℃下厌氧培养24 h;再取菌液10 μL接种于液深10 cm的MRS培养基,37 ℃下有氧培养24 h;如此反复5次,最后将有氧培养下液深10 cm的MRS培养基连续传代培养,得耐氧驯化青春双歧杆菌。
1.2.3 菌株特性检测
(1) 革兰氏染色和镜检:参考张苓花等[17]的方法,对驯化过程中的青春双歧杆菌采用革兰氏染色法和镜检,观察菌体的大小、颜色、分叉状态等是否符合双歧杆菌属的基本形态特征。
(2) 青春双歧杆菌菌液吸光度的测定:用紫外—可见分光光度计在600 nm波长下测定青春双歧杆菌菌液吸光度,记录青春双歧杆菌驯化过程中吸光度的变化情况。
(3) 测定青春双歧杆菌菌液pH值:用pH计对青春双歧杆菌驯化过程中的pH值进行测定。
(4) 青春双歧杆菌的菌体形态和16S rRNA测序鉴定:对青春双歧杆菌进行革兰氏染色并镜检,观察驯化前后的菌体形态变化,同时对其16S rRNA基因进行PCR扩增[18],扩增后的产物进行测序和对比分析。
1.2.4 菌液有机酸含量测定 取驯化前后青春双歧杆菌培养液,10 000×g离心5 min,取上清液,过0.22 μm滤膜后进样,色谱柱为syncronis C18,Dim 250 mm×4.6 mm,5 μm,梯度淋洗程序共持续30 min,前10 min和后3 min的流动相为2%的乙腈和98%的磷酸二氢钾水溶液(流速0.5 mL/min),10~27 min时流动相为20%的乙腈和80%的磷酸二氢钾水溶液(流速0.8 mL/min),柱温30 ℃,在210 nm波长下检测吸收峰[19]。
1.2.5 还原糖含量测定 采用DNS比色法,在紫外分光光光度计560 nm波长下作出葡萄糖标准曲线,根据标准曲线求得青春双歧杆菌培养液中还原糖的含量[20]。
2 结果与分析
2.1 耐氧驯化前后青春双歧杆菌的吸光度和pH值
2.1.1 菌液吸光度 由表1可以看出,驯化前的青春双歧杆菌在有氧培养条件下OD600 nm不足0.10,而在厌氧条件下OD600 nm可达1.75。经5次耐氧驯化后,青春双歧杆菌菌液吸光度值达到了1.07,说明较驯化前青春双歧杆菌菌数有大幅度提升。同时,有氧培养和厌氧培养下菌液的吸光度值之比不断增大,表明在驯化过程中青春双歧杆菌的耐氧能力也在不断提升。
2.1.2 pH值 在循环驯化过程中,随着传代次数的增加,菌液pH值不断下降,青春双歧杆菌的耐酸能力也在不断提升,从表1可以看出在驯化结束前菌液pH值已经稳定至4.5附近,这有助于青春双歧杆菌作为益生菌通过胃部酸性环境,从而作用于肠道,并且驯化后的耐氧青春双歧杆菌可为发酵食品的生产提供优良菌株。
表1青春双歧杆菌驯化过程中吸光度和pH值的变化情况
Table1ChangesofabsorbanceandpHvalueintheacclimatedprocessofB.adolescentis
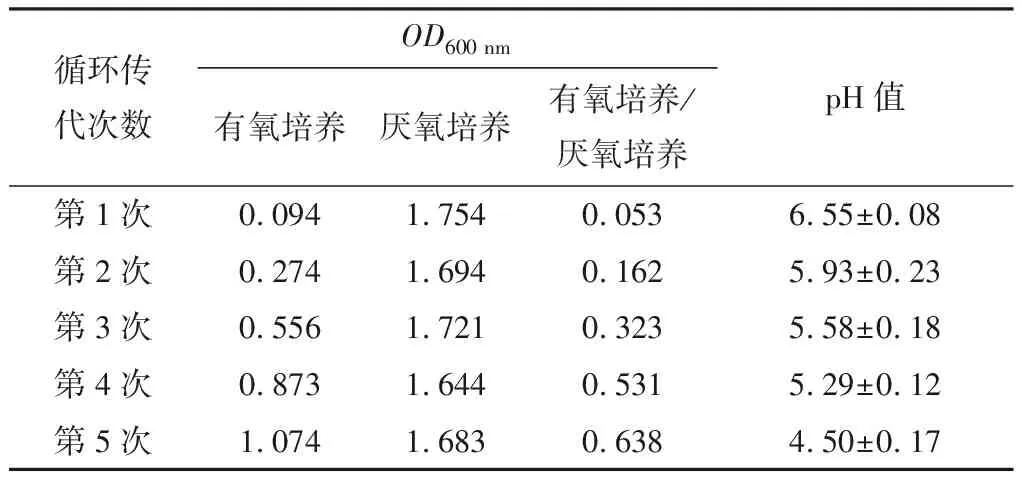
循环传代次数OD600 nm有氧培养厌氧培养有氧培养/厌氧培养pH值第1次0.0941.7540.0536.55±0.08第2次0.2741.6940.1625.93±0.23第3次0.5561.7210.3235.58±0.18第4次0.8731.6440.5315.29±0.12第5次1.0741.6830.6384.50±0.17
2.2 耐氧驯化前后青春双歧杆菌形态特征的比较
耐氧驯化前后青春双歧杆菌的菌落和菌体形态对比结果如表2和图1、2所示,可以看出青春双歧杆菌在耐氧驯化前后的形态保持一致,且驯化前后菌体的16S rRNA 基因序列一致,可以确定青春双歧杆菌菌株在耐氧驯化后未发生变异。
2.3 驯化前后青春双歧杆菌菌液中的有机酸含量
厌氧菌的培养一般以糖类或醇类为碳源,在青春双歧杆菌的生长代谢中,会将碳源分解成乳酸、乙酸、丙酸、丁酸等有机酸,因此,研究测定耐氧驯化前后青春双歧杆菌代谢不同有机酸含量的变化情况。图3为乳酸、乙酸、丙酸、丁酸混合标准品的紫外吸收峰谱图,图4、5分别为耐氧驯化前后青春双歧杆菌代谢有机酸吸收峰谱图。对比图3~5可以看出,驯化前后青春双歧杆菌代谢产生的乳酸、乙酸、丙酸、丁酸的出峰时间符合标准品出峰时间,确定青春双歧杆菌驯化前后有机酸种类无显著变化。
表2耐氧驯化前后青春双歧杆菌菌体形态特征
Table2MorphologicalcharacteristicsofB.adolescentisbeforeandafteraerobicdomestication

培养条件镜检形态菌落形态革兰氏染色厌氧多为棒状杆菌,有Y型、V型,两端不规则乳白色或白色、不透明、圆形、边缘完整阳性有氧体积较厌氧培养时小、菌体较短、两端规则乳白色或白色、菌落较小、不透明、圆形、边缘完整阳性

图1 耐氧驯化前青春双歧杆菌菌体形态

图2 耐氧驯化后青春双歧杆菌菌体形态
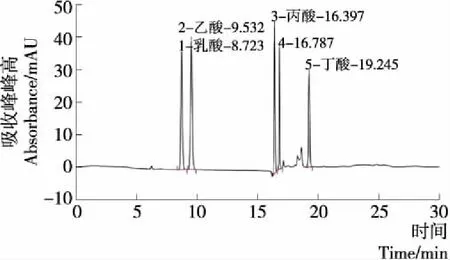
图3 4种有机酸标准品色谱图
根据各标准品峰面积绘制标准曲线,根据标准曲线计算有机酸含量,结果如表3所示。由表3可以看出,驯化后青春双歧杆菌代谢乙酸和乳酸的含量下降幅度较大,丙酸含量变化不明显。经耐氧驯化后,青春双歧杆菌代谢的4种有机酸总量下降,而乙酸与乳酸的摩尔数之比上升,青春双歧杆菌生长的最佳摩尔比为2.0~4.0[17],而驯化后的青春双歧杆菌代谢乙酸与乳酸摩尔比为3.74,在最佳范围之间,有利于青春双歧杆菌的生长繁殖,在发酵食品的生产方面具有一定优势。

图4 驯化前青春双歧杆菌不同有机酸色谱图

图5 驯化后青春双歧杆菌不同有机酸色谱图
表3青春双歧杆菌驯化前后有机酸含量
Table3ContentoforganicacidsbeforeandafterthedomesticationofB.adolescentisg/L

青春双歧杆菌乳酸乙酸丙酸丁酸驯化前8.759.200.271.96驯化后1.294.840.240.47
2.4 不同低聚糖对驯化前后青春双歧杆菌增殖效果的影响
2.4.1 青春双歧杆菌在不同低聚糖培养基中OD600 nm和pH 青春双歧杆菌在3种低聚糖培养基中的OD600 nm值和pH值如表4所示,总体上驯化后比驯化前OD600 nm值稍有下降,主要是由于青春双歧杆菌为专性厌氧菌,虽然经过耐氧驯化但生长状况和厌氧培养下的菌株仍存在差距;驯化后比驯化前pH值降低,主要源于耐氧驯化的青春双歧杆菌提高了自身的耐酸、产酸能力。并且低聚木糖培养基中的青春双歧杆菌生长情况和产酸能力均强于大豆低聚糖、低聚麦芽糖培养基中的。
表4青春双歧杆菌在不同低聚糖培养基中吸光度和pH的变化情况
Table4ChangesintheabsorbanceandpHofB.adolescentisindifferentoligosaccharidecultures

低聚糖OD600 nm驯化前驯化后pH驯化前驯化后大豆低聚糖1.0230.7295.034.59低聚木糖 1.5351.1785.744.26低聚麦芽糖0.6470.4335.284.83
2.4.2 驯化前后青春双歧杆菌在不同低聚糖培养基中的还原糖含量 通过DNS比色法绘制葡萄糖标准曲线,将试验中测得的OD560 nm值,代入葡萄糖标准曲线方程(y=0.012 5x-0.139 3,R2=0.995 2)计算葡萄糖含量,在3种低聚糖培养基中青春双歧杆菌菌液还原糖含量如表5。
表5驯化前后青春双歧杆菌在不同低聚糖培养基中还原糖含量
Table5ReducingsugarcontentofB.adolescentisindifferentoligosaccharideculturesbeforeandafterdomestication g/L

低聚糖种类驯化前驯化后大豆低聚糖13.33215.692低聚木糖 7.4928.612低聚麦芽糖16.49217.852
从表5中也可以看出:在低聚木糖培养基中青春双歧杆菌生长后,菌液还原糖含量最低,碳源利用率最高,由此可知低聚木糖是良好的促双歧杆菌生长因子。龚芳红等[21]研究表明人体每天食用0.7 g低聚木糖17 d后,双歧杆菌所占比例由8.5%提高到17.9%,21 d后提高到26.2%;徐海燕等[22]研究了低聚木糖对双歧杆菌及肠道菌群生长的影响,结果表明,低聚木糖是对青春双歧杆菌有明显增殖效果的低聚糖,同时也印证了Crittenden等[19]比较多种低聚糖对厌氧菌发酵特性的研究。不同低聚糖对双歧杆菌都有着一定的增殖效果,但低聚木糖是其中最优良的一种,适合作为双歧因子。
3 结论
试验探讨了青春双歧杆菌的耐氧驯化及低聚糖对青春双歧杆菌增殖的影响,通过改变氧分压,逐步提高青春双歧杆菌对氧气的耐受力。同时培养基中添加低聚糖可以对青春双歧杆菌的增殖起到促进作用;驯化后的青春双歧杆菌在有氧条件下生长能力达标,产酸能力得到提升,菌体驯化前后形态一致,耐氧青春双歧杆菌代谢产生的乙酸与乳酸比值较厌氧青春双歧杆菌更适宜发酵,因此,耐氧青春双歧杆菌特性良好。后续可进一步对多种低聚糖共同影响青春双歧杆菌的增殖效应,以及改善耐氧青春双歧杆菌生长条件进行研究。

