3株酿酒酵母发酵过程中有机酸含量变化分析
裴芳艺 姜 明 马岩石 陈 雪 刘振艳 刘 溪 陈晓婷
(齐齐哈尔医学院科研处卫生检验中心,黑龙江 齐齐哈尔 161000)
酵母菌是人类文明史上利用最早的微生物,为兼性厌氧菌,其中属酿酒酵母(Saccharomycescerevisiae)利用得最为普遍[1]。S.cerevisiae又称面包酵母或者出芽酵母,是一种公认的与人类关系最广泛的GRAS(Generally Regarded As Safe)微生物,广泛用于制作面包和馒头等食品,在工业生产中,主要应用于发酵谷类酿造酒类[2-4]。
不同的S.cerevisiae种因其独特的代谢方式直接影响发酵过程中有机酸的分泌,而有机酸是发酵食品中酸味的重要组成部分,与发酵食品的质量评价和品质管理有着密切的关系[5-6]。对酸味起主要作用的有机酸为柠檬酸、乳酸、乙酸等[7],其中柠檬酸有清爽宜人的味道,给人一种持续的味觉刺激,柠檬酸含量越高,风味越好[8]。总酸含量偏高,会出现口感粗糙、不协调;总酸含量偏低则会出现口感黏稠、不爽口;适宜的总酸,能够赋予酿造食品尤其是酒精饮料的平衡协调、柔和清爽、活泼的口感[9-10]。由于有机酸种类、含量及其比例关系对酿造食品的风味、pH值等都有重要的影响[11]。目前对于发酵食品中有机酸的研究主要集中在乳酸菌等益生菌上[12],并未对S.cerevisiae发酵过程中有机酸含量变化进行研究。此外,当前的研究焦点是利用基因工程手段提高乙醇[13]、2,3-丁二醇等醇类物质产量[14],忽略了酵母菌有机酸代谢途径的研究,及其在食品、酒精饮料中的作用。
有机酸及代谢产物的分析方法有气相色谱法(Gas chromatography, GC)、高效液相色谱法(High performance liquid chromatography, HPLC)及核磁共振法(Nuclear magnetic resonance, NMR)。其中,GC法在挥发性代谢产物的研究方面具有一定的优势,然而操作过程中需要对样品进行衍生化处理,使得产物大量损失。NMR由于价格昂贵,分析较复杂,在常规检测中应用较少。HPLC因其操作简便,检测灵敏,是目前有机酸及食品风味物质研究的主要手段。因此,试验拟利用HPLC对3株S.cerevisiae发酵过程中葡萄糖、甘油、乙醇及有机酸含量进行测定分析,力求找寻能够提高食品、酒类产品风味品质的优势菌株,为酵母菌代谢途径研究提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
S.cerevisiae1946(CICC 1946)、S.cerevisiae32788(CICC 32788):中国工业微生物菌种保藏管理中心(CICC);
S.cerevisiaeP1:实验室自行分离。
1.1.2 试剂
硫酸:色谱纯,天津科密欧有限公司;
无水柠檬酸、α-酮戊二酸、琥珀酸、L-乳酸、甲酸、乙酸标准品:色谱纯,上海源叶生物科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖琼脂培养基(YPD)(货号HB5193)、YPD液体培养基(货号HB5193-1):青岛海博生物技术有限公司。
葡萄糖单碳源发酵培养基:葡萄糖80 g,酵母提取物5 g,(NH4)2SO42.5 g,KH2PO42.5 g,MgSO4·7H2O 0.25 g,无水CaCl20.25 g,蒸馏水1 L,调pH至5.0,108 ℃ 高压湿热灭菌20 min,用于S.cerevisiae发酵培养。
1.1.4 仪器与设备
高效液相色谱仪:WatersTMe2695型,美国Waters公司;
高速离心机:5804R型,上海艾研生物科技有限公司;
生化培养箱:BSP-400型,上海博讯有限公司;
往复式恒温震荡水域培养摇床:SPH-110X12型,上海世平实验设备有限公司。
1.2 方法
1.2.1 菌株活化 将甘油管保藏的菌株S.cerevisiae1946、S.cerevisiae32788和S.cerevisiaeP1分别接种于20 mL YPD液体培养基中,30 ℃、140 r/min振荡培养24 h,活化菌株。将活化后的菌液分别三区划线于YPD固体平板上,30 ℃、静置培养48 h。连续传代培养3代后,挑取生长状况优良的单菌落分别接种于100 mL/250 mL YPD液体培养基中,制备种子液。
1.2.2 制备发酵液 将种子液以5 mL/100 mL的接种量接种于葡萄糖单碳源发酵培养基中,30 ℃、200 r/min培养60 h,每隔6 h取适量发酵液,待测。
1.2.3 高效液相色谱分析 AminexHPX-87H有机酸分析柱(300 mm×7.8 mm;Bio-Rad;Hercules)。流动相:0.005 mol/L H2SO4,流速0.6 mL/min,进样量20 μL,柱温35 ℃,检测波长210 nm。配置不同浓度标准品(0.2,0.4,0.6,0.8,1.0,1.2 g/L),取稀释后标准品1 mL,13 000 r/min 离心10 min后取上清液,过0.22 μm滤膜后进样,进样量20 μL/针,测定得到相应浓度的峰面积与出峰时间,以浓度为横坐标,峰面积为纵坐标绘制标准曲线。取发酵液1 mL进行梯度稀释100倍,13 000 r/min离心10 min后取上清液,过0.22 μm滤膜后进样,进样量20 μL/针,根据各组分出峰面积和标准曲线,计算各组分含量。
1.3 数据处理
每个试验重复3次,结果以(均值±标准差)表示,统计检验的显著水平设定为0.05。利用JMP(Version 9.0.2,SAS,Inc)软件进行方差分析及多重比较,并用Sigmaplot(Version 10.0,Systat Software,Inc)软件绘图。
2 结果与分析
2.1 标准溶液的色谱分析及回归方程
通过HPLC色谱图可知标准品出峰效果良好,按照出峰时间顺序依次为柠檬酸(7.6 min)、α-酮戊二酸(8.0 min)、葡萄糖(8.6 min)、丙酮酸(9.0 min)、苹果酸(10.9 min)、琥珀酸(11.4 min)、L-乳酸(12.0 min)、甘油(12.9 min)、甲酸(13.4 min)、乙酸(14.6 min)、乙醇(21.4 min)。以进样量(mg/mL)为横坐标,峰面积(mAU·min)为纵坐标,绘制标准曲线,进行线性回归,建立回归方程,如表1所示。由表1可知,相关系数符合试验预期要求(R2>0.99),表明该色谱工作条件测定性能稳定、重现性高。
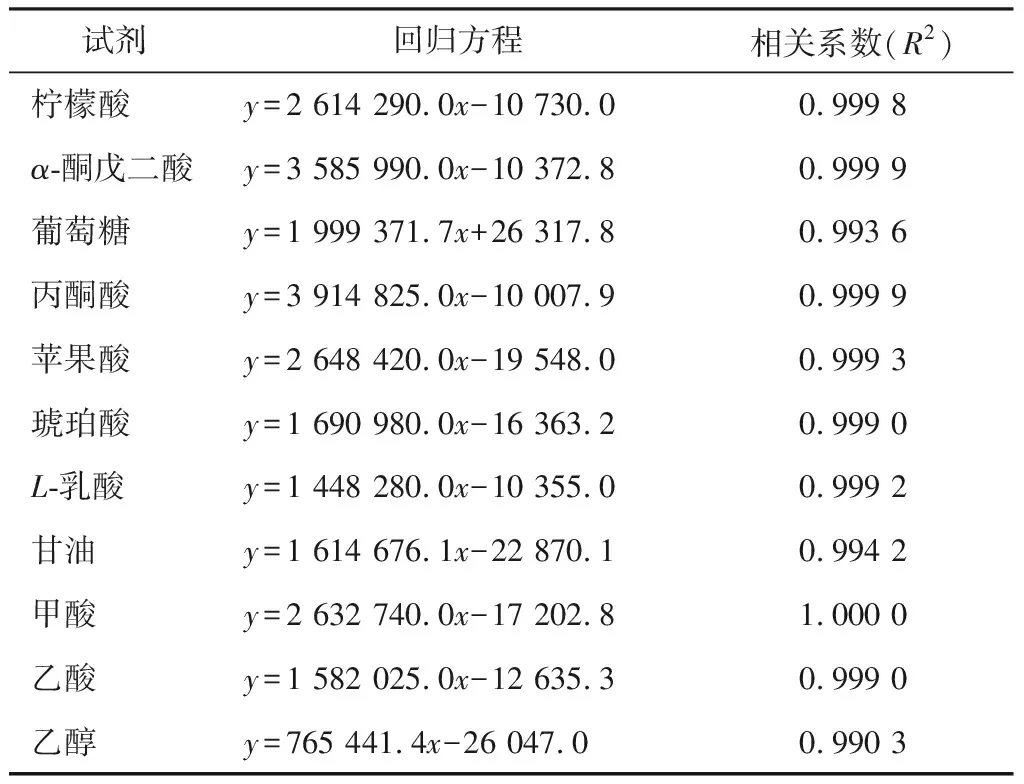
表1 各种试剂的回归方程及相关系数
2.2 葡萄糖、甘油和乙醇含量变化
2.2.1 葡萄糖 由图1可知,随着发酵的进行葡萄糖被不断消耗,在发酵12 h时,葡萄糖均被消耗殆尽。在发酵6 h时,3种发酵体系中葡萄糖的剩余量分别为(10.01±2.50)(S.cerevisiaeP1),(5.73±0.71)(S.cerevisiae1946),(8.54±0.93)(S.cerevisiae32788) g/L,S.cerevisiae1946对葡萄糖的利用速度大于S.cerevisiae32788和S.cerevisiaeP1。

图1 3株S. cerevisiae发酵体系中葡萄糖含量变化曲线
2.2.2 甘油 由图2可知,随着葡萄糖的不断消耗,菌体大量繁殖,甘油呈现先急速上升后保持稳定的趋势。在整个发酵过程中(除发酵24 h外),S.cerevisiae1946发酵体系中甘油的含量显著高于S.cerevisiae32788和S.cerevisiaeP1发酵体系(P<0.05),而S.cerevisiae32788和S.cerevisiaeP1发酵体系中甘油的含量无显著差异(P>0.05)。在发酵末期,3种发酵体系中甘油的含量分别为(3.25±0.14)(S.cerevisiaeP1),(3.51±0.03)(S.cerevisiae1946),(3.30±0.10)(S.cerevisiae32788) g/L。甘油作为中性代谢物质在维持细胞内外渗透压均衡的基础上,起到调节氧化还原的作用[15-16]。
2.2.3 乙醇 由图3可知,随着发酵的进行乙醇的含量呈现先急速上升后略有下降最后保持平稳的趋势。在发酵24 h时,乙醇含量最高,在3个发酵体系中分别为(32.85±0.54)(S.cerevisiaeP1),(35.82±0.67)(S.cerevisiae1946),(32.00±2.64)(S.cerevisiae32788) g/L。从整个发酵过程来看,在S.cerevisiae1946发酵体系中,乙醇的含量始终高于S.cerevisiae32788和S.cerevisiae1946发酵体系。在发酵末期,S.cerevisiae1946发酵体系中乙醇的含量最高,为(29.88±1.28) g/L。相较于S.cerevisiaeP1和S.cerevisiae32788,S.cerevisiae1946可以有效地将葡萄糖转化成乙醇。

图2 3株S. cerevisiae发酵体系中甘油含量变化曲线
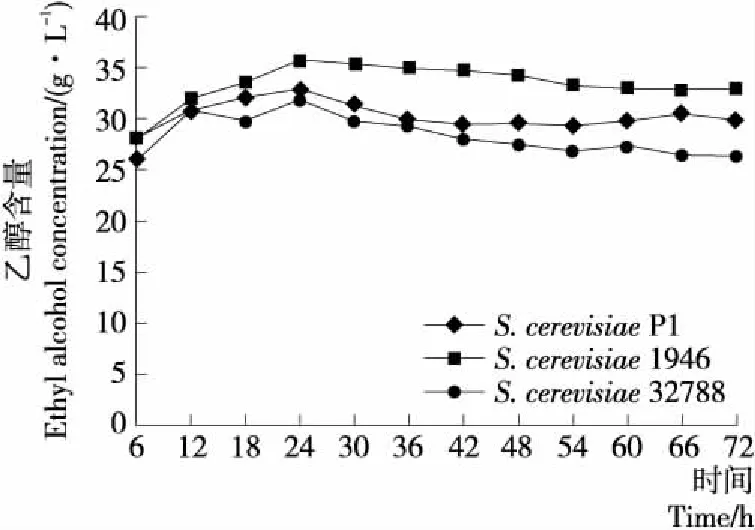
图3 3株S. cerevisiae发酵体系中乙醇含量变化曲线
综上研究表明,酵母菌在发酵过程中将α-酮戊二酸、丙酮酸和乳酸逐渐转化为乙醇代谢中间产物,随着发酵时间的延长,乙醇和甘油的浓度逐渐增加。在发酵后期,由于营养物质消耗殆尽,酵母菌生长代谢活性降低,导致甘油含量稳定,乙醇含量略有减少[17],与试验结果相符。然而,随着乙醇发酵的进行,发酵液中酒精度不断增加,较高的酒精度会抑制酵母细胞的生长[18]。因此S.cerevisiae1946虽然可以有效地代谢葡萄糖产生乙醇,但其生长状况不如S.cerevisiaeP1和S.cerevisiae32788。
2.3 有机酸含量变化
2.3.1 有机酸总量 由图4可知,随着发酵的进行有机酸含量呈现先升高后保持平稳的趋势,而在S.cerevisiae1946发酵体系中,有机酸的含量上升较快,在前48 h 时,始终高于S.cerevisiae32788和S.cerevisiaeP1发酵体系。发酵48 h后,S.cerevisiae1946体系中有机酸含量保持稳定,而S.cerevisiae32788和S.cerevisiaeP1体系中有机酸含量继续快速升高,在66 h时趋于稳定。在发酵末期,3种发酵体系中有机酸的含量分别为(4.05±0.02)(S.cerevisiaeP1),(2.88±0.04)(S.cerevisiae1946),(4.02±0.03)(S.cerevisiae32788) g/L。S.cerevisiae1946中有机酸的含量积累的速度大于S.cerevisiaeP1和S.cerevisiae32788发酵体系,但在发酵末期有机酸含量较低。因此可以看出,S.cerevisiaeP1可以快速地利用葡萄糖产生甘油、有机酸,但与S.cere-visiae32788和S.cerevisiaeP1相比,S.cerevisiae1946转化率较低,可能是菌株在生长代谢过程中,利用葡萄糖产生其他代谢产物。酸类物质是酒精饮料中重要的风味物质,在酒精饮料中有增加浓厚感和减少甜味的作用,但酸含量要适中,否则会影响酒精饮料的口感和风味[19]。
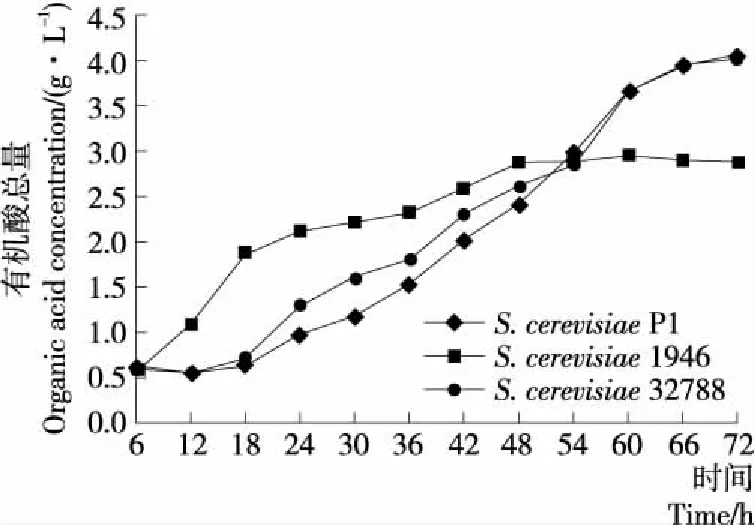
有机酸总量为每一发酵体系中各种有机酸的总量
2.3.2 各有机酸含量 由图5可知,在整个发酵过程中,共检测到7种有机酸。随着发酵的进行各有机酸含量不断升高。发酵12 h时,在S.cerevisiaeP1中,琥珀酸含量最高,为(0.18±0.05) g/L,其次为丙酮酸[(0.15±0.04) g/L];在S.cerevisiae1946中,乙酸的含量最高,为(0.52±0.01) g/L,其次为丙酮酸[(0.37±0.08) g/L];在S.cerevisiae32788中,丙酮酸的含量最高,为(0.19±0.01) g/L,其次为琥珀酸[(0.14±0.03) g/L]。此时,S.cerevisiae1946发酵体系中,无论是有机酸种类还是有机酸含量均与S.cerevisiae32788、S.cerevisiaeP1发酵体系不同。随着发酵时间的延长,S.cerevisiae1946体系中有机酸种类减少,但有机酸含量逐渐升高。在S.cerevisiaeP1体系中,乙酸、丙酮酸、琥珀酸的含量显著增加(P<0.05),柠檬酸、甲酸含量不断减少。而在S.cerevisiae32788体系中,除L-乳酸含量减少外,其余有机酸均呈不断增长的趋势。发酵72 h时,3个发酵体系中,乙酸含量最高,其次为丙酮酸;而在S.cerevisiae1946发酵体系中未检测到L-乳酸,故S.cerevisiae32788与S.cerevisiaeP1的代谢过程较为相似,不同于S.cerevisiae1946。琥珀酸是糖类和大部分氨基酸代谢过程中的重要中间产物[20]。在3个发酵体系中,琥珀酸的含量逐渐增加,发酵末期,仍保持较高水平。在S.cerevisiaeP1发酵前12 h检测到低量柠檬酸,其余发酵体系均未检测到柠檬酸,是由于S.cerevisiae在三羧酸循环中产生的柠檬酸较少,且会被S.cerevisiae利用[21]。
综上可知,S.cerevisiae32788与S.cerevisiaeP1能将丙酮酸转换成乙酸,同时伴有L-乳酸的生成,而S.cerevisiae1946则将丙酮酸转换成乙酸,并不产生乳酸。低产酸水平的酵母可促使更多的葡萄糖转化成乙酸,减少乙醇产量,酵母菌的产酸水平与产乙醇能力呈负相关关系[18]。袁文杰等[17]研究发现,发酵的主要产物为乙醇,主要副产物为乙酸、甘油和琥珀酸。乙酸是酵母菌发酵产乙醇过程中的伴生产物,其变化趋势及含量与乙醇呈正向耦合。梁璋成等[22]研究结果表明,乳酸、乙酸和琥珀酸是发酵的主要产物,其含量均随酒精发酵的进行而增加。故3株S.cerevisiae的产酸能力与产乙醇能力一一对应。
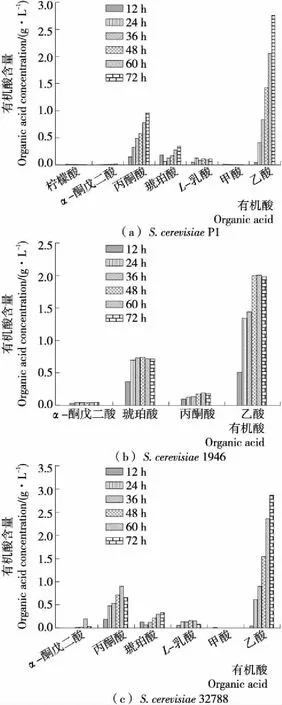
图5 3株酿酒酵母发酵过程中不同有机酸的含量变化
3 结论
利用HPLC对3株S.cerevisiae发酵过程中葡萄糖、甘油、乙醇及有机酸含量进行测定分析。结果表明:S.cerevisiae1946发酵体系中甘油、乙醇的含量显著高于S.cerevisiaeP1和S.cerevisiae32788发酵体系(P<0.05);S.cerevisiaeP1和S.cerevisiae32788发酵体系中有机酸的含量显著高于S.cerevisiae1946发酵体系(P<0.05);3个发酵体系中,乙酸的含量最高,其次为丙酮酸,S.cerevisiae的产酸水平与产乙醇能力呈负相关。故菌株S.cerevisiaeP1和S.cerevisiae32788具有应用于工业生产的潜力。下一步应重点研究S.cerevisiaeP1和S.cerevisiae32788在发酵过程中氨基酸及其他重要代谢产物的变化情况,并将菌株应用于食品或酿酒发酵,探究其发酵功能。

