牡丹花蕊醇提物对H2O2诱导HUVEC细胞
罗 磊 关宁宁 向进乐 朱文学
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023; 2. 河南省农产品干燥装备工程技术研究中心,河南 洛阳 471023)
牡丹是中国最重要的观赏花卉之一,同时具有较高的食用价值,自古就有牡丹花茶、牡丹花酒和牡丹花脯等产品,2011年3月卫生部认定凤丹牡丹为新资源食品[1]。牡丹花蕊是牡丹花的精华部分,具有很高的营养价值,周明远等[2]研究表明牡丹花蕊可提取牡丹花蕊油,其中亚油酸和亚麻酸含量远高于其他常见食用油。李朝苹等[3]研究表明牡丹花蕊水体液在体外具有较强的抗氧化性。但是目前对牡丹花蕊醇提物抗氧化作用及主要功效成分缺乏深入研究。
血管内皮细胞参与机体免疫活动,其损伤与动脉粥样硬化[4]、脑卒中、高血压[5]、冠心病和糖尿病[6-7]等疾病的发生发展有着紧密的关系。而氧化应激是造成细胞损伤的重要因素之一,所以采用H2O2诱导内皮细胞是研究抗氧化作用的重要手段之一[8-10]。傅茂润等[11]对牡丹花蕊进行了提取工艺研究,李朝苹等[3]研究了牡丹花蕊提取液的体外抗氧化功效,但关于牡丹花蕊提取物在细胞水平上的功效研究却鲜有报道。试验拟在高效液相分析其功效成分的基础上,采用H2O2诱导人脐静脉血管内皮细胞(HUVEC细胞)损伤来检测牡丹花蕊醇提物在细胞中抗氧化作用,以期为牡丹在牡丹花蕊方向上的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
牡丹花:品种为凤丹白,采摘地点为洛阳洛龙区牡丹园;
芦丁、槲皮素、山奈酚、芹菜素、芍药苷和木犀草素标准品:纯度均≥98%,上海源叶生物科技有限公司;
人脐静脉内皮细胞:上海名劲科技有限公司;
高糖培养基:美国Hyclone公司;
噻唑蓝:美国Sigma公司;
双抗、胰蛋白酶(250 NFU/mg):美国Gibco公司;
四季青胎牛血清:杭州四季青生物工程材料有限公司;
纤维素酶:50 U/mg,上海源叶生物科技有限公司;
SOD、GPX、MDA、GSH和BCA测定试剂盒:南京建成生物工程公司;
其他试剂均为分析纯。
1.2 仪器与设备
高效液相色谱仪:1260Infinity型,安捷伦科技有限公司;
双人单面净化工作台:SW-CJ-2FD型,济南启科仪器设备有限公司;
倒置显微镜:CKX41型,日本Olympus公司;
全自动酶标仪:680型,美国Bio-Rad公司;
CO2细胞培养箱:E191IR型,美国金西盟公司;
数控超声波清洗器:KQ-500DE型,南京晓晓仪器设备有限公司。
1.3 试验方法
1.3.1 牡丹花蕊醇提物的制备 采用纤维素酶—超声辅助乙醇提取法,条件:乙醇浓度70%,料液比1∶40 (g/mL),加酶量0.3%,酶解pH 5,酶解时间30 min,50 ℃ 条件下酶解后沸水浴10 min灭活,超声功率300 W,超声时间30 min,超声温度45 ℃,提取后旋蒸浓缩。牡丹花蕊提取液配置成浓度为2.0 mg/mL的上样液,以1.50 mL/min 上样流速进行D-101树脂的吸附过程,先以3.0 BV的蒸馏水以1.5 mL/min流速洗脱除杂,再以体积分数95%乙醇溶液以3.0 mL/min流速洗脱,收集乙醇洗脱液,旋蒸(温度60 ℃)至总体积的5%,真空冷冻干燥(温度约-40 ℃,冷冻时间24 h)后置于4 ℃冰箱中保存,备用。
1.3.2 牡丹花蕊醇提物的紫外光谱扫描 称取冻干后的牡丹花蕊醇提物粉末5 mg,用70%无水乙醇定容至100 mL,在波长200~700 nm的范围内,用紫外分光光度计进行光谱扫描。
1.3.3 牡丹花蕊醇提物的高效液相色谱分析
(1) 色谱条件:采用Kromasil 100-5C18(250 mm×4.6 mm,5 μm)色谱柱进行分析,以乙腈(A)和水(B)为流动相进行梯度洗脱,0~30 min,30% A→60% A,检测波长230 nm,流速0.8 mL/min,柱温30 ℃,进样量10 μL。
(2) 制作标准曲线:参考有关牡丹相关文献[12-13],试验选择6种主要的标准品作为参照,即芦丁、槲皮素、山奈酚、芹菜素、芍药苷和木犀草素。参考王金艳等[14]的方法稍作修改,配置标准混合溶液绘制标准曲线。
(3) 称取牡丹花蕊醇提物粉末4 mg,甲醇溶液定容至10 mL,超声5 min后过0.22 μm滤膜过滤,按1.3.3(1)的色谱条件进行分析。
1.3.4 牡丹花蕊醇提物的细胞试验
(1) HUVEC细胞培养:参考刘竹青等[15]的方法配置DMEM培养基,在CO2的细胞培养箱中培养细胞,并定时更换培养液。
(2) HUVEC氧化损伤模型的建立:参考罗磊等[16]的方法并稍作调整,将细胞密度为2.0×105个/mL的HUVEC细胞接种于细胞培养板。配置不同浓度梯度的H2O2溶液(0~1 mmol/L)作用于HUVEC细胞,采用MTT法检测细胞存活率。依据式(1)计算细胞存活率。

(1)
式中:
A——细胞存活率,%;
A0——空白组的吸光度均值;
A1——不同浓度H2O2组的吸光度均值。
(3) 药物浓度剂量的筛选:筛选过程同氧化损伤模型建立过程相似,配置不同浓度的牡丹花蕊醇提物培养液(0~1 mg/L)作用于HUVEC细胞,采用MTT法[17]检测并计算细胞存活率。
(4) HUVEC细胞内抗氧化物酶的测定:参考卞梦瑶等[17]的方法并稍作调整,将细胞接种于6孔板中,每孔2.0 mL,培养24 h贴壁后,吸弃细胞培养液。空白组和模型组加入2.0 mL培养基;低、中、高组分别加入2.0 mL不同质量浓度的牡丹花蕊醇提液(100,300,500 μg/mL);对照组加入2.0 mL浓度为500 mg/mL的 VC培养液,置于培养箱中培养。24 h后吸弃上清液,每孔加入800 mmol/L 的H2O2溶液2.0 mL,置于培养箱中培养4 h 后将细胞和细胞培养液分离。参照SOD、GPX、GSH、MDA和BCA试剂盒的操作说明,以BCA试剂盒检测结果为基础,测定细胞及细胞培养液中SOD和GPX活性以及GSH和MDA的含量。
1.4 数据统计

2 结果与分析
2.1 牡丹花蕊醇提物的成分分析
2.1.1 紫外光谱扫描结果 大多数黄酮类化合物的紫外吸收光谱中有两个特征吸收峰带,300~400 nm的吸收带为带Ⅰ,240~280 nm的吸收带为带Ⅱ[18]。如图1所示,牡丹花蕊醇提物溶液经过紫外光谱扫描之后在277 nm处出现了特征峰带Ⅱ,在365 nm处出现了特征峰带Ⅰ。说明牡丹花蕊醇提物的紫外光谱扫描结果符合黄酮类化合物的特征光谱反应。

图1 牡丹花蕊醇提物的紫外可见吸收光谱
2.1.2 HPLC分析 表1为6种标准品的标准曲线,且在0.05~0.40 mg/mL时与峰面积呈良好的线性关系。图2为黄酮混合标准溶液与牡丹花蕊醇提物溶液的HPLC图。图2(b)中出现的3个较为明显的色谱峰,分别为峰1、峰2和峰4,且与图2(a)中的峰1、峰2和峰4相对应,保留时间基本相同。图2(b)中保留时间在7.31 min 的峰以及保留时间在11.66 min的峰在图2(a)中无对应保留时间的峰。经分析,牡丹花蕊醇提物中主要含有芦丁、槲皮素和芍药苷3种单体,且含量分别为44.25%,17.00%,15.50%,所以纯化后的牡丹花蕊醇提物的浓度约为76.75%。

表1 6种标准品的标准曲线
2.2 牡丹花蕊醇提物的细胞抗氧化试验
2.2.1 H2O2浓度的筛选 由图3可知,H2O2浓度在0~600 μmol/L时,对HUVEC 无明显的抑制作用(P>0.05)。当H2O2浓度为800 μmol/L时,HUVEC细胞存活率为52.05%。H2O2浓度过高可能会导致细胞过量死亡,而浓度过低又会因细胞代数不同等因素而不能对细胞产生明显的抑制作用,故H2O2浓度选择800 μmol/L 为宜。
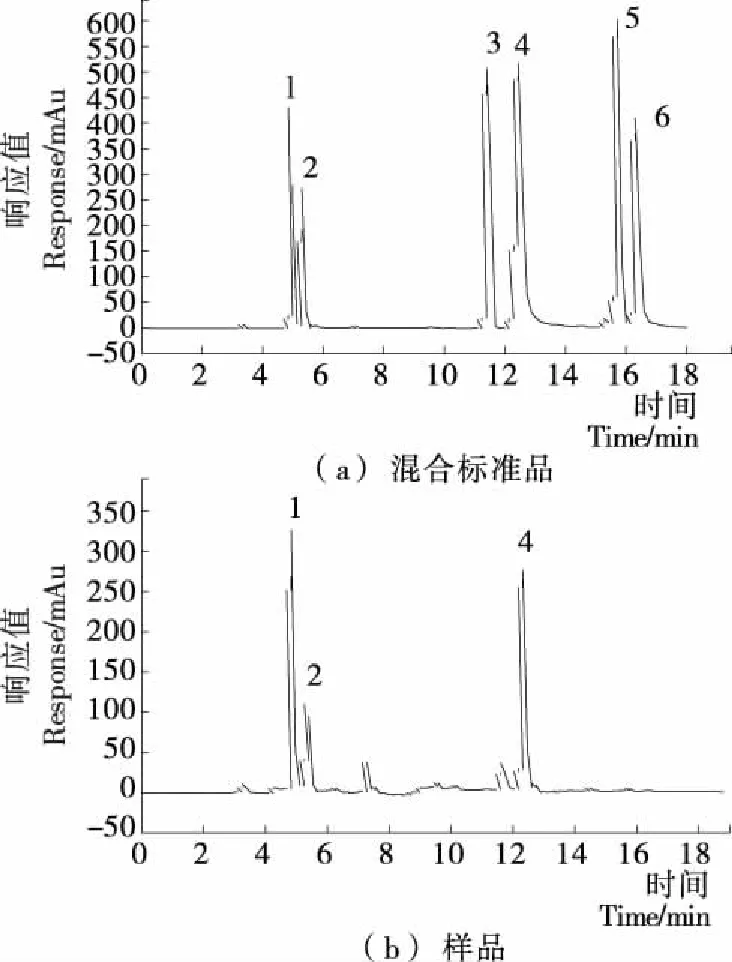
1. 芦丁 2. 芍药苷 3. 木犀草素 4. 槲皮素 5. 芹菜素 6. 山奈酚
图2 混合黄酮标准品和样品的HPLC图
Figure 2 HPLC chromatogram of the mixture of flavone standards and sample

小写字母不同表示组间差异显著(P<0.05)
2.2.2 牡丹花蕊醇提物浓度选择 如图4所示,浓度在100~500 μg/mL时牡丹花蕊醇提物对HUVEC细胞的生长无显著影响(P>0.05)。浓度>500 μg/mL时,显著抑制增殖(P<0.05)。研究[19]表明当血管内皮细胞受损时会增加动脉硬化的可能性,所以,选择牡丹花蕊醇提物剂量为100,300,500 μg/mL来进行下一步试验。
肿瘤的生长和转移与血管生成关系密切,所以抑制血管生成是研究抗肿瘤的重要机制之一。图4表明,当牡丹花蕊醇提物浓度>500 μg/mL时对HUVEC细胞有抑制作用,说明牡丹花蕊醇提物中可能含有某种血管生成抑制因子。

小写字母不同表示组间差异显著(P<0.05)
2.2.3 牡丹花蕊醇提物对HUVEC细胞及培养液中SOD活性的影响 超氧化物歧化酶是机体内重要的自由基清除剂,能够清除胞内过量ROS从而维持细胞内的稳定性[20]。图5表明,细胞中模型组SOD含量为156.5 U/mg,剂量组SOD含量均显著提高(P<0.05),均在200.0 U/mg以上。说明当细胞受损时,细胞内的自由基含量增加,SOD含量下降,而牡丹花蕊醇提物能够提高细胞抗自由基攻击的能力,提高细胞内SOD水平。
高剂量组含量为269.5 U/mg,对照组含量为275.9 U/mg,两者差异无统计学意义(P>0.05)。说明高剂量的牡丹花蕊醇提物的抗氧化性可达到VC水平。细胞培养液中SOD含量变化与细胞一致,中、低剂量组之间的差异无统计学意义(P>0.05)。

小写字母不同表示组间差异显著(P<0.05)
2.2.4 牡丹花蕊醇提物对HUVEC细胞及培养液中GSH含量的影响 谷胱甘肽能够清除O2-和H2O2,能够与自由基等有害物质相结合转为无害物质排出体外,减少机体氧化损伤[21]。图6表明,细胞中模型组的浓度为5.90 mg/g,剂量组GSH含量分别为10.70,21.01,36.80 mg/g,含量显著升高。说明牡丹花蕊醇提物能够提高细胞内GSH的含量,从而降低自由基的含量,避免细胞损伤。高剂量组的GSH含量与对照组相比,差异不显著(P>0.05),说明高剂量的牡丹花蕊醇提物在细胞内具有很强的抗氧化性。培养液与细胞中GSH的含量变化一致,细胞及培养液中的低、中、高剂量组间均有显著差异,说明抗氧化能力与浓度存在剂量依赖效应。
2.2.5 牡丹花蕊醇提物对HUVEC细胞及培养液中GPX活性的影响 谷胱甘肽过氧化物酶是一种能够催化H2O2分解的酶,将H2O2还原成水,而自身转化为氧化型谷胱甘肽,而氧化型谷胱甘肽可以在还原酶的作用下转化为GSH,GSH通过清除过量的自由基来维持细胞活性[22-23]。如图7所示,细胞中牡丹花蕊醇提物组将模型组中GPX的含量从57.79 mg/L提高到了150.00 mg/L 以上,培养液中,GPX的含量从6.90 mg/L提高到了15.00 mg/L 以上,差异显著(P<0.05)。说明牡丹花蕊醇提物能够提高细胞内GPX的活性,使其催化H2O2水解,增加GSH含量,提高细胞的抗氧化应激的能力。剂量组中GPX的活性变化也表明花蕊醇提物的抗氧化能力与浓度存在剂量依赖效应。培养液中GPX的含量与细胞中含量变化一致。

小写不同字母表示组间差异显著(P<0.05)

小写字母不同表示组间差异显著(P<0.05)
2.2.6 牡丹花蕊醇提物对HUVEC细胞及培养液中MDA含量的影响 不饱和脂肪酸因自由基攻击发生氧化,机体的脂质过氧化产物丙二醛就会升高,丙二醛的存在会加速细胞膜的衰老[24-25]。如图8所示,细胞中模型组的MDA含量为32.38 mol/mg,远高于空白组的5.93 mol/mg,说明当细胞受到氧化损伤时,细胞内的脂质过氧化反应增多,细胞膜的功能性降低。与模型组相比,低、中、高剂量组显著抑制了H2O2引起的MDA含量的增加(P<0.05),说明牡丹花蕊醇提物能够清除自由基,减少细胞内脂质过氧化物的产生。高剂量组的MDA含量低于对照组的,说明高剂量的牡丹花蕊醇提物对于降低细胞内MDA含量的作用,可能高于抗坏血酸。细胞液中MDA含量变化与细胞中MDA含量变化一致。
周艳峰等[26]研究表明,芦丁在对人晶状体上皮细胞氧化损伤的保护作用,主要与减少ROS的生成有关,其中SOD、MDA和GSH的变化情况与试验一致。宋献美等[27]研究表明芍药苷对H2O2诱导的HUVEC损伤具有明显的保护作用,可通过抑制HUVEC细胞间黏附因子ICAM-1的表达[28],从而抑制细胞损伤。Shokoohinia等[29]和 Daubney等[30]研究表明槲皮素可通过减少ROS的形成来保护神经细胞PC12和心肌细胞H9c2。褚韦韦等[31]研究表明槲皮素够增强细胞内的还原系统,增加GPX1、SOD2及GSH的水平,降低氧化应激所带来的损伤。而试验结果表明,牡丹花蕊醇提物主要成分为芦丁、槲皮素和芍药苷,含量分别达到44.25%,15.50%,17.00%,总含量为76.75%。芦丁、槲皮素和芍药对细胞内SOD和GPX等抗氧化物酶活性的提高和对细胞的保护作用,与牡丹花蕊醇提物对细胞的保护机制一致,因此,芦丁、槲皮素和芍药苷可能是牡丹花蕊醇提物产生较强抗氧化作用的主要成分。

小写字母不同表示组间差异显著(P<0.05)
3 结论
细胞抗氧化试验表明,H2O2能够造成细胞膜的损伤,对HUVEC细胞中的SOD和GPX等抗氧化物酶活性具有抑制作用,造成脂质过氧化物MDA含量上升,GSH含量下降。当不同浓度的牡丹花蕊醇提物作用于HUVEC细胞后,细胞中SOD和GPX活性以及GSH的含量均有不同程度的提高,而且细胞中MDA含量也显著降低。说明牡丹花蕊醇提物能够提高细胞中各种抗氧化物酶的活性,减少脂质过氧化反应的发生,保护HUVEC细胞完整且提高细胞抗氧化性。这一结论与马静静等[25]的研究结论一致,说明通过抑制细胞间黏附因子的表达可能也是牡丹花蕊醇提物其发挥抗氧化性的途径之一。
牡丹花蕊醇提物纯化后主要所含芦丁、槲皮素和芍药苷3种单体,三者可能是牡丹花蕊醇提物产生较强抗氧化作用的主要成分,但3种单体成分发挥抗氧化作用的主要机制和途径却尚不清楚。牡丹花蕊中3种单体成分的分离纯化及其功效研究将是下一步的研究方向。

