糖基化改性对酪蛋白酶解产物抗氧化活性的影响
赵玉滨 穆秋霞 曲柳青 崔素萍
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
美拉德反应(Maillardreaction,MR)是指食品中羰基化合物与氨基化合物发生的羰氨缩合反应[1],又称蛋白质或氨基酸的糖基化改性反应。美拉德反应不但可以改善食品的颜色和风味,而且其反应产物还具有抗氧化活性等,Hodge[2]认为美拉德反应会生成类黑精色素及其他高分子杂环化合物;孙常雁等[3]研究发现乳清蛋白肽的美拉德反应产物(MRPs)具有较强的总还原力、羟基自由基清除能力,且抗氧化活性随着乳清蛋白肽美拉德反应产物质量浓度的增加而加强;刘蒙蒙[4]研究发现罗非鱼皮胶原蛋白肽—葡萄糖MRPs抗氧化活性随加热时间的延长以及葡萄糖浓度增加而提高,且在碱性介质中产物活性较高;钱森和等[5]发现美拉德反应能够有效增强芝麻多肽的抗氧化活性;项惠丹等[6]研究发现大豆分离蛋白与还原糖反应的MRPs抗氧化性均低于酪蛋白制备的MRPs,且两种MRPs都有较强的抗氧化活性;Lertittikul等[7]在研究猪血红蛋白和葡萄糖发生美拉德反应后,发现不同pH和加热时间对MRPs的抗氧化能力都有显著影响。Dong等[8]研究发现水解β-乳球蛋白与葡萄糖经美拉德反应后,MRPs的抗氧化能力显著提高。
现有研究主要集中在某单一的反应物种类及反应条件对MRPs的抗氧化活性的影响,尚未见对反应物种类和反应条件对MRPs抗氧化活性的影响进行系统研究的报道。试验拟将酪蛋白碱性蛋白酶的酶解产物与还原糖(葡萄糖、果糖、木糖)在不同反应pH、温度和时间下建立糖基化反应体系,系统分析还原糖种类和反应条件对酪蛋白碱性蛋白酶的酶解产物糖基化产物的抗氧化活性的影响,并优化反应条件,以期对今后的糖基化产物的应用提供参考。
1 材料与方法
1.1 试验材料
酪蛋白:生化试剂,天津市大茂化学试剂厂;
2709碱性蛋白酶(2.0×105U/g):生化试剂,北京鸿润宝顺科技有限公司;
葡萄糖、果糖、木糖:分析纯,山东省龙力生物科技股份有限公司;
水杨酸:分析纯,国药集团化学试剂有限公司;
硫酸亚铁、抗坏血酸、磷酸盐缓冲液、铁氰化钾、三氯乙酸、氯化铁、过氧化氢:分析纯,天津市大茂化学试剂厂。
1.2 试验仪器
紫外分光光度计:INESA-L5型,上海仪电分析仪器有限公司;
油浴锅:DF-1型,金坛市虹盛仪器厂;
分析天平:BSA124S型,赛多利斯科学仪器(北京)有限公司;
水浴锅:XMTD-204型,江苏科析仪器有限公司。
1.3 试验方法
1.3.1 酪蛋白碱性蛋白酶酶解产物的制备 将酪蛋白与蒸馏水配制成质量浓度为5%的溶液,然后用1 mol/L NaOH调pH至10,加入4 000 U/mL的碱性蛋白酶,在55 ℃酶解3 h,然后在90 ℃水浴10 min,即得酪蛋白酶解液,酶解液冷冻干燥备用。
1.3.2 糖基化改性的单因素试验设计 以反应产物抗氧化活性为指标,进行单因素试验条件的筛选。按糖与酪蛋白质量比为2∶1的比例,准确称量2 g葡萄糖、木糖和果糖分别溶于酪蛋白碱性蛋白酶酶解产物溶液中,进行糖基化改性。待完全溶解后调pH为7.0,8.0,9.0,10.0,在110 ℃下反应2 h,确定最佳pH;调pH为10.0,在100,110,120,130 ℃恒温下反应2 h,确定最佳反应温度;调pH为10.0,在110 ℃恒温下反应2,3,4,5 h,确定最佳反应时间。以上每个处理做3次重复。
1.3.3 正交试验设计 在单因素试验的基础上,选取最优还原糖、pH、温度和时间,每个单因素确定3个较优水平。采用三因素三水平正交试验设计,以选择最优抗氧化的糖基化反应条件。
1.3.4 糖基化改性产物抗氧化活性的测定
(1) 清除羟基自由基活性:取50 μL糖基化反应产物(0.05 g/mL),加水定容至2 mL,稀释40倍,剩余步骤见文献[9]。
(2) 还原力:取20 μL糖基化反应产物(0.05 g/mL),加水定容至2 mL,稀释100倍,剩余步骤见文献[9]。
以未经处理的酪蛋白酶解液为对照样品。
1.3.5 统计分析方法 用Microsoft Excel 2010及IBM SPSS Statistics 22.0进行统计分析。
2 结果与分析
2.1 pH对糖基化产物羟基自由基清除率和还原力的影响
如表1所示,酶解产物与木糖、果糖的糖基化产物的羟基自由基清除能力在pH 7.0时最高,分别是38.63%和32.82%,高于对照且与其他试验组差异显著(P<0.05)。与葡萄糖的糖基化产物的羟基自由基清除能力随pH的升高变化无规律,其中pH 7.0和pH 9.0之间差异不显著(P>0.05),而pH 9.0和 pH 10.0之间差异显著(P<0.05);在pH 10.0时清除率最高为25.67%,但仍低于对照,说明葡萄糖和酪蛋白酶解物糖基化产物的自由基清除率较低。可以初步推断,葡萄糖并不适于通过糖基化来提高酪蛋白水解产物抗氧化性。综上所述,pH 7.0是木糖和果糖通过糖基化来提高酪蛋白水解产物抗氧化性的最佳pH。
表1pH对不同还原糖糖基化产物羟基自由基清除率的影响†
Table1EffectsofpHonthescavengingrateofhydroxylradicalsofdifferentreducingsugarsglycosylationproducts %

pH值葡萄糖木糖果糖7.020.87±0.49b38.63±3.70a32.82±1.46a8.023.13±3.09ab32.67±1.79b22.80±1.97b9.020.33±0.40b30.90±1.55b18.27±6.88b10.025.67±0.68a33.00±2.46b24.13±4.06b
† 对照样品对羟基自由基清除率为(29.02±1.57)%;同列字母不同表示差异显著(P<0.05)。
从表2可以看出,酪蛋白酶解物与3种糖的糖基化产物的还原能力在试验pH范围内差异基本不显著(P>0.05)(果糖在pH 7.0还原力偏低)。结合表1、2,pH 7.0是葡萄糖、木糖通过糖基化来提高酪蛋白水解产物抗氧化性的最佳pH。
表2pH对不同还原糖糖基化产物还原能力的影响†
Table2EffectsofpHonthereducingpowerofdifferentreducingsugarsglycosylationproducts
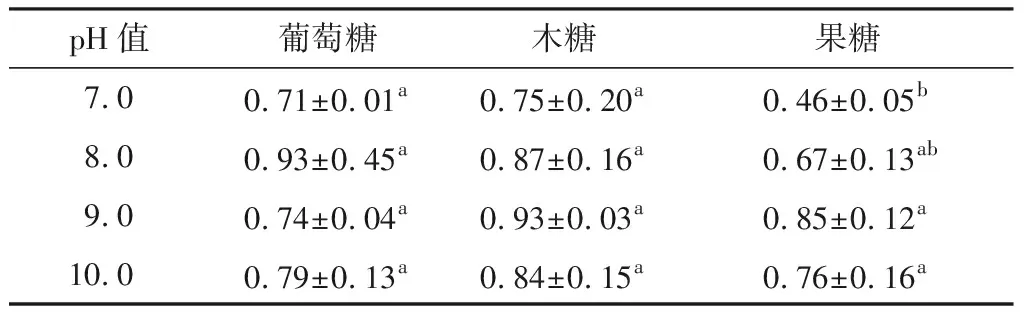
pH值葡萄糖木糖果糖7.00.71±0.01a0.75±0.20a0.46±0.05b8.00.93±0.45a0.87±0.16a0.67±0.13ab9.00.74±0.04a0.93±0.03a0.85±0.12a10.00.79±0.13a0.84±0.15a0.76±0.16a
† 对照样品还原力0.63±0.03;同列字母不同表示差异显著(P<0.05)。
2.2 温度对糖基化产物羟基自由基清除率和还原能力的影响
由表3、4可知,当温度由100 ℃升至110 ℃时,酪蛋白酶解物与3种糖的糖基化产物羟基自由基清除率随温度的提高变化差异基本不显著(除果糖略有差异外),还原能力随温度的变化差异也不显著;但均显著低于120 ℃和130 ℃的结果(P>0.05);3种糖的糖基化产物的羟基自由基清除率均低于对照,而还原能力低于或略大于对照。当温度由120 ℃升至130 ℃时糖基化产物的羟基自由基清除率和还原力均高于对照。
章银良等[10]研究温度对酪蛋白—木糖美拉德反应产物抗氧化性的影响时,发现随着温度的升高,糖基化产物的羟基自由基清除能力和还原力都增强;刘海梅等[11]发现,随着温度的升高,葡萄糖—牡蛎酶解液的糖基化产物还原力增强,与试验结果基本一致。综上所述,120~130 ℃ 是葡萄糖、木糖和果糖通过糖基化来提高酪蛋白水解产物抗氧化性的最适温度范围。
表3温度对不同还原糖糖基化产物羟基自由基清除率的影响†
Table3Effectsoftemperatureonhydroxylradicalscavengingrateofdifferentreducingsugarsglycosylationproducts %
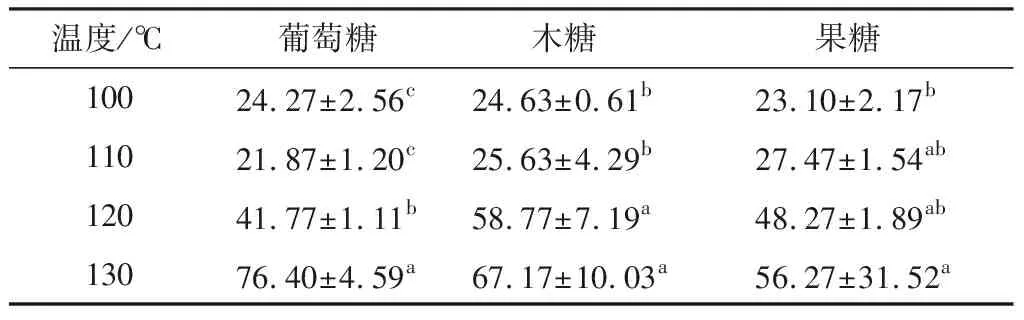
温度/℃葡萄糖木糖果糖10024.27±2.56c24.63±0.61b23.10±2.17b11021.87±1.20c25.63±4.29b27.47±1.54ab12041.77±1.11b58.77±7.19a48.27±1.89ab13076.40±4.59a67.17±10.03a56.27±31.52a
† 对照样品对羟基自由基清除率为(29.02±1.57)%;同列字母不同表示差异显著(P<0.05)。
表4温度对不同还原糖糖基化产物还原能力的影响†
Table4Effectsoftemperatureonthereducingpowerofdifferentreducingsugarsglycosylationproducts

温度/℃葡萄糖木糖果糖1000.51±0.09b0.97±0.17c0.64±0.12b1100.54±0.15b0.56±0.14c0.64±0.17b1201.73±0.07a1.45±0.39b0.82±0.18ab1302.00±0.26a2.24±0.05a1.09±0.34a
† 对照样品还原力0.63±0.03;同列字母不同表示差异显著(P<0.05)。
2.3 反应时间对糖基化产物羟基自由基清除率和还原能力的影响
反应时间对糖基化产物的羟基自由基清除率和还原能力的影响见表5、6。在反应前4 h内,酪蛋白酶解物与3种糖的糖基化产物的羟基自由基清除率和还原力基本随反应时间的延长而增加;在4 h时,3种糖的糖基化产物的羟基自由基清除率和还原力均达到最高,且均显著高于对照(P<0.05)。3种糖的糖基化产物,在反应3 h和 4 h时的羟基自由基清除率均高于对照,虽然果糖3 h的糖基化产物在检测羟基自由基清除率是误差较大,但是与还原力检测结果一致,在反应2~3 h时都无显著差异(P>0.05);在反应2~5 h时的还原能力均高于对照。这是因为美拉德反应达到一定时间后,美拉德反应中间产物与氨基化合物进行醛基-氨基反应最终生成类黑精,类黑精具有抗氧化等活性。4 h后有所下降,可能是长时间加热后导致还原性物质分解所致[12]。江连洲等[13]研究葡聚糖糖基化处理对绿豆蛋白抗氧化性影响时,发现反应开始时羟自由基清除能力迅速提升,之后随着反应时间的延长呈现下降趋势。赵晶等[14]发现,随着时间的延长,酪蛋白酶解物与还原糖糖基化产物的还原力呈现先增加后降低的趋势。两者研究结果与试验结果一致。综上所述,反应时间4 h时,3种糖与酪蛋白酶解物的糖基化产物的羟基自由基清除率和还原能力最优。
表5时间对不同还原糖糖基化产物羟基自由基清除率的影响
Table5Effectsoftimeonhydroxylradicalscavengingrateofdifferentreducingsugarsglycosylationproducts %
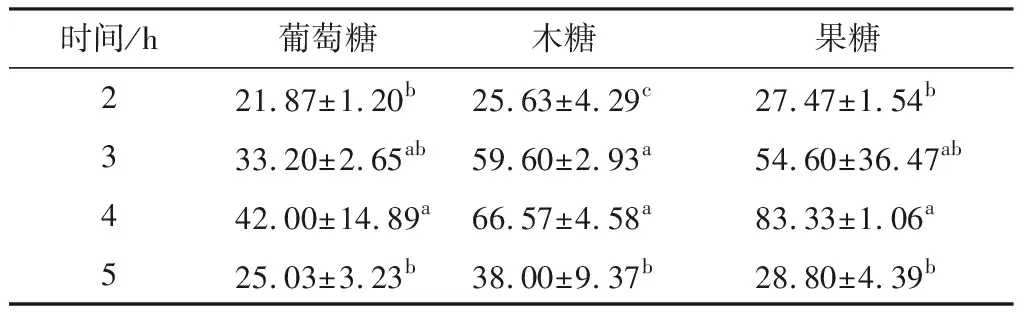
时间/h葡萄糖木糖果糖221.87±1.20b25.63±4.29c27.47±1.54b333.20±2.65ab59.60±2.93a54.60±36.47ab442.00±14.89a66.57±4.58a83.33±1.06a525.03±3.23b38.00±9.37b28.80±4.39b
† 对照样品对羟基自由基清除率为(29.02±1.57)%;同列字母不同表示差异显著(P<0.05)。
表6时间对不同还原糖糖基化产物还原能力的影响†
Table6Effectsoftimeonthereducingpowerofdifferentreducingsugarsglycosylationproducts

时间/h葡萄糖木糖果糖20.80±0.16b0.83±0.19b0.90±0.13ab30.78±0.14b0.88±0.11b0.83±0.19b41.05±0.15a1.12±0.05a1.14±0.19a50.55±0.02b0.70±0.05b0.64±0.04b
† 对照样品还原力0.63±0.03;同列字母不同表示差异显著(P<0.05)。
2.4 糖基化改性工艺的优化
Wang等[15]研究发现乳清蛋白分离物与6种糖(葡萄糖、乳糖、木糖、果糖、蔗糖、麦芽糖)进行美拉德反应后,乳清蛋白分离物与木糖产生的糖基化产物抗氧化活性最高,其研究结果与试验结果一致。所以正交试验选用木糖与酪蛋白酶解物进行糖基化反应。正交试验因素水平取值见表7,试验设计及结果见表8。
由表8可知:影响糖基化产物羟基自由基清除率的主次因素为C>B>A。影响糖基化产物还原力的主次因素为B>C>A。酪蛋白酶解产物与木糖反应产生糖基化产物羟基自由基清除率和还原能力的优化水平分别为A2B3C2和A2B2C2。
分别在温度130 ℃、pH 7.5、时间4 h(A2B3C2)和温度130 ℃、pH 7.0、时间4 h(A2B2C2)的条件下进行3次平行验证实验。结果表明,A2B3C2的羟基自由基清除率为82%,还原率为1.489;A2B2C2的羟基自由基清除率为71%,还原率为1.340。因此,确定抗氧化活性最强的反应条件为A2B3C2,即温度130 ℃、pH 7.5、时间4 h。
3 结论
研究结果表明,通过糖基化改性可以提高酪蛋白酶解物的抗氧化性;酪蛋白酶解产物与木糖糖基化改性产物的抗氧化活性最强,最优的抗氧化反应条件为温度130 ℃、pH 7.5、时间4 h。试验所涉及到的单糖种类较少,未来还可以利用其他糖类,例如半乳糖、麦芽糖、乳糖、淀粉、纤维素等进行深入研究,从而将酪蛋白水解物的抗氧化性提高,充分发挥酪蛋白水解物的抗氧化性在各类食品中的作用。
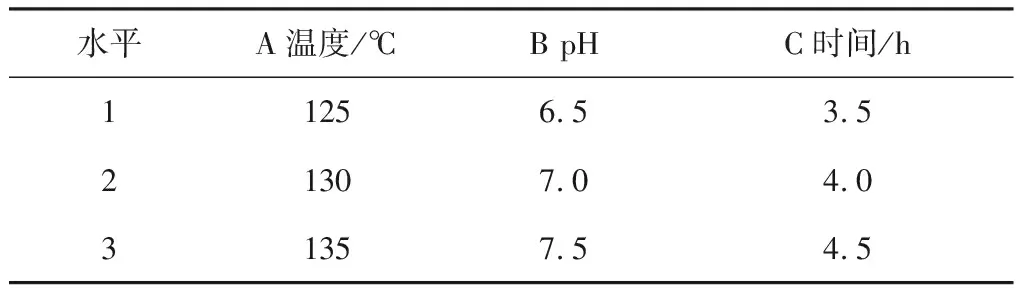
表7 正交试验因素水平表

表8 正交试验设计及结果分析表

